名校
1 . 元素X、Q、Y、Z、M、R均为短周期主族元素,且原子序数依次增大。已知Y原子最外层电子数与核外电子总数之比为3:4,M原子的最外层电子数与次外层电子数之比为3:4;R-、Z+、X+离子半径逐渐减小;化合物XR常温下为气体,Q和Y在周期表中的位置相邻,请回答下列问题:
(1)M在元素周期表中的位置_________________ ,写出Z的离子结构示意图___________ 。
(2)写出X、Y、R按原子个数之比1:1:1形成的化合物的电子式________________ 。
(3)X与Y可分别形成10电子和18电子的分子,写出该18电子分子转化成10电子分子的化学方程式__________________________________ 。
(4)写出单质R的一种工业用途_______________________ 。
(5)下图表示由上述元素中的某两种元素组成的气体分子在一定条件下的密闭容器中充分反应前后的转化关系,写出该转化过程的化学方程式为____________________ 。
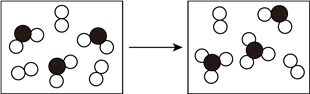
(6)由X、Y、Z、M四种元素组成的一种离子化合物A,已知A,既能与盐酸反应,又能与氢氧化钠溶液反应,还能和氯水反应,写出A与氯水反应的离子方程式___________ 。
(7)科学家认为存在QX5这种物质,且预测其与水剧烈反应放出气体,所得水溶液呈弱碱性,写出该反应的化学方程式___________________________ ,已知QX5中含有离子键和极性键,写出它的电子式______________ 。
(1)M在元素周期表中的位置
(2)写出X、Y、R按原子个数之比1:1:1形成的化合物的电子式
(3)X与Y可分别形成10电子和18电子的分子,写出该18电子分子转化成10电子分子的化学方程式
(4)写出单质R的一种工业用途
(5)下图表示由上述元素中的某两种元素组成的气体分子在一定条件下的密闭容器中充分反应前后的转化关系,写出该转化过程的化学方程式为

(6)由X、Y、Z、M四种元素组成的一种离子化合物A,已知A,既能与盐酸反应,又能与氢氧化钠溶液反应,还能和氯水反应,写出A与氯水反应的离子方程式
(7)科学家认为存在QX5这种物质,且预测其与水剧烈反应放出气体,所得水溶液呈弱碱性,写出该反应的化学方程式
您最近一年使用:0次
解题方法
2 . 153年前门捷列夫制得世界上第一张元素周期表,它反映了元素之间的内在联系,是对元素的一种很好的自然分类。如图为现代元素周期表的一部分,请回答下列问题:(以下问题均用相应的化学用语表达)
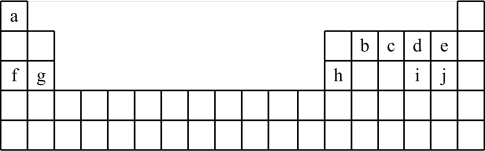
(1)在这10种元素中,非金属性最强的元素在周期表中的位置是______ 。
(2)由a、d、f三种元素形成的化合物含有的化学键有______ (填写化学键类型),属于______ 化合物。
(3)元素b、c形成的简单气态氢化物中较稳定的是_____ ;d、h、i、j的简单离子半径由大到小的顺序排列为_____ 。
(4)用电子式表示c2的形成过程_____ 。
(5)在含有a、g、h简单阳离子的100mL溶液中,逐滴滴加5mol/L的NaOH溶液到过量,生成沉淀的质量与加入的NaOH溶液的体积关系如图所示。由图中数据分析计算:
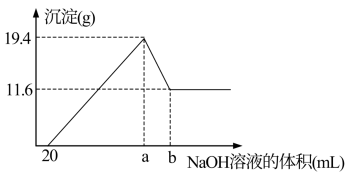
①沉淀减少时发生的离子方程式:______ 。
②a点的数值为:______ mL。

(1)在这10种元素中,非金属性最强的元素在周期表中的位置是
(2)由a、d、f三种元素形成的化合物含有的化学键有
(3)元素b、c形成的简单气态氢化物中较稳定的是
(4)用电子式表示c2的形成过程
(5)在含有a、g、h简单阳离子的100mL溶液中,逐滴滴加5mol/L的NaOH溶液到过量,生成沉淀的质量与加入的NaOH溶液的体积关系如图所示。由图中数据分析计算:

①沉淀减少时发生的离子方程式:
②a点的数值为:
您最近一年使用:0次
名校
解题方法
3 . 短周期元素X、Y、Z、W的原子序数递增,且Z为金属元素,X、W同主族。单质X、Z、W可分别与单质Y化合生成最高价化合物甲、乙、丙。结合如图转化关系,下列判断正确的是
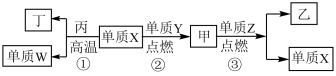

A.反应①可表示为 | B.X位于元素周期表第二周期V主族 |
| C.甲、丙、丁均为酸性氧化物 | D.乙的电子式为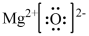 |
您最近一年使用:0次
2022-04-23更新
|
1006次组卷
|
3卷引用:湖北省鄂东南联盟学校2021-2022学年高一下学期期中联考化学试题
4 . 短周期元素W、X、Y、Z的原子序数依次增大,m、p、q、r、s是由这些元素组成的二元化合物。常温常压下r为液体,其余均为无色气体,m的摩尔质量为p的2倍,n是元素Y的单质,q能使品红溶液褪色;m、n、p、q、r、s之间的转化关系如图所示。请根据以上信息回答下列问题:

(1)元素Z在周期表中的位置为________ 。
(2)化合物p的电子式为_________ ;X、Y、Z的原子半径由大到小的顺序为______ (用元素符号表示)。
(3)n与p反应生成r、s的化学方程式为__________ 。
(4)m、p、r中稳定性最好的是_______ (填化学式),理由是___________ 。

(1)元素Z在周期表中的位置为
(2)化合物p的电子式为
(3)n与p反应生成r、s的化学方程式为
(4)m、p、r中稳定性最好的是
您最近一年使用:0次
5 . A、B、C、D、E是中学化学常见单质, X、Y、Z、M、N、W、H、K是常见化合物,X是B和C的化合产物,它们之间有如下转化关系 (反应物和产物中的H2O已略去):
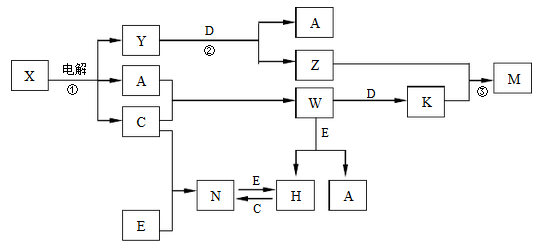
(1)Y的电子式为____________ ,构成E单质的元素在周期表中的位置_____________ 。
(2)反应②的离子方程式为_____________________ 。
(3)足量C通入Y的溶液中可得到一种常见的消毒剂。在该消毒剂中通入少量CO2可得一种酸式盐,从酸性强弱角度请你写出得到的结论:_______________________ 。
(4)①写出检验N中阳离子常用的试剂名称___________________ ,N也可用来净水,请写出相关离子方程式________________________ 。
②H的溶液在空气中久置,会变浑浊,请写出相关离子方程式_____________
(5)C可用来制取漂白粉,为测定漂白粉中有效成分的含量,某小组进行了如下实验:称取漂白粉2.0g,研磨后溶解,配制成250mL溶液,取出25.00mL加入到锥形瓶中,再加入过量的KI溶液和过量的硫酸,此时发生的离子方程式为_____________ (不考虑生成CaSO4):
静置。待完全反应后,用1mol·L-1的Na2S2O3溶液做标准溶液滴定反应生成的碘,已知反应式为:2Na2S2O3+I2=Na2S4O6+2NaI,共用去Na2S2O3溶液20.00mL。则该漂白粉中有效成分的质量分数为__________ (保留到小数点后两位)。

(1)Y的电子式为
(2)反应②的离子方程式为
(3)足量C通入Y的溶液中可得到一种常见的消毒剂。在该消毒剂中通入少量CO2可得一种酸式盐,从酸性强弱角度请你写出得到的结论:
(4)①写出检验N中阳离子常用的试剂名称
②H的溶液在空气中久置,会变浑浊,请写出相关离子方程式
(5)C可用来制取漂白粉,为测定漂白粉中有效成分的含量,某小组进行了如下实验:称取漂白粉2.0g,研磨后溶解,配制成250mL溶液,取出25.00mL加入到锥形瓶中,再加入过量的KI溶液和过量的硫酸,此时发生的离子方程式为
静置。待完全反应后,用1mol·L-1的Na2S2O3溶液做标准溶液滴定反应生成的碘,已知反应式为:2Na2S2O3+I2=Na2S4O6+2NaI,共用去Na2S2O3溶液20.00mL。则该漂白粉中有效成分的质量分数为
您最近一年使用:0次
2011·湖北·一模
解题方法
6 . 有关物质存在如图所示转化关系(部分产物已略去)。

已知A、B是均能使澄清石灰水变浑浊的气体。M为无色液体,常用作有机溶剂,其结构与A相似且为非极性分子。C、E均难溶于水且E难溶于酸。
(1)单质N在X中燃烧可形成一种具有磁性的黑色物质,则构成N的元素在周期表中的位置为___________________________________ 。
(2)M的电子式为_______________________ ,Y的化学式为____________________ 。
(3)①写出离子方程式:A→C________________________________________________
②检验O中阴离子的方法为____________________________________________________________________________
(4)将M滴入O溶液中,观察到溶液变浑浊,请推断反应的化学方程式:___________________________________________ 。

已知A、B是均能使澄清石灰水变浑浊的气体。M为无色液体,常用作有机溶剂,其结构与A相似且为非极性分子。C、E均难溶于水且E难溶于酸。
(1)单质N在X中燃烧可形成一种具有磁性的黑色物质,则构成N的元素在周期表中的位置为
(2)M的电子式为
(3)①写出离子方程式:A→C
②检验O中阴离子的方法为
(4)将M滴入O溶液中,观察到溶液变浑浊,请推断反应的化学方程式:
您最近一年使用:0次



