22-23高一·全国·课时练习
1 . 下列关于有机物的说法正确的是
| A.乙烯的分子式为CH2=CH2 |
| B.甲烷的结构简式为CH4 |
| C.乙炔的结构简式为C2H2 |
| D.乙烯能使酸性KMnO4溶液褪色说明它具有漂白性 |
您最近一年使用:0次
2023-01-31更新
|
1104次组卷
|
5卷引用:7.2.2 烃及有机高分子材料——同步学习必备知识
(已下线)7.2.2 烃及有机高分子材料——同步学习必备知识8.1.2石油炼制乙烯(课后)-2019苏教版必修2课前课中课后黑龙江省哈尔滨市第四中学校2022-2023学年高一下学期期中考试化学试题(已下线)考点巩固卷10 有机化学基础(一)(3大考点60题)-2024年高考化学一轮复习考点通关卷(新高考通用)湖南省岳阳市岳阳楼区2022-2023学年高一下学期期末考试化学试题
名校
2 . 短周期主族元素A、B、C、D、E、F、G的原子序数依次增大,在元素周期表中A的原子半径最小,B与C相邻且 的最外层电子数是次外层的3倍,D为同周期中金属性最强的元素,C、F同主族,E是地壳中含量最多的金属元素。回答下列问题:
的最外层电子数是次外层的3倍,D为同周期中金属性最强的元素,C、F同主族,E是地壳中含量最多的金属元素。回答下列问题:
(1)C在元素周期表中的位置为第_______ 周期_______ 族,G的元素符号是_______ 。
(2)B的原子结构示意图为_______
(3)比较 和
和 离子半径大小:
离子半径大小:_______ (用离子符号表示);
(4)比较 和
和 简单氢化物的热稳定性强弱:
简单氢化物的热稳定性强弱:_______ (用化学式表示)。
(5) 和
和 的最高价氧化物的水化物酸性较强的是
的最高价氧化物的水化物酸性较强的是_______ (用化学式表示)。
(6) 的氧化物与
的氧化物与 的最高价氧化物对应水化物的溶液反应的离子方程式为
的最高价氧化物对应水化物的溶液反应的离子方程式为_______ 。
 的最外层电子数是次外层的3倍,D为同周期中金属性最强的元素,C、F同主族,E是地壳中含量最多的金属元素。回答下列问题:
的最外层电子数是次外层的3倍,D为同周期中金属性最强的元素,C、F同主族,E是地壳中含量最多的金属元素。回答下列问题:(1)C在元素周期表中的位置为第
(2)B的原子结构示意图为
(3)比较
 和
和 离子半径大小:
离子半径大小:(4)比较
 和
和 简单氢化物的热稳定性强弱:
简单氢化物的热稳定性强弱:(5)
 和
和 的最高价氧化物的水化物酸性较强的是
的最高价氧化物的水化物酸性较强的是(6)
 的氧化物与
的氧化物与 的最高价氧化物对应水化物的溶液反应的离子方程式为
的最高价氧化物对应水化物的溶液反应的离子方程式为
您最近一年使用:0次
2023-01-22更新
|
476次组卷
|
2卷引用:作业(二十五) 元素周期表和元素周期律的应用
名校
3 . X、Y、Z、J、R、Q六种短周期主族元素,原子序数依次增大。元素Z在地壳中含量最高,Y的简单氢化物水溶液呈碱性,J元素的焰色试验呈黄色,X能与J形成离子化合物,且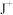 的半径大于
的半径大于 的半径,R的周期序数等于主族序数,Q的最外层电子数与其电子总数之比为
的半径,R的周期序数等于主族序数,Q的最外层电子数与其电子总数之比为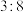 。请回答:
。请回答:
(1)Q元素在周期表中的位置为_______ 。
(2)六种元素原子半径最大的是_______ ,简单离子半径最大的是_______ 。(填元素符号)。
(3)元素的非金属性Z_______ (填“>”或“<”)Q。下列各项中,不能说明这一结论的事实有_______ (填字母)。
A.Q的氢化物的水溶液放置在空气中会变浑浊
B.Z与Q之间形成的化合物中元素的化合价
C.Z和Q的单质的状态
D.Z和Q在周期表中的位置
(4)R的最高价氧化物与J的最高价氧化物的水化物反应的化学方程式_______ 。
(5)X与Z简单化合物的空间构型为_______ ,用电子式表示X与J化合物的形成过程_______ ;X与Q在一定条件下可以形成极不稳定的原子个数比为 的化合物,该化合物分子中既有极性键又有非极性键,写出该分子的结构式:
的化合物,该化合物分子中既有极性键又有非极性键,写出该分子的结构式:_______ 。
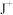 的半径大于
的半径大于 的半径,R的周期序数等于主族序数,Q的最外层电子数与其电子总数之比为
的半径,R的周期序数等于主族序数,Q的最外层电子数与其电子总数之比为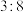 。请回答:
。请回答:(1)Q元素在周期表中的位置为
(2)六种元素原子半径最大的是
(3)元素的非金属性Z
A.Q的氢化物的水溶液放置在空气中会变浑浊
B.Z与Q之间形成的化合物中元素的化合价
C.Z和Q的单质的状态
D.Z和Q在周期表中的位置
(4)R的最高价氧化物与J的最高价氧化物的水化物反应的化学方程式
(5)X与Z简单化合物的空间构型为
 的化合物,该化合物分子中既有极性键又有非极性键,写出该分子的结构式:
的化合物,该化合物分子中既有极性键又有非极性键,写出该分子的结构式:
您最近一年使用:0次
2023-01-16更新
|
324次组卷
|
3卷引用:微专题(八) ——元素综合推断
名校
4 . 反应3Cl2+8NH3=N2+6NH4Cl常用于检验运输氯气的管道是否发生泄漏。下列表示反应中相关微粒的化学用语正确的是
A.中子数为18的氯原子: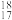 Cl Cl |
B.用电子式表示氨气分子的形成过程: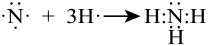 |
| C.N2的结构式:N=N |
| D.NH4Cl中有离子键和非极性键 |
您最近一年使用:0次
名校
解题方法
5 . 化合物 X2Y 是由具有相同电子层结构的正负离子构成,该化合物可能是
| A.Na2O | B.N2O | C.CaF2 | D.K2O |
您最近一年使用:0次
6 . 《石雅》云:“青金石色相如天,或复金屑散乱,光辉灿烂,若众星丽于天也”。青金石的化学组成可表示为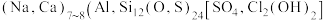 。回答下列问题:
。回答下列问题:
(1)硅在元素周期表中的位置是_______ ;铝离子的结构示意图为_______ 。
(2) 的电子式为
的电子式为_______ 。写出一种由青金石中非金属元素组成的既含有极性键又含有非极性键的物质的分子式_______ 。
(3)青金石所含的短周期元素中,金属性最强的是_______ ,非金属元素原子半径由大到小的顺序为_______ 。S、Cl、Ca、Al、Na、O六种元素离子半径由大到小的顺序为_______ 。
(4)Be与Al的化学性质相似,则Al与NaOH溶液反应的化学方程式是_______ 。
(5)下列不能说明氯元素的非金属性比硫元素强的是_______(填字母)。
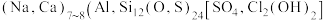 。回答下列问题:
。回答下列问题:(1)硅在元素周期表中的位置是
(2)
 的电子式为
的电子式为(3)青金石所含的短周期元素中,金属性最强的是
(4)Be与Al的化学性质相似,则Al与NaOH溶液反应的化学方程式是
(5)下列不能说明氯元素的非金属性比硫元素强的是_______(填字母)。
| A.氯、硫的最低负价分别为-1、-2 |
| B.硫化氢在300℃时开始分解,HCl在1500℃时开始缓慢分解 |
C. 的酸性比 的酸性比 的强 的强 |
D.向 水溶液中通入 水溶液中通入 有淡黄色沉淀生成 有淡黄色沉淀生成 |
您最近一年使用:0次
2023-01-13更新
|
234次组卷
|
2卷引用:章末检测卷(四) 物质结构 元素周期律
名校
7 . 下列化学用语正确的是
A.氮分子的电子式: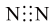 | B.硫原子的结构示意图: |
C.溴化钠的电子式: | D.水分子的结构式: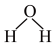 |
您最近一年使用:0次
2023-01-04更新
|
343次组卷
|
23卷引用:苏教2020版化学必修第一册专题5 微观结构与物质的多样性 第二单元 微粒之间的相互作用力课后习题
苏教2020版化学必修第一册专题5 微观结构与物质的多样性 第二单元 微粒之间的相互作用力课后习题(已下线)2009—2010学年河北冀州中学高一下学期期中考试化学卷(已下线)09-10年合肥六中高一下学期期末模拟考试化学卷(已下线)2010年河北省蔚县一中高一下学期期末考试化学试题(已下线)2010—2011学年江苏省黄桥中学高一第二学期期末复习化学试题2(已下线)2011-2012学年江苏省江阴市一中高二上学期期中考试化学(必修)试卷(已下线)2010-2011学年江苏省南京实验国际学校高一下学期期中考试化学试卷(已下线)2011-2012学年浙江省嘉兴八校高一下学期期中联考化学试卷(已下线)2011-2012学年江苏省盐城中学高一下学期期中考试化学试卷(已下线)2011-2012学年河北省邯郸市高一下学期期末教学质量检测化学试卷(已下线)2012-2013学年浙江省桐乡一中高一下学期期中考试化学理科试卷(已下线)2012-2013学年浙江瑞安市瑞祥高级中学高一下学期期中考试化学试卷2014-2015学年北京市房山区周口店中学高一下期中考试化学试卷2016-2017学年江西省上高县第二中学高一4月(第六次)月考化学试卷黑龙江省虎林市高级中学2016-2017学年高一5月月考化学试题湖南省邵阳市第二中学2016-2017学年高一下学期期末考试(理)化学试题湖南省邵阳市第二中学2016-2017学年高一下学期期末考试(文)化学试题贵州省遵义市第四中学2017-2018学年高二上学期期中考试化学(文)试题吉林省公主岭市范家屯镇第一中学2018-2019学年高二下学期期中考试化学试题黑龙江省青冈县一中2018-2019学年高一下学期期末考试(B班)化学试题陕西省西安市临潼区2021-2022学年高一下学期期末质量检测化学试题辽宁省沈阳市第二中学2022-2023学年高一上学期期末考试化学试题江苏省无锡市第一中学2023-2024学年高一上学期艺术班期末化学试题
22-23高一上·全国·课时练习
解题方法
8 . 元素、原子半径、化合价的变化规律
(1)原子结构的变化规律
(2)原子半径的变化规律
(1)原子结构的变化规律
| 原子序数 | 电子层数 | 最外层电子数 | 达到稳定结构时的最外层电子数 |
1~2 | 1→2 | ||
3~10 | 1→8 | ||
11~18 | 1→8 | ||
| 结论:随着原子序数的递增,元素原子核外的电子排布呈现 | |||
(2)原子半径的变化规律
| 3~10号元素符号 | Li | Be | B | C | N | O | F | Ne |
| 原子半径/pm | 152 | 89 | 82 | 77 | 75 | 74 | 71 | - |
| 变化趋势 |  逐渐 逐渐 | |||||||
| 11~18号元素符号 | Na | Mg | Al | Si | P | S | Cl | Ar |
| 原子半径/pm | 186 | 160 | 143 | 117 | 110 | 102 | 99 | - |
| 变化趋势 |  逐渐 逐渐 | |||||||
| 结论:随着原子序数的递增,元素原子的半径呈现 | ||||||||
您最近一年使用:0次
名校
9 . 下表是某些短周期元素的电负性数值(鲍林标度)。
(1)根据表中数据归纳元素的电负性的变化规律。__________
(2)试推测,前四周期元素中电负性最小的元素与电负性最大的元素分别是__________ 元素,写出这两种元素形成的化合物的电子式__________ 。
(3)预测 元素电负性的范围
元素电负性的范围__________ 。
(4)一般认为,如果两种成键元素之间的电负性差值大于1.7,它们的原子之间通常形成离子键,电负性差值小于1.7通常形成共价键。请据此预测 属于离子化合物还是共价化合物
属于离子化合物还是共价化合物__________ 。
| 元素符号 |  |  | N | O | F |  |  |  | P | S |  |
| 电负性数值 | 1.0 | 1.5 | 3.0 | 3.5 | 4.0 | 0.9 | 1.2 | 1.5 | 2.1 | 2.5 | 3.0 |
(2)试推测,前四周期元素中电负性最小的元素与电负性最大的元素分别是
(3)预测
 元素电负性的范围
元素电负性的范围(4)一般认为,如果两种成键元素之间的电负性差值大于1.7,它们的原子之间通常形成离子键,电负性差值小于1.7通常形成共价键。请据此预测
 属于离子化合物还是共价化合物
属于离子化合物还是共价化合物
您最近一年使用:0次
2022-11-27更新
|
246次组卷
|
2卷引用:2019鲁科版高中化学选择性必修2第1章第3节 原子结构与元素性质课后习题
解题方法
10 . 下列选项中,所叙述的粒子按半径由大到小排列时,顺序正确的是
①基态X的原子结构示意图为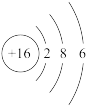
②基态Y原子的价电子排布式为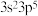
③基态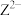 的轨道表示式为
的轨道表示式为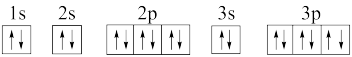
④基态T原子有2个电子层,电子式为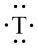
①基态X的原子结构示意图为

②基态Y原子的价电子排布式为
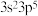
③基态
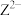 的轨道表示式为
的轨道表示式为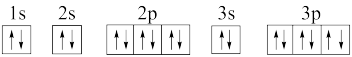
④基态T原子有2个电子层,电子式为
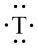
A.① ② ② ③ ③ ④ ④ | B.③ ④ ④ ① ① ② ② |
C.③ ① ① ② ② ④ ④ | D.① ② ② ④ ④ ③ ③ |
您最近一年使用:0次
2022-11-27更新
|
350次组卷
|
3卷引用:2019鲁科版高中化学选择性必修2第1章第3节 原子结构与元素性质课后习题



