10-11高三上·福建厦门·阶段练习
名校
1 . 在上海召开的第七届全球人类基因大会上,我国科学家第一次提出可以用砒霜(As2O3)来治疗早期幼粒白血病。
(1)完成并配平下列化学方程式:_____________
As2O3+ Zn+ H2SO4 → AsH3+ ZnSO4+ ______
(2)As2O3在上述反应中显示出来的性质是_____________ 。
A.氧化性 B.还原性 C.酸性 D.碱性
(3)若生成0.1 mol AsH3,则转移电子的物质的量为___________ mol。
(1)完成并配平下列化学方程式:
As2O3+ Zn+ H2SO4 → AsH3+ ZnSO4+ ______
(2)As2O3在上述反应中显示出来的性质是
A.氧化性 B.还原性 C.酸性 D.碱性
(3)若生成0.1 mol AsH3,则转移电子的物质的量为
您最近一年使用:0次
2018-12-11更新
|
125次组卷
|
4卷引用:宁夏固原市隆德县2020-2021学年高一上学期期末考试化学试题
宁夏固原市隆德县2020-2021学年高一上学期期末考试化学试题(已下线)2010年福建省厦门市杏南中学高三上学期10月月考化学卷福建省惠安惠南中学2019届高三上学期期中考试化学试题【全国百强校】山东省泰安市第一中学2019届高三上学期12月学情诊断化学试题
名校
解题方法
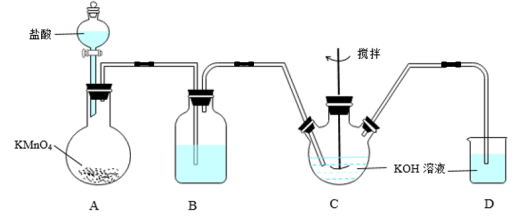
2 . 高铁酸钾(K2FeO4)是一种新型,高效、多功能绿色水处理剂,可通过KClO溶液与Fe(NO3)3溶液的反应制备。已知:①KClO在较高温度下发生歧化反应生成KClO3。②K2FeO4具有下列性质:可溶于水、微溶于浓KOH溶液;在强碱性溶液中比较稳定;在Fe3+催化作用下发生分解,在酸性至弱碱性条件下,能与水反应生成Fe(OH)3和O2,如图所示是实验室模拟工业制备KClO溶液装置。______ ;
(2)反应时需将C装置置于冷水浴中,其原因为______ ;
(3)制备K2FeO4时,不能将碱性的KClO溶液滴加到Fe(NO3)3饱和溶液中,其原因是______ ,制备K2FeO4的离子方程式______ ;
(4)工业上常用废铁屑为原料制备Fe(NO3)3溶液,检验Fe3+所需试剂名称______ ,其反应原理为______ (用离子方程式表示);
(5)向反应后的三颈瓶中加入饱和KOH溶液,析出K2FeO4固体,过滤、洗涤、干燥。洗涤操作所用最佳试剂为______ ;
A.水 B.无水乙醇 C.稀KOH溶液
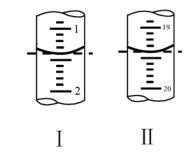
(6)工业上用“间接碘量法”测定高铁酸钾的纯度:用碱性KI溶液溶解1.00g K2FeO4样品,调节pH使高铁酸根全部被还原成亚铁离子,再调节pH为3~4,用1.0mol/L的Na2S2O3标准溶液作为滴定剂进行滴定(2Na2S2O3+I2=Na2S4O6+2NaI),淀粉作指示剂,装有Na2S2O3标准溶液的滴定管起始和终点读数如如图所示:______ mL。
②原样品中高铁酸钾的质量分数为______ 。[M(K2FeO4)=198g/mol]
③若在配制Na2S2O3标准溶液的过程中定容时俯视刻度线,则导致所测高铁酸钾的质量分数______ (填“偏高”、“偏低”或“无影响”)。
(2)反应时需将C装置置于冷水浴中,其原因为
(3)制备K2FeO4时,不能将碱性的KClO溶液滴加到Fe(NO3)3饱和溶液中,其原因是
(4)工业上常用废铁屑为原料制备Fe(NO3)3溶液,检验Fe3+所需试剂名称
(5)向反应后的三颈瓶中加入饱和KOH溶液,析出K2FeO4固体,过滤、洗涤、干燥。洗涤操作所用最佳试剂为
A.水 B.无水乙醇 C.稀KOH溶液
(6)工业上用“间接碘量法”测定高铁酸钾的纯度:用碱性KI溶液溶解1.00g K2FeO4样品,调节pH使高铁酸根全部被还原成亚铁离子,再调节pH为3~4,用1.0mol/L的Na2S2O3标准溶液作为滴定剂进行滴定(2Na2S2O3+I2=Na2S4O6+2NaI),淀粉作指示剂,装有Na2S2O3标准溶液的滴定管起始和终点读数如如图所示:
②原样品中高铁酸钾的质量分数为
③若在配制Na2S2O3标准溶液的过程中定容时俯视刻度线,则导致所测高铁酸钾的质量分数
您最近一年使用:0次
2021-02-02更新
|
109次组卷
|
2卷引用:宁夏海原县第一中学2021届高三上学期期末考试化学试题



