名校
解题方法
1 . 铜质电路板可采用酸性蚀刻与碱性蚀刻两种方法。将二者的废液混合可实现回收再利用。其主要流程如图:
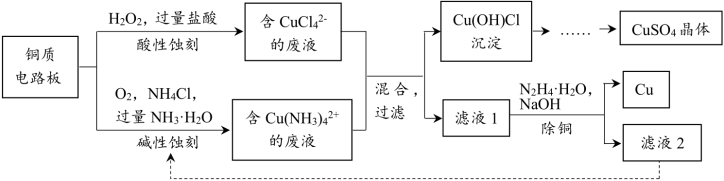
已知:①水合肼N2H4·H2O具有强还原性,易被氧化为N2
②Cu2++4NH3 Cu(NH3)
Cu(NH3)
(1)蚀刻
①酸性蚀刻铜的离子方程式:___________
②关于蚀刻的下列说法正确的是___________ 。
A.碱性蚀刻和酸性蚀刻分别利用了O2、H2O2的氧化性
B.酸性蚀刻时盐酸的主要作用是增强溶液的酸性
C.用H2O2、H2SO4、NaCl也可以使Cu溶解
(2)滤液1的pH约为5,其中除少量Cu2+外,还大量存在的离子是___________ 。
(3)除铜
①利用水合肼N2H4·H2O还原Cu2+的离子方程式是___________ 。
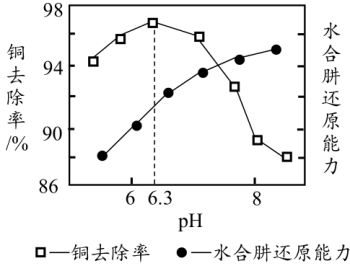
②已知该反应瞬间完成。滤渣成分只有Cu。测得铜去除率、水合肼还原能力随溶液pH的变化情况如图所示。由图可知。随溶液pH增大,铜去除率先增加后减小,结合图给值息和已知信息分析其原因:___________ 。

已知:①水合肼N2H4·H2O具有强还原性,易被氧化为N2
②Cu2++4NH3
 Cu(NH3)
Cu(NH3)
(1)蚀刻
①酸性蚀刻铜的离子方程式:
②关于蚀刻的下列说法正确的是
A.碱性蚀刻和酸性蚀刻分别利用了O2、H2O2的氧化性
B.酸性蚀刻时盐酸的主要作用是增强溶液的酸性
C.用H2O2、H2SO4、NaCl也可以使Cu溶解
(2)滤液1的pH约为5,其中除少量Cu2+外,还大量存在的离子是
(3)除铜
①利用水合肼N2H4·H2O还原Cu2+的离子方程式是
②已知该反应瞬间完成。滤渣成分只有Cu。测得铜去除率、水合肼还原能力随溶液pH的变化情况如图所示。由图可知。随溶液pH增大,铜去除率先增加后减小,结合图给值息和已知信息分析其原因:

您最近一年使用:0次
2021-11-27更新
|
476次组卷
|
3卷引用:宁夏石嘴山市平罗中学2022-2023学年高三上学期期中考试(重点班)化学试题
宁夏石嘴山市平罗中学2022-2023学年高三上学期期中考试(重点班)化学试题黑龙江省牡丹江市第一高级中学2021-2022学年高三上学期期中考试化学试题(已下线)解密06 金属及其化合物(分层训练)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)
名校
解题方法
2 . 人体血红蛋白中含有Fe2+,如果误食亚硝酸盐会使人中毒,因为亚硝酸盐会使Fe2+变Fe3+,生成高铁血红蛋白而丧失与O2结合的能力。服用维生素C可缓解亚硝酸盐中毒。说明维生素C具有
| A.氧化性 | B.还原性 | C.酸性 | D.碱性 |
您最近一年使用:0次
2020-11-09更新
|
1000次组卷
|
70卷引用:2015-2016学年宁夏吴忠中学高一上学期期末考试化学试卷
2015-2016学年宁夏吴忠中学高一上学期期末考试化学试卷(已下线)高考第一轮复习化学反应与能量变化单元测试(已下线)2010—2011学年云南省元阳一中高一上学期期末考试化学试卷(已下线)2011-2012学年上海理工大学附属中学高一上学期期末考试化学试卷(已下线)2011-2012学年广东省汕头金山中学高一第一学期期末考试化学(文)试卷(已下线)2011-2012学年浙江省余姚中学高一下学期期中考试文科化学试卷(已下线)2011-2012学年福建省泉州一中高一下学期期中考试化学试卷(已下线)2012-2013学年河北省邢台一中高一上学期第三次月考化学试卷(已下线)2012-2013学年浙江省杭州十四中高一上学期期末考试化学试卷(已下线)2012-2013学年上海市上海理工大学附属中学高一上期末考试化学试卷(已下线)2012-2013学年浙江省杭州地区七校高一下学期期中联考文科化学试卷(已下线)2013-2014学年山东省临沂市重点中学高一上学期期中考试化学试卷2014-2015山西省原平市一中高一上学期期末考试化学试卷2015-2016学年吉林省吉林五十五中高二上学期期中(文)化学试卷2015-2016学年广东广州执信中学高二上期中文化学试卷2015-2016学年湖南省常德一中高一上学期期末化学试卷2015-2016学年福建省莆田二十五中高一下学期第一次月考化学试卷2015-2016学年山西晋城市高平市特立高级中学高二下期中理科化学卷2016-2017学年广东佛山一中高一上第一次段考化学卷2016-2017学年遵义市第四中学高二上学期期中考试化学(文)试卷2016-2017学年广东省广州执信中学高二上期中化学卷2016-2017学年广东省汕头市金山中学高二上学业水平测试化学卷甘肃省武威市河西成功学校2017-2018学年高一上学期期中考试化学试题山东省临沂市蒙阴县实验中学2017-2018学年高一上学期期中考试化学试题山东省桓台第二中学2017-2018学年高一12月月考化学试题陕西省西安市长安区第一中学2017-2018学年高二上学期期末考试化学(文)试题广东省惠州市2017-2018学年高一上学期期末教学质量检测化学试题湖南省师范大学附属中学2017-2018学年高二上学期期末考试化学(文)试题云南省昆明市黄冈实验学校2017-2018学年高二上学期期末考试化学(理)试题云南民族大学附属中学2017-2018学年高一下学期期中考试化学试题2018-2019学年鲁科版必修1第2章元素与物质世界本章测试题广东省普通高中2018-2019学年高二学业水平测试预测试题福建省晋江市季延中学2018-2019学年高二(文)上学期期中考试化学试题山西省祁县第二中学校2018-2019学年高二下学期5月考试化学试题江苏省苏州陆慕高级中学2018-2019学年高一下学期5月月考化学试题江苏省苏州市第五中学2018-2019学年高二上学期期中考试(必修)化学试题甘肃省嘉峪关市一中2017-2018学年高一上学期期中考试化学试题云南省云天化中学2019-2020学年高一9月月考化学试题黑龙江省哈尔滨市第三中学2019-2020学年高二上学期期中考试化学(文)试题黑龙江省哈尔滨市阿城区龙涤中学2019-2020学年高一上学期第一次段考化学试题上海市嘉定区封浜高中2019-2020学年高二上学期期中考试化学试题湖南省常德市2018-2019学年高二下学期第一次月考化学试题江西省抚州市南城县第二中学2019-2020学年高一上学期第二次月考化学试题江苏省海头高级中学2019-2020学年高一上学期第三次月考化学试题福建省晋江市养正中学2019-2020学年高二上学期第二次月考化学试题山西省运城市盐湖五中2019-2020学年高一上学期期中考试化学试题安徽省六安市第一中学2019-2020学年高一下学期疫情防控延期开学期间辅导测试(三)化学试题安徽省芜湖市2019-2020学年高二上学期期末考试化学(文)试题辽宁省东北育才学校科学高中部2020-2021学年高一上学期第一学段检测化学试题(已下线)【浙江新东方】7广东省佛山市第一中学2020-2021学年高一上学期第一次段考化学试题江苏省常州市2020-2021学年高一上学期期中考试化学试题江西省九江市浔阳区九江市第七中学2020-2021学年高一上学期期中考试化学试题吉林省大安市第六中学2019-2020学年高二下学期期末考试化学(理)试题上海市奉城高级中学2018-20219学年高二上学期期中考试化学试题河北省石家庄市第二中学西校区2020-2021学年高一上学期12月月考化学试卷河南省南阳市第四中学2020-2021学年高一上学期第二次月考化学试题河南省南阳市油田第一中学2020-2021学年高二上学期期中考试化学试题福建省莆田第一中学2021-2022学年高一上学期期中考试化学试题山西省大同市2021-2022学年高一上学期期末调研化学试题上海理工大学附属中学中2021-2022学年高一下学期期中考试化学试题江苏省常州市金坛区2021-2022学年高一上学期期中教学质量调研化学试题广东省华南师范大学附属中学2020-2021学年高一上学期期中考试化学试题辽宁省锦州市黑山县黑山中学2021-2022学年高一上学期12月月考化学试题北京清华大学附属中学2022-2023学年高一上学期期末考试化学试卷海南省临高县新盈中学2021-2022学年高二上学期(5-8班)期中考试化学试题湖南省株洲市炎陵县第一中学等2校2022-2023学年高一下学期3月月考化学试题甘肃省武威市天祝藏族自治县第一中学2022-2023学年高一下学期开学考试化学试题广东省汕头市潮阳第一中学2023-2024学年高一上学期12月月考化学试题北京市顺义区杨镇第一中学2023-2024学年高一上学期期中考试化学试题
名校
3 . 氧化剂和还原剂在生产生活中广泛使用。
(1)高锰酸钾和氢溴酸溶液可以发生如下反应:2KMnO4+16HBr=5Br2+2MnBr2+2KBr+8H2O
①其中还原剂为___ ,还原产物为___ 。
②若有0.8mol还原剂被氧化,则转移电子的物质的量是___ 。
(2)古老但仍然是最有用的制备联氨(N2H4)溶液的方法如下:
__ NaClO+__ NH3·H2O→___ N2H4+___ NaCl+___ H2O
①请配平上述化学方程式。
②NH3·H2O在上述反应中显示出来的性质是___ 。
A.氧化性 B.还原性
C.酸性 D.碱性
(3)人体内所含铁元素以Fe2+和Fe3+的形式存在。市场出售的某种麦片中含有微量的颗粒细小的还原铁粉,这些铁粉在人体胃酸的作用下转化成亚铁盐,此反应的离子方程式为____ ,但Fe2+在酸性条件下很容易被空气中的氧气氧化,写出该反应的离子方程式_____ 。
(4)H3PO2和NaH2PO2均可将溶液中的Ag+还原为Ag,从而可用于化学镀银。
①H3PO2中P元素的化合价为____ 。
②利用H3PO2进行化学镀银反应中,氧化剂与还原剂物质的量之比为4∶1,则氧化产物为___ 。
(1)高锰酸钾和氢溴酸溶液可以发生如下反应:2KMnO4+16HBr=5Br2+2MnBr2+2KBr+8H2O
①其中还原剂为
②若有0.8mol还原剂被氧化,则转移电子的物质的量是
(2)古老但仍然是最有用的制备联氨(N2H4)溶液的方法如下:
①请配平上述化学方程式。
②NH3·H2O在上述反应中显示出来的性质是
A.氧化性 B.还原性
C.酸性 D.碱性
(3)人体内所含铁元素以Fe2+和Fe3+的形式存在。市场出售的某种麦片中含有微量的颗粒细小的还原铁粉,这些铁粉在人体胃酸的作用下转化成亚铁盐,此反应的离子方程式为
(4)H3PO2和NaH2PO2均可将溶液中的Ag+还原为Ag,从而可用于化学镀银。
①H3PO2中P元素的化合价为
②利用H3PO2进行化学镀银反应中,氧化剂与还原剂物质的量之比为4∶1,则氧化产物为
您最近一年使用:0次
2019-10-20更新
|
404次组卷
|
6卷引用:宁夏银川市第二中学2021-2022学年高一上学期期末考试化学试题
名校
4 . 在上海召开的第七届全球人类基因大会上,我国科学家第一次提出可以用砒霜(As2O3)来治疗早期幼粒白血病。
(1)完成并配平下列化学方程式:_____________
As2O3+ Zn+ H2SO4 → AsH3+ ZnSO4+ ______
(2)As2O3在上述反应中显示出来的性质是_____________ 。
A.氧化性 B.还原性 C.酸性 D.碱性
(3)若生成0.1 mol AsH3,则转移电子的物质的量为___________ mol。
(1)完成并配平下列化学方程式:
As2O3+ Zn+ H2SO4 → AsH3+ ZnSO4+ ______
(2)As2O3在上述反应中显示出来的性质是
A.氧化性 B.还原性 C.酸性 D.碱性
(3)若生成0.1 mol AsH3,则转移电子的物质的量为
您最近一年使用:0次
2018-12-11更新
|
125次组卷
|
4卷引用:宁夏固原市隆德县2020-2021学年高一上学期期末考试化学试题
宁夏固原市隆德县2020-2021学年高一上学期期末考试化学试题(已下线)2010年福建省厦门市杏南中学高三上学期10月月考化学卷福建省惠安惠南中学2019届高三上学期期中考试化学试题【全国百强校】山东省泰安市第一中学2019届高三上学期12月学情诊断化学试题
名校
解题方法
5 . NaClO2是一种重要的杀菌消毒剂,也常用来漂白织物等,其一种生产工艺如下,回答下列问题
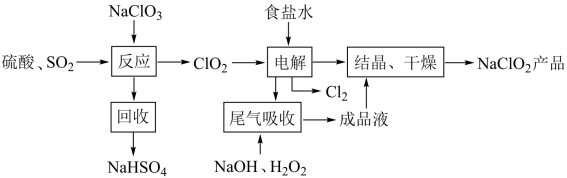
(1)NaClO2中Cl的化合价为______________________ .
(2)写出“反应”步骤中生成ClO2的化学方程式._______________________________ 。
(3)“电解”所用食盐水由粗盐水精制而成。粗盐精制时,为除去其中的Mg 2+和Ca 2+,要加入的试剂分别为_____________________ 、______________________ 。
(4)“尾气吸收”是吸收“电解”过程排出的少量ClO2。此吸收反应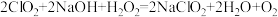 ,氧化剂与氧化产物的质量之比为
,氧化剂与氧化产物的质量之比为_________________ ,在标况下生成44.8LO2则转移电子的物质的量是____ .
(5)双氧水是中学常见的绿色化学试剂,既可以表现氧化性,又可以表现还原性。向双氧水中滴加酸性高锰酸钾溶液,产生气泡,紫红色褪去(已知Mn2+为无色),根据现象写出离子方程式._____________________________ 。

(1)NaClO2中Cl的化合价为
(2)写出“反应”步骤中生成ClO2的化学方程式.
(3)“电解”所用食盐水由粗盐水精制而成。粗盐精制时,为除去其中的Mg 2+和Ca 2+,要加入的试剂分别为
(4)“尾气吸收”是吸收“电解”过程排出的少量ClO2。此吸收反应
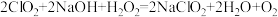 ,氧化剂与氧化产物的质量之比为
,氧化剂与氧化产物的质量之比为(5)双氧水是中学常见的绿色化学试剂,既可以表现氧化性,又可以表现还原性。向双氧水中滴加酸性高锰酸钾溶液,产生气泡,紫红色褪去(已知Mn2+为无色),根据现象写出离子方程式.
您最近一年使用:0次
名校
解题方法
6 . 关于下列物质的应用或分析错误的是
| A.常温下,用铁槽车运输浓硝酸利用了浓硝酸的强氧化性 |
| B.神舟13号返回舱烧蚀材料中含有石棉,说明石棉易燃烧 |
| C.用维生素C做NaNO2中毒的急救药利用了维生素C的强还原性 |
| D.《神农本草经》记载:“石硫黄(S)能化银、铜、铁”,这句话体现了石硫黄(S)的氧化性 |
您最近一年使用:0次
2023-05-07更新
|
265次组卷
|
3卷引用:宁夏银川市第二中学2023-2024学年高三上学期统练四 化学试题
7 . 自来水是自然界中的淡水经过絮凝、沉淀、过滤、消毒等工艺处理后得到的。高铁酸钾(K2FeO4,极易溶于水)是常见的水处理剂,其原理如图所示。完成下列问题:

(1)K2FeO4的电离方程式_______ 。过程①中K2FeO4表现了_______ (填“氧化”或“还原”)性。
(2)根据上述原理分析,作水处理剂时,K2FeO4的作用有_______ 、_______ (填两个)。
(3)制备高铁酸钾常用的反应原理为:Fe(OH)3+KClO+KOH→K2FeO4+KCl+H2O(反应未配平)。
①通过该反应说明:在碱性条件下,氧化性KClO_______ K2FeO4。
A.大于 B.小于 C.等于 D.无法比较
②配平该反应的化学方程式,并用单线桥法 表示电子转移的方向和数目说明_______ ;
(4)世界环保联盟要求ClO2逐渐取代Cl2作为自来水消毒剂
已知:NaCl+3H2O NaClO3+3H2↑
NaClO3+3H2↑
发生器:2NaClO3+4HCl=2ClO2↑+Cl2↑+2NaCl+2H2O
ClO2的生产流程示意图如图:

该工艺中,需要补充的物质X为_______ (填化学式,下同),能参与循环的物质有_______ 。
(5)已知:ClO2是极易溶于水的气体,具有强氧化性。用如图装置探究ClO2性质。回答下列问题:

锥形瓶内ClO2进气导管不伸入液面以下,原因是_______ 。

(1)K2FeO4的电离方程式
(2)根据上述原理分析,作水处理剂时,K2FeO4的作用有
(3)制备高铁酸钾常用的反应原理为:Fe(OH)3+KClO+KOH→K2FeO4+KCl+H2O(反应未配平)。
①通过该反应说明:在碱性条件下,氧化性KClO
A.大于 B.小于 C.等于 D.无法比较
②配平该反应的化学方程式,并用
(4)世界环保联盟要求ClO2逐渐取代Cl2作为自来水消毒剂
已知:NaCl+3H2O
 NaClO3+3H2↑
NaClO3+3H2↑发生器:2NaClO3+4HCl=2ClO2↑+Cl2↑+2NaCl+2H2O
ClO2的生产流程示意图如图:

该工艺中,需要补充的物质X为
(5)已知:ClO2是极易溶于水的气体,具有强氧化性。用如图装置探究ClO2性质。回答下列问题:

锥形瓶内ClO2进气导管不伸入液面以下,原因是
您最近一年使用:0次
8 . 下列对于化学反应8NH3+3Cl2=N2+6NH4Cl的有关说法不正确的是( )
| A.反应中NH3体现了还原性 |
| B.可利用该反应检验氯气管道是否泄漏 |
| C.若生成2.8gN2,则被氧化的Cl2为0.3mol |
| D.氧化性:Cl2>N2 |
您最近一年使用:0次
2020-08-27更新
|
159次组卷
|
5卷引用:宁夏银川唐徕回民中学2021-2022学年高一下学期3月月考化学试题
名校
9 . 硝酸是一种具有强氧化性、腐蚀性的强酸,其还原产物因硝酸浓度的不同而有变化,从总体上说,硝酸浓度越高,平均每分子硝酸得到的电子数越少,浓硝酸的还原产物主要为NO2、稀确酸的还原产物为NO。实验室中,常用Cu与浓HNO3反应制取NO2,用Cu与稀HNO3反应制取NO。
(1)请写出实验室中用Cu与浓HNO3反应制取NO2的化学方程式:__________________________________ 。
(2)上述(1)反应中发生氧化反应的物质是___________ ,1 mol 氧化剂________ (填“得到"或"失去“)______ mol电子。
(3)48.0g Cu与适量的浓HNO3反应,铜全部作用后,共收集到22.4L气体(标准状况下),反应中消耗HNO3的物质的量是__________ (填字母代号)。
A.1.5mol B.2.0mol C.2.5mol D.3.0mol
(4)实际上硝酸不仅可被还原为NO2或NO,浓度更稀时硝酸还可以被还原为N2O、N2、NH4NO3等,请将下列3种物质:FeSO4、Fe(NO3)3和Fe2(SO4)3分别填入下面对应的横线上,并配平该反应的化学方程式。 HNO3+ → + + N2O↑+ H2O_____________________
(5)硝酸的还原产物NO、NO2、N2O等对环境均有副作用,为了可持续发展,当今社会提出的一个新概念--“绿色化学”,它要求从经济、环保和技术上设计可行的化学反应,则下列由单质铜制取硝酸铜的方法可行且符合“绿色化学”的是__________ (填字母代号)。
A.Cu Cu(NO3)2
Cu(NO3)2
B.Cu CuO
CuO  Cu(NO3)2
Cu(NO3)2
C.Cu CuO
CuO Cu(OH)2
Cu(OH)2  Cu(NO3)2
Cu(NO3)2
D.Cu CuSO4
CuSO4 Cu(NO3)2
Cu(NO3)2
(1)请写出实验室中用Cu与浓HNO3反应制取NO2的化学方程式:
(2)上述(1)反应中发生氧化反应的物质是
(3)48.0g Cu与适量的浓HNO3反应,铜全部作用后,共收集到22.4L气体(标准状况下),反应中消耗HNO3的物质的量是
A.1.5mol B.2.0mol C.2.5mol D.3.0mol
(4)实际上硝酸不仅可被还原为NO2或NO,浓度更稀时硝酸还可以被还原为N2O、N2、NH4NO3等,请将下列3种物质:FeSO4、Fe(NO3)3和Fe2(SO4)3分别填入下面对应的横线上,并配平该反应的化学方程式。 HNO3+ → + + N2O↑+ H2O
(5)硝酸的还原产物NO、NO2、N2O等对环境均有副作用,为了可持续发展,当今社会提出的一个新概念--“绿色化学”,它要求从经济、环保和技术上设计可行的化学反应,则下列由单质铜制取硝酸铜的方法可行且符合“绿色化学”的是
A.Cu
 Cu(NO3)2
Cu(NO3)2B.Cu
 CuO
CuO  Cu(NO3)2
Cu(NO3)2C.Cu
 CuO
CuO Cu(OH)2
Cu(OH)2  Cu(NO3)2
Cu(NO3)2D.Cu
 CuSO4
CuSO4 Cu(NO3)2
Cu(NO3)2
您最近一年使用:0次
2014-03-03更新
|
349次组卷
|
3卷引用:宁夏育才中学学益校区2017-2018学年高一下学开学考试化学试题
宁夏育才中学学益校区2017-2018学年高一下学开学考试化学试题(已下线)2013-2014学年福建省宁德市高一上学期期末考试化学试卷(A)湖南省长沙市一中2017-2018学年度高一第一学期期末考试化学试题
名校
10 . 下列反应中说明NH3既有还原性,又有碱性的是( )
A.4NH3+5O2 4NO+6H2O 4NO+6H2O | B.NH3+HNO3=NH4NO3 |
| C.8NH3+3Cl2=N2+6NH4Cl | D.2NH3+3CuO 3Cu+N2+3H2O 3Cu+N2+3H2O |
您最近一年使用:0次
2019-02-17更新
|
383次组卷
|
8卷引用:宁夏银川一中2017-2018学年高一上学期期末考试化学试题
宁夏银川一中2017-2018学年高一上学期期末考试化学试题宁夏回族自治区青铜峡市高级中学2018-2019学年高一上学期期末考试化学试题(已下线)2015河北保定某重点中学同步作业(必修1苏教版)4.2.2氮肥的生产和使用2017-2018学年高一人教版必修一:26 氨的实验室制法课时训练化学试题黑龙江省伊春中学2017-2018学年高一化学上学期期末考试题(已下线)【走进新高考】(人教版必修一)4.4.1氨、硝酸、硫酸——氨 同步练习02新疆维吾尔自治区且末县第二中学2018-2019学年高一上学期期末考试化学试题北京市通州区运河中学2022-2023学年高一下学期3月月考化学试题



