1 . 某小组同学探究Cu和H2O2的反应。
【猜想预测】
猜想1:Cu与H2O2不发生反应;
猜想2:Cu与H2O2可能发生氧化还原反应,H2O2作氧化剂。
【实验探究】
实验ⅰ:向装有0.5 g Cu的烧杯中加入20 mL 30% H2O2溶液,一段时间内无明显现象,10小时后,溶液中有少量蓝色浑浊,Cu片表面附着少量蓝色固体。
(1)通过该实验证明了猜想2成立,写出该反应的化学方程式:________ 。
【继续探究】
针对该反应速率较慢,小组同学查阅资料,设计并完成了下列实验。
资料:Cu2++ 4NH3⇌[ Cu(NH3)4]2+,[ Cu(NH3)4]2+为深蓝色;Cu(OH)2可溶于氨水形成深蓝色溶液。
(2)实验ⅱ中:溶液变蓝的原因是________ (用化学用语解释);经检验产生的气体为氧气,产生氧气的原因是________ 。
(3)对比实验ⅰ和ⅲ,为探究氨水对Cu的还原性或H2O2氧化性的影响,该同学利用如图装置继续实验。
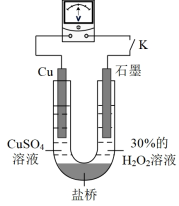
已知:电压大小反映了物质氧化还原性强弱的差异;物质氧化性与还原性强弱差异越大,电压越大。
a.K闭合时,电压为x。
b.向U形管右侧溶液中滴加氨水后,电压不变。
c.继续向U形管左侧溶液中滴加氨水后,电压增大了y。
该实验的结论:_________ 。利用该方法也可证明酸性增强可提高H2O2的氧化性,导致Cu溶解速率加快。
(4)对比实验ⅱ和ⅲ,实验ⅲ中产生氧气速率明显更快,可能的原因是_______ 。
(5)实验ⅲ有少量蓝色不溶物,小组同学加入少量NH4Cl可使其溶解,结合文字和化学用语解释不溶物溶解的原因:________ 。
(6)基于以上实验,影响Cu与H2O2反应速率的因素有________ 。
【猜想预测】
猜想1:Cu与H2O2不发生反应;
猜想2:Cu与H2O2可能发生氧化还原反应,H2O2作氧化剂。
【实验探究】
实验ⅰ:向装有0.5 g Cu的烧杯中加入20 mL 30% H2O2溶液,一段时间内无明显现象,10小时后,溶液中有少量蓝色浑浊,Cu片表面附着少量蓝色固体。
(1)通过该实验证明了猜想2成立,写出该反应的化学方程式:
【继续探究】
针对该反应速率较慢,小组同学查阅资料,设计并完成了下列实验。
资料:Cu2++ 4NH3⇌[ Cu(NH3)4]2+,[ Cu(NH3)4]2+为深蓝色;Cu(OH)2可溶于氨水形成深蓝色溶液。
| 装置 | 序号 | 试剂a | 现象 |
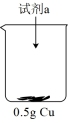 | ⅱ | 20 mL 30% H2O2与4 mL 5 mol/L H2SO4混合液 | Cu表面很快生产少量气泡,溶液逐渐变蓝,产生较多气泡 |
| ⅲ | 20 mL 30% H2O2与4 mL5 mol/L氨水混合液 | 溶液立即变为深蓝色,产生大量气泡,Cu表面有少量蓝色不溶物 |
(2)实验ⅱ中:溶液变蓝的原因是
(3)对比实验ⅰ和ⅲ,为探究氨水对Cu的还原性或H2O2氧化性的影响,该同学利用如图装置继续实验。

已知:电压大小反映了物质氧化还原性强弱的差异;物质氧化性与还原性强弱差异越大,电压越大。
a.K闭合时,电压为x。
b.向U形管右侧溶液中滴加氨水后,电压不变。
c.继续向U形管左侧溶液中滴加氨水后,电压增大了y。
该实验的结论:
(4)对比实验ⅱ和ⅲ,实验ⅲ中产生氧气速率明显更快,可能的原因是
(5)实验ⅲ有少量蓝色不溶物,小组同学加入少量NH4Cl可使其溶解,结合文字和化学用语解释不溶物溶解的原因:
(6)基于以上实验,影响Cu与H2O2反应速率的因素有
您最近半年使用:0次
2020-06-06更新
|
337次组卷
|
3卷引用:北京市丰台区2020届高三下学期高三综合练习(二)化学试题
名校
解题方法
2 . 设计实验探究NO的氧化性。
实验Ⅰ:用排水法收集一瓶NO,将其倒扣在盛有碱性 溶液的水槽中,振荡,观察到集气瓶中液面上升。
溶液的水槽中,振荡,观察到集气瓶中液面上升。
资料:ⅰ.NO与碱性 溶液会发生氧化还原反应,
溶液会发生氧化还原反应, 被还原为
被还原为 。
。
ⅱ. 与
与 反应生成黄色沉淀。
反应生成黄色沉淀。
某同学认为,需通过进一步实验验证NO的氧化性,补充以下实验:
实验Ⅱ:取饱和 溶液,加入少量冰醋酸,再滴加5滴
溶液,加入少量冰醋酸,再滴加5滴 的
的 溶液,无明显变化。
溶液,无明显变化。
实验Ⅲ:
(1)取少量实验Ⅰ反应后集气瓶中的溶液,加入少量冰醋酸,再滴加5滴 的
的 溶液,
溶液,___________ (填实验现象)。
上述实验证明NO有氧化性。
(2)实验Ⅱ的目的是___________
(3)写出NO与碱性 溶液反应的离子方程式
溶液反应的离子方程式___________
(4)一个氧化还原反应可以看成“氧化”和“还原”两个半反应,试用此角度分析NO与碱性 溶液的反应。若还原反应为:
溶液的反应。若还原反应为: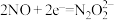 ,则氧化反应为:
,则氧化反应为:___________ 。
(5)某同学结合所学知识设计处理工业废气中 和NO的实验方案,达到消除污染,保护环境的目的。
和NO的实验方案,达到消除污染,保护环境的目的。
①先用饱和纯碱溶液吸收废气中的 ,生成
,生成 ,写出该反应的离子方程式
,写出该反应的离子方程式___________
②再向生成的溶液中加入一定量___________ ,以此溶液来吸收NO气体。
实验Ⅰ:用排水法收集一瓶NO,将其倒扣在盛有碱性
 溶液的水槽中,振荡,观察到集气瓶中液面上升。
溶液的水槽中,振荡,观察到集气瓶中液面上升。资料:ⅰ.NO与碱性
 溶液会发生氧化还原反应,
溶液会发生氧化还原反应, 被还原为
被还原为 。
。ⅱ.
 与
与 反应生成黄色沉淀。
反应生成黄色沉淀。某同学认为,需通过进一步实验验证NO的氧化性,补充以下实验:
实验Ⅱ:取饱和
 溶液,加入少量冰醋酸,再滴加5滴
溶液,加入少量冰醋酸,再滴加5滴 的
的 溶液,无明显变化。
溶液,无明显变化。实验Ⅲ:
(1)取少量实验Ⅰ反应后集气瓶中的溶液,加入少量冰醋酸,再滴加5滴
 的
的 溶液,
溶液,上述实验证明NO有氧化性。
(2)实验Ⅱ的目的是
(3)写出NO与碱性
 溶液反应的离子方程式
溶液反应的离子方程式(4)一个氧化还原反应可以看成“氧化”和“还原”两个半反应,试用此角度分析NO与碱性
 溶液的反应。若还原反应为:
溶液的反应。若还原反应为: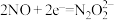 ,则氧化反应为:
,则氧化反应为:(5)某同学结合所学知识设计处理工业废气中
 和NO的实验方案,达到消除污染,保护环境的目的。
和NO的实验方案,达到消除污染,保护环境的目的。①先用饱和纯碱溶液吸收废气中的
 ,生成
,生成 ,写出该反应的离子方程式
,写出该反应的离子方程式②再向生成的溶液中加入一定量
您最近半年使用:0次
3 . 实验小组制备高铁酸钾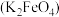 并探究其性质。
并探究其性质。
资料: 为紫色固体,微溶于KOH溶液;具有强氧化性,在酸性或中性溶液中快速产生
为紫色固体,微溶于KOH溶液;具有强氧化性,在酸性或中性溶液中快速产生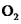 ,在碱性溶液中较稳定。
,在碱性溶液中较稳定。
(1)制备 (夹持装置略)
(夹持装置略)
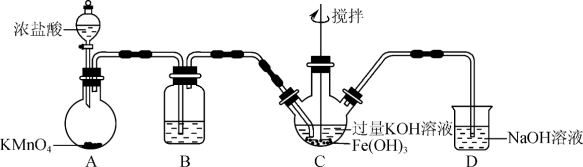
A为氯气发生装置。A中反应化学方程式是________________ (锰被还原为Mn2+)。除杂装置B所用试剂为________ 。C中得到紫色固体和溶液,C中Cl2发生的反应有 ,另外还有(离子方程式表示)
,另外还有(离子方程式表示)_____ 。
(2)探究 的性质
的性质
取C中紫色溶液,加入稀硫酸,产生黄绿色气体,得溶液a,经检验气体中含有Cl2。为证明是否 氧化了Cl-而产生Cl2,设计下图方案:
氧化了Cl-而产生Cl2,设计下图方案:
①由方案一中溶液变红可知a中含有______ 离子,但该离子的产生不能判断一定是 将Cl-氧化,还可能由
将Cl-氧化,还可能由____________ 产生(用离子方程式表示)。
②根据 的制备实验得出:氧化性Cl2
的制备实验得出:氧化性Cl2______  (填“>”或“<”),而方案二实验表明,Cl2和
(填“>”或“<”),而方案二实验表明,Cl2和 的氧化性强弱关系相反,原因是
的氧化性强弱关系相反,原因是________ 。
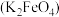 并探究其性质。
并探究其性质。资料:
 为紫色固体,微溶于KOH溶液;具有强氧化性,在酸性或中性溶液中快速产生
为紫色固体,微溶于KOH溶液;具有强氧化性,在酸性或中性溶液中快速产生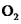 ,在碱性溶液中较稳定。
,在碱性溶液中较稳定。(1)制备
 (夹持装置略)
(夹持装置略)
A为氯气发生装置。A中反应化学方程式是
 ,另外还有(离子方程式表示)
,另外还有(离子方程式表示)(2)探究
 的性质
的性质取C中紫色溶液,加入稀硫酸,产生黄绿色气体,得溶液a,经检验气体中含有Cl2。为证明是否
 氧化了Cl-而产生Cl2,设计下图方案:
氧化了Cl-而产生Cl2,设计下图方案:| 方案一 | 取少量a,滴加KSCN溶液至过量溶液呈血红色。 |
| 方案二 | 用KOH溶液充分洗涤C中所得固体再用KOH溶液将K2FeO4溶出,得到紫色溶液b。取少量b,滴加盐酸,有C12产生。 |
 将Cl-氧化,还可能由
将Cl-氧化,还可能由②根据
 的制备实验得出:氧化性Cl2
的制备实验得出:氧化性Cl2 (填“>”或“<”),而方案二实验表明,Cl2和
(填“>”或“<”),而方案二实验表明,Cl2和 的氧化性强弱关系相反,原因是
的氧化性强弱关系相反,原因是
您最近半年使用:0次
名校
解题方法
4 . 高铁酸钾(K2FeO4)是一种新型、高效、无毒的多功能水处理剂。查阅资料已知:K2FeO4为紫色固体,溶于KOH溶液,具有强氧化性,在酸性或中性溶液中快速产生O2,在碱性溶液中较稳定。
(1)制备K2FeO4
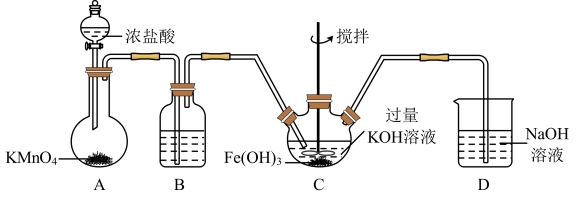
①在装置A中发生的化学反应中HCl显示出来的性质为___________ 。
②C为制备K2FeO4装置,写出次氯酸钾与氢氧化铁在碱性环境中反应的离子方程式:___________ 。
(2)探究K2FeO4的性质
取C中浅紫红色溶液,加入稀硫酸,产生黄绿色气体,得溶液a,经检验气体中含有Cl2。为证明K2FeO4能否氧化Cl-而产生Cl2,设计如下方案:取少量溶液a,滴加KSCN溶液至过量,溶液呈红色。由方案中溶液变红可知a中含有Fe3+,该离子的产生不能判断一定是由K2FeO4被Cl-还原而形成的,原因是___________ 。
(3)使用时经常通过测定高铁酸钾的纯度来判断其是否变质。K2FeO4在硫酸溶液中反应如下: FeO
FeO +
+ H+=
H+= O2↑+
O2↑+ Fe3++
Fe3++ ___________
___________
①完成并配平上述离子方程式(方框内填化学计量数,横线上写物质)。___________
②现取C中洗涤并干燥后样品的质量10g,加入稀硫酸,收集到0.672L气体(标准状况)。则样品中高铁酸钾的质量分数为___________ 。(计算结果保留到0.1%)
(1)制备K2FeO4

①在装置A中发生的化学反应中HCl显示出来的性质为
②C为制备K2FeO4装置,写出次氯酸钾与氢氧化铁在碱性环境中反应的离子方程式:
(2)探究K2FeO4的性质
取C中浅紫红色溶液,加入稀硫酸,产生黄绿色气体,得溶液a,经检验气体中含有Cl2。为证明K2FeO4能否氧化Cl-而产生Cl2,设计如下方案:取少量溶液a,滴加KSCN溶液至过量,溶液呈红色。由方案中溶液变红可知a中含有Fe3+,该离子的产生不能判断一定是由K2FeO4被Cl-还原而形成的,原因是
(3)使用时经常通过测定高铁酸钾的纯度来判断其是否变质。K2FeO4在硫酸溶液中反应如下:
 FeO
FeO +
+ H+=
H+= O2↑+
O2↑+ Fe3++
Fe3++ ___________
___________①完成并配平上述离子方程式(方框内填化学计量数,横线上写物质)。
②现取C中洗涤并干燥后样品的质量10g,加入稀硫酸,收集到0.672L气体(标准状况)。则样品中高铁酸钾的质量分数为
您最近半年使用:0次
2021-12-21更新
|
310次组卷
|
2卷引用:湖南省湘潭凤凰中学2021-2022学年高一上学期12月月考化学试题
解题方法
5 . 在包装糕点盒中会附有食品保鲜剂,里边的主要成分是铁粉,它可以预防食物变质,这说明铁粉具有
| A.酸性 | B.碱性 | C.氧化性 | D.还原性 |
您最近半年使用:0次
名校
解题方法
6 . 化学创造美好生活,下列说法有关物质的性质与用途错误的是
| A.SO2具有较强的还原性——可以在葡萄酒中添加SO2作为抗氧化剂食品保鲜 |
| B.高铁酸钾(K2FeO4)具有强氧化性——可用作饮用水消毒剂 |
| C.电子跃迁到激发态过程中释放能量产生紫色光——钾盐可用作紫色烟花的原料 |
| D.Ca(OH)2具有碱性—用熟石灰处理实验后的酸性废水 |
您最近半年使用:0次
名校
解题方法
7 . 为了防止食品变质,常在食品袋中放入小袋的铁粉,这是利用铁的
| A.还原性 | B.氧化性 | C.酸性 | D.碱性 |
您最近半年使用:0次
2023-09-23更新
|
282次组卷
|
5卷引用:黑龙江省七台河市第六中学2022-2023学年高一上学期期末考试化学试题
黑龙江省七台河市第六中学2022-2023学年高一上学期期末考试化学试题(已下线)课时1 铁的单质(已下线)专题03 铁 金属材料-【寒假自学课】2024年高一化学寒假提升学与练(人教版2019)安徽省宿州市十三校联考2023-2024学年高一上学期1月期末考试化学试题黑龙江省佳木斯市三校联考2023-2024学年高一上学期1月期末化学试题
名校
解题方法
8 . 化学创造美好生活,下列说法有关物质的性质与用途错误的是
| A.电子跃迁到激发态过程中释放能量产生紫色光—钾盐可用作紫色烟花的原料 |
| B.高铁酸钾(K2FeO4)具有强氧化性—可用作饮用水消毒剂 |
| C.SO2具有较强的还原性—可以在葡萄酒中添加SO2作为抗氧化剂食品保鲜 |
| D.Ca(OH)2具有碱性—理科突击班化学社团用熟石灰处理实验后的酸性废水 |
您最近半年使用:0次
2023-08-21更新
|
496次组卷
|
2卷引用:四川省绵阳市高中理科突击班2023-2024学年高三上学期第零次诊断性考试理综化学试题
名校
解题方法
9 . 某兴趣小组研究亚硝酸钠,查阅下列资料,试根据信息回答下列问题。
(1)已知NaNO2能发生如下反应:2NaNO2+4HI=2NO↑+I2+2NaI+2H2O。请用双线桥表示电子转移的方向和数目:___ 。
(2)误食NaNO2会导致血红蛋白中的Fe2+转化为Fe3+ 而中毒,可服用维生素C 解毒。下列分析错误的是__ (填序号)。
A.NaNO2被还原 B.维生素C具有还原性
C.还原性:维生素C>Fe2+ D.NaNO2是还原剂
(3)下列方法中,可用来区分NaNO2和NaCl的是___ (填序号)。
A.焰色反应 B.分别滴加酸化FeSO4溶液和KSCN溶液
C.在酸性条件下加入KI 淀粉溶液 D.分别滴加AgNO3溶液
(4)某同学把新制的氯水加到NaNO2溶液中,观察到氯水褪色,同时生成NaNO3和HCl,请写出反应的离子方程式:___ 。
| 药品 | NaNO2 (亚硝酸钠) |
| 性质 | 1.在酸性溶液中有较强氧化性,能将Fe2+ 氧化成Fe3+ ; 2.AgNO2是一种难溶于水、易溶于酸的盐。 |
(1)已知NaNO2能发生如下反应:2NaNO2+4HI=2NO↑+I2+2NaI+2H2O。请用双线桥表示电子转移的方向和数目:
(2)误食NaNO2会导致血红蛋白中的Fe2+转化为Fe3+ 而中毒,可服用维生素C 解毒。下列分析错误的是
A.NaNO2被还原 B.维生素C具有还原性
C.还原性:维生素C>Fe2+ D.NaNO2是还原剂
(3)下列方法中,可用来区分NaNO2和NaCl的是
A.焰色反应 B.分别滴加酸化FeSO4溶液和KSCN溶液
C.在酸性条件下加入KI 淀粉溶液 D.分别滴加AgNO3溶液
(4)某同学把新制的氯水加到NaNO2溶液中,观察到氯水褪色,同时生成NaNO3和HCl,请写出反应的离子方程式:
您最近半年使用:0次
名校
解题方法
10 . 氧化还原反应原理在研究物质性质及物质转化方面具有重要的价值。
(1)生活中常用的“84”消毒液与洁厕净(主要成分是盐酸)混合时会产生大量的有毒气体,写出该反应的离子方程式:_______ 。
(2)苹果汁是人们喜欢的饮料。由于此饮料中含有 ,现榨的会由淡绿色(含
,现榨的会由淡绿色(含 )变为棕黄色(含
)变为棕黄色(含 )。若榨汁时加入维生素C,可有效防止这种现象发生。这说明维生素C具有_______。
)。若榨汁时加入维生素C,可有效防止这种现象发生。这说明维生素C具有_______。
(3)焊接铜器时,可用 除去表面的
除去表面的 再进行焊接,该反应是:
再进行焊接,该反应是: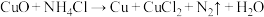
①配平该反应方程式_______ 。
②该反应的氧化产物是_______ 。氧化剂和还原剂的个数比是_______ 。
(4)一定条件下,分别以 、
、 、
、 为原料制取
为原料制取 ,当制得相同质量的
,当制得相同质量的 时,三个反应中转移的电子数目之比为
时,三个反应中转移的电子数目之比为_______ 。
(1)生活中常用的“84”消毒液与洁厕净(主要成分是盐酸)混合时会产生大量的有毒气体,写出该反应的离子方程式:
(2)苹果汁是人们喜欢的饮料。由于此饮料中含有
 ,现榨的会由淡绿色(含
,现榨的会由淡绿色(含 )变为棕黄色(含
)变为棕黄色(含 )。若榨汁时加入维生素C,可有效防止这种现象发生。这说明维生素C具有_______。
)。若榨汁时加入维生素C,可有效防止这种现象发生。这说明维生素C具有_______。| A.氧化性 | B.还原性 | C.酸性 | D.碱性 |
 除去表面的
除去表面的 再进行焊接,该反应是:
再进行焊接,该反应是: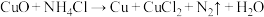
①配平该反应方程式
②该反应的氧化产物是
(4)一定条件下,分别以
 、
、 、
、 为原料制取
为原料制取 ,当制得相同质量的
,当制得相同质量的 时,三个反应中转移的电子数目之比为
时,三个反应中转移的电子数目之比为
您最近半年使用:0次



