解题方法
1 . 在包装糕点盒中会附有食品保鲜剂,里边的主要成分是铁粉,它可以预防食物变质,这说明铁粉具有
| A.酸性 | B.碱性 | C.氧化性 | D.还原性 |
您最近一年使用:0次
解题方法
2 . 生活处处离不开化学。阅读材料,完成各题:
材料一:人体胃液中含有胃酸(0.2%~0.4%的盐酸),起杀菌、帮助消化等作用。当胃酸过多时,医生通常用“胃舒平”[主要成分是Al(OH)3] 或“小苏打片”(主要成分是NaHCO3) 给病人治疗。
(1)写出NaHCO3在水中的电离方程式___________ 。
(2)病人同时患有胃溃疡,此时最宜服用___________ (填“小苏打片”或“胃舒平”),发生反应的化学方程式为___________ 。
材料二:维生素C又称“抗坏血酸”,因为它能够保护身体免于氧化剂的威胁。维生素C同时也是一种辅酶,能增强人体对疾病的抵抗能力。
(3)将维生素C溶于水后向溶液中滴加几滴紫色石蕊试液,试液变红,说明维生素C的水溶液呈___________性。
(4)亚铁离子易被吸收,给贫血者补充铁时,应给予含亚铁离子的亚铁盐,如硫酸亚铁。服用维生素C,可使食物中的铁离子转化成亚铁离子,有利于铁的吸收。上述反应中维生素C是___________ 剂。
材料一:人体胃液中含有胃酸(0.2%~0.4%的盐酸),起杀菌、帮助消化等作用。当胃酸过多时,医生通常用“胃舒平”[主要成分是Al(OH)3] 或“小苏打片”(主要成分是NaHCO3) 给病人治疗。
(1)写出NaHCO3在水中的电离方程式
(2)病人同时患有胃溃疡,此时最宜服用
材料二:维生素C又称“抗坏血酸”,因为它能够保护身体免于氧化剂的威胁。维生素C同时也是一种辅酶,能增强人体对疾病的抵抗能力。
(3)将维生素C溶于水后向溶液中滴加几滴紫色石蕊试液,试液变红,说明维生素C的水溶液呈___________性。
| A.酸性 | B.碱性 | C.氧化性 | D.还原性 |
您最近一年使用:0次
名校
解题方法
3 . 生产芯片的半导体材料有硅、锗、砷化镓等,应用比较广泛的是硅。硅可由石英砂(主要成分是二氧化硅)制得,制备高纯硅的主要工艺流程如图所示:

资料:①SiHCl3能与H2O剧烈反应,在空气中易自燃;②粗SiHCl3 (沸点33.0℃)中含有少量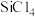 (沸点57.6℃)和HCl(沸点-84.7℃)
(沸点57.6℃)和HCl(沸点-84.7℃)
(1)流程①焦炭体现了___________ (填“氧化性”或“还原性”)。
(2)流程③提纯SiHCl3的操作是___________ 。
(3)流程④的化学反应为置换反应,写出其化学方程式:___________ 。
流程④制备高纯硅的装置如图(热源及夹持装置略去):

(4)若要从下列玻璃仪器中选择部分来组装A处的气体发生装置,需要的是___________ (填选项编号):
a. 分液漏斗 b.烧瓶 c.酒精灯 d.大试管 e.漏斗 f.烧杯 g.导管
装置B中的试剂是___________ (填试剂名称);装置C中的烧瓶需要加热,其目的是___________ 。
(5)反应一段时间后,装置D中观察到的现象是___________ 。
(6)为保证制备高纯硅实验的成功,操作的关键是检查实验装置的气密性,控制好反应温度以及___________ ,该流程中能够循环利用的物质是___________ 。

资料:①SiHCl3能与H2O剧烈反应,在空气中易自燃;②粗SiHCl3 (沸点33.0℃)中含有少量
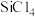 (沸点57.6℃)和HCl(沸点-84.7℃)
(沸点57.6℃)和HCl(沸点-84.7℃)(1)流程①焦炭体现了
(2)流程③提纯SiHCl3的操作是
(3)流程④的化学反应为置换反应,写出其化学方程式:
流程④制备高纯硅的装置如图(热源及夹持装置略去):

(4)若要从下列玻璃仪器中选择部分来组装A处的气体发生装置,需要的是
a. 分液漏斗 b.烧瓶 c.酒精灯 d.大试管 e.漏斗 f.烧杯 g.导管
装置B中的试剂是
(5)反应一段时间后,装置D中观察到的现象是
(6)为保证制备高纯硅实验的成功,操作的关键是检查实验装置的气密性,控制好反应温度以及
您最近一年使用:0次
2022高三·全国·专题练习
解题方法
4 . 亚硝酸钠(NaNO2)外观酷似食盐且有咸味,是一种常用的发色剂和防腐剂。查阅资料知:酸性条件下NaNO2具有氧化性。利用所供试剂,设计实验方案验证此信息:_______ (供选用的试剂有NaNO2溶液、FeSO4溶液、稀硫酸、KSCN溶液)
您最近一年使用:0次
解题方法
5 . 化学与生活紧密相关,下列与化学知识有关的描述正确的是
| A.小苏打可用作食品膨松剂,利用其水溶液呈碱性 |
B. 可用于饮用水消毒,利用了其强氧化性 可用于饮用水消毒,利用了其强氧化性 |
C. 用于制作光导纤维,利用了其半导体的特性 用于制作光导纤维,利用了其半导体的特性 |
| D.镁铝合金用于制作航天器外壳,利用了其强还原性 |
您最近一年使用:0次
解题方法
6 . 化学与生产、生活密切相关。下列说法不正确的是
A.《美国陶瓷学会会刊》发表我国故宫研究院的考古成果:乾隆时期紫金釉中发现特殊晶体-亚稳相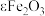 晶体,该样品溶于盐酸,滴加KSCN溶液,可验证 晶体,该样品溶于盐酸,滴加KSCN溶液,可验证 |
| B.利用酸性重铬酸钾检测酒驾利用了酸性重铬酸钾的强氧化性和酒精的还原性、挥发性 |
| C.石油的分馏,煤的气化、液化均属于物理变化 |
| D.采取“汽车尾气催化净化”“静电除尘”“燃煤固硫”等方法,可提高空气质量 |
您最近一年使用:0次
解题方法
7 . 铁及其合金在工农业生产和日常生活中有广泛的应用。
(1)高铁的快速发展方便了人们的出行,工业上利用铝热反应焊接钢轨间的缝隙,写出Al和Fe2O3混合粉末发生铝热反应的化学方程式______ 。该反应的反应原理是______ 。
(2)琥珀酸亚铁,化学式为FeC4H4O4是一种常见高效补血药,易溶于水,在水溶液中发生电离:FeC4H4O4=Fe2++ ,有较强还原性。
,有较强还原性。
①取少量琥珀酸亚铁溶液,滴加NaOH溶液,写出反应的离子方程式______ 。
②取少量琥珀酸亚铁溶液,滴加KSCN溶液,溶液呈很浅的红色,滴加少量氯水溶液颜色变深。
溶液呈很浅的红色是因为Fe2+与氧气反应生成了Fe3+和水,写出酸性条件下发生该反应的离子方程式:______ 。用离子方程式表示滴加少量氯水溶液颜色变深的原因:______ 和Fe3++3SCN- Fe(SCN)3。
Fe(SCN)3。
③服用琥珀酸亚铁时医生经常建议同时服用维生素C(又叫抗坏血酸),说明维生素C具有______ 。
A.强氧化性 B.强还原性 C.强酸性 D.很强的甜味
(3)2019年诺贝尔化学奖颁给锂离子电池领域,获奖科学家的重要贡献之一是研发出了电极材料——磷酸亚铁锂(LiFePO4),LiFePO4的一种制备方法如下。
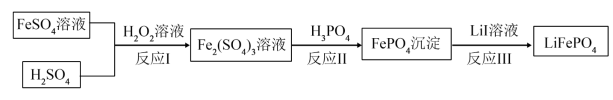
①写出反应Ⅰ的离子方程式______ 。
②反应Ⅲ中氧化剂是______ (填化学式)。
(1)高铁的快速发展方便了人们的出行,工业上利用铝热反应焊接钢轨间的缝隙,写出Al和Fe2O3混合粉末发生铝热反应的化学方程式
(2)琥珀酸亚铁,化学式为FeC4H4O4是一种常见高效补血药,易溶于水,在水溶液中发生电离:FeC4H4O4=Fe2++
 ,有较强还原性。
,有较强还原性。①取少量琥珀酸亚铁溶液,滴加NaOH溶液,写出反应的离子方程式
②取少量琥珀酸亚铁溶液,滴加KSCN溶液,溶液呈很浅的红色,滴加少量氯水溶液颜色变深。
溶液呈很浅的红色是因为Fe2+与氧气反应生成了Fe3+和水,写出酸性条件下发生该反应的离子方程式:
 Fe(SCN)3。
Fe(SCN)3。③服用琥珀酸亚铁时医生经常建议同时服用维生素C(又叫抗坏血酸),说明维生素C具有
A.强氧化性 B.强还原性 C.强酸性 D.很强的甜味
(3)2019年诺贝尔化学奖颁给锂离子电池领域,获奖科学家的重要贡献之一是研发出了电极材料——磷酸亚铁锂(LiFePO4),LiFePO4的一种制备方法如下。

①写出反应Ⅰ的离子方程式
②反应Ⅲ中氧化剂是
您最近一年使用:0次
8 . 下列化学反应中:
① (未配平)
(未配平)
②
③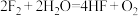
④
⑤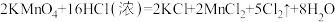
⑥
⑦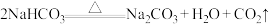
回答下列问题:
(1)上述反应中,既是分解反应,又是氧化还原反应的是___________ (填序号)。
(2)反应①中的氧化剂是___________ ,被氧化的元素是___________ ,用化合价升降法配平①中的反应方程式:___________ 。
(3)反应④中氧化产物和还原产物的质量之比为___________ ;反应⑤中浓盐酸表现出的性质是___________ (填字母)。
A.还原性 B.酸性 C.氧化性 D.挥发性
(4)请用双线桥法标出反应⑥电子转移的方向及数目:___________ ;产生1 mol  时,转移的电子的物质的量为准状况下的气体体积为
时,转移的电子的物质的量为准状况下的气体体积为___________ mol;1 mol  参加反应时,生成标准状况下的气体体积为
参加反应时,生成标准状况下的气体体积为___________ L。
①
 (未配平)
(未配平)②

③
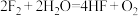
④

⑤
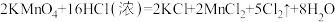
⑥

⑦
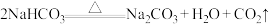
回答下列问题:
(1)上述反应中,既是分解反应,又是氧化还原反应的是
(2)反应①中的氧化剂是
(3)反应④中氧化产物和还原产物的质量之比为
A.还原性 B.酸性 C.氧化性 D.挥发性
(4)请用双线桥法标出反应⑥电子转移的方向及数目:
 时,转移的电子的物质的量为准状况下的气体体积为
时,转移的电子的物质的量为准状况下的气体体积为 参加反应时,生成标准状况下的气体体积为
参加反应时,生成标准状况下的气体体积为
您最近一年使用:0次
名校
9 . 铜及其化合物有着广泛的应用。某实验小组探究 的性质。
的性质。
I.实验准备:
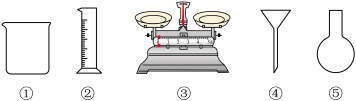
(1)由 固体配制
固体配制 溶液,下列仪器中需要使用的有
溶液,下列仪器中需要使用的有_________ (填序号)。
实验任务:探究 溶液分别与
溶液分别与 、
、 溶液的反应
溶液的反应
查阅资料:
已知:a.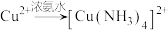 (深蓝色溶液)
(深蓝色溶液)
b. (无色溶液)
(无色溶液) (深蓝色溶液)
(深蓝色溶液)
设计方案并完成实验:
现象分析与验证:
(2)推测实验B产生的无色气体为 ,实验验证:用蘸有碘水的淀粉试纸接近试管口,观察到
,实验验证:用蘸有碘水的淀粉试纸接近试管口,观察到__________ 。
(3)推测实验B中的白色沉淀为 ,实验验证步骤如下:
,实验验证步骤如下:
①实验B完成后,立即过滤、洗涤。
②取少量已洗净的白色沉淀于试管中,滴加足量________ ,观察到沉淀溶解,得到无色溶液,此反应的离子方程式为__________ ;露置在空气中一段时间,观察到溶液变为深蓝色。
(4)对比实验A、B,提出假设: 增强了
增强了 的氧化性。
的氧化性。
①若假设合理,实验B反应的离子方程式为
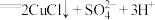 和
和__________ 。
②下述实验C证实了假设合理,装置如图8(两个电极均为碳棒)。实验方案:闭合K,电压表的指针偏转至“X”处;向U形__________ (补全实验操作及现象)。
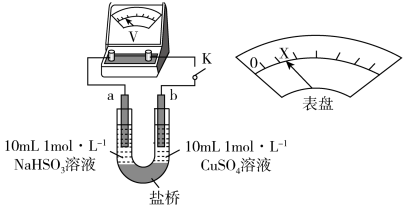
Ⅱ. 能与
能与 、
、 、
、 、
、 等形成配位数为4的配合物。
等形成配位数为4的配合物。
(5)硫酸铜溶液呈蓝色的原因是溶液中存在配离子_________ (填化学式)。
(6)常见配合物的形成实验
 的性质。
的性质。I.实验准备:
(1)由
 固体配制
固体配制 溶液,下列仪器中需要使用的有
溶液,下列仪器中需要使用的有
实验任务:探究
 溶液分别与
溶液分别与 、
、 溶液的反应
溶液的反应查阅资料:
已知:a.
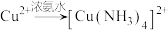 (深蓝色溶液)
(深蓝色溶液)b.
 (无色溶液)
(无色溶液) (深蓝色溶液)
(深蓝色溶液)设计方案并完成实验:
实验 | 装置 | 试剂x | 操作及现象 |
A |
| 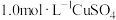 溶液 溶液 | 加入  溶液,得到绿色溶液, 溶液,得到绿色溶液, 未见明显变化。 未见明显变化。 |
B | 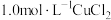 溶液 溶液 | 加入  溶液,得到绿色溶液, 溶液,得到绿色溶液,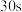 时有无色气泡和白色沉淀产生,上层溶液颜色变浅。 时有无色气泡和白色沉淀产生,上层溶液颜色变浅。 |
(2)推测实验B产生的无色气体为
 ,实验验证:用蘸有碘水的淀粉试纸接近试管口,观察到
,实验验证:用蘸有碘水的淀粉试纸接近试管口,观察到(3)推测实验B中的白色沉淀为
 ,实验验证步骤如下:
,实验验证步骤如下:①实验B完成后,立即过滤、洗涤。
②取少量已洗净的白色沉淀于试管中,滴加足量
(4)对比实验A、B,提出假设:
 增强了
增强了 的氧化性。
的氧化性。①若假设合理,实验B反应的离子方程式为

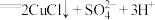 和
和②下述实验C证实了假设合理,装置如图8(两个电极均为碳棒)。实验方案:闭合K,电压表的指针偏转至“X”处;向U形

Ⅱ.
 能与
能与 、
、 、
、 、
、 等形成配位数为4的配合物。
等形成配位数为4的配合物。(5)硫酸铜溶液呈蓝色的原因是溶液中存在配离子
(6)常见配合物的形成实验
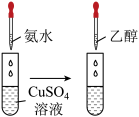
实验操作 | 实验现象 | 有关离子方程式 |
| 滴加氨水后,试管中首先出现蓝色沉淀,氨水过量后沉淀逐渐 |  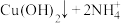   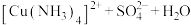 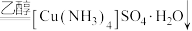 |
您最近一年使用:0次
2023-05-16更新
|
843次组卷
|
2卷引用:广东省梅州市2023届高三下学期第二次质检测试化学试题
10 . 某化学小组在研究Na2SO3溶液、FeCl3溶液性质及反应时,进行了下列实验:
(1) 取1mol•L﹣1的Na2SO3溶液置于空气中,测得其pH随时间的变化曲线如图所示:
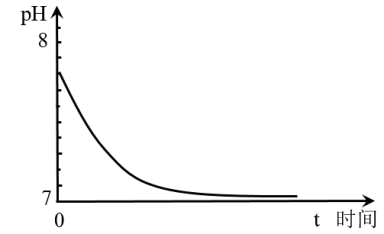
①最初,Na2SO3溶液pH=7.8,解释其原因的离子方程式是___________ 。
②t时间段内,造成其pH发生上述变化,用离子方程式解释是___________ 。
(2) 探究Na2SO3溶液与FeCl3溶液实际反应的情况:
实验ⅰ
实验ⅱ
①实验ⅱ证明,溶液中含有___________ 离子;
②对Na2SO3溶液与FeCl3溶液实际反应存在两种认识:
认识Ⅰ.反应中Fe3+完全转化为Fe2+ ,W溶液中c(Fe2+)一定很大,反应的离子方程式是___________ 。
认识Ⅱ.W溶液中c(Fe2+)应该极小,否则W溶液不会呈红褐色。
(3) 资料显示:Fe2+呈淡绿色、FeSO3是墨绿色沉淀、碱式硫酸铁[Fe4(OH)2(SO4)5]溶液为红褐色。
①实验中始终未出现墨绿色沉淀,说明c(Fe2+)极小,其原因用离子方程式解释是___________ 。
②实验过程和结果显示,O2、Fe3+、SO 的氧化性强弱顺序是
的氧化性强弱顺序是___________ 。
③若Fe4(OH)2(SO4)5是造成溶液W呈红褐色的原因之一,其形成的化学方程式是___________ 。
④用激光笔照射W溶液,发现有丁达尔现象,用离子方程式解释原因是___________ 。
(1) 取1mol•L﹣1的Na2SO3溶液置于空气中,测得其pH随时间的变化曲线如图所示:

①最初,Na2SO3溶液pH=7.8,解释其原因的离子方程式是
②t时间段内,造成其pH发生上述变化,用离子方程式解释是
(2) 探究Na2SO3溶液与FeCl3溶液实际反应的情况:
实验ⅰ
| 装置 | 操作 | 现象 |
 | 向2mL1mol•L﹣1FeCl3溶液中,逐滴滴加1mo•L﹣1Na2SO3溶液2mL | 溶液黄色逐渐加深,最终得红褐色溶液(W) |
| 装置 | 操作 | 现象 |
 | 取1mL溶液W于试管中,向其滴加过量盐酸,再滴加5滴BaCl2溶液 | 产生白色沉淀 |
②对Na2SO3溶液与FeCl3溶液实际反应存在两种认识:
认识Ⅰ.反应中Fe3+完全转化为Fe2+ ,W溶液中c(Fe2+)一定很大,反应的离子方程式是
认识Ⅱ.W溶液中c(Fe2+)应该极小,否则W溶液不会呈红褐色。
(3) 资料显示:Fe2+呈淡绿色、FeSO3是墨绿色沉淀、碱式硫酸铁[Fe4(OH)2(SO4)5]溶液为红褐色。
①实验中始终未出现墨绿色沉淀,说明c(Fe2+)极小,其原因用离子方程式解释是
②实验过程和结果显示,O2、Fe3+、SO
 的氧化性强弱顺序是
的氧化性强弱顺序是③若Fe4(OH)2(SO4)5是造成溶液W呈红褐色的原因之一,其形成的化学方程式是
④用激光笔照射W溶液,发现有丁达尔现象,用离子方程式解释原因是
您最近一年使用:0次



 溶液
溶液