1 . 某化学小组在研究Na2SO3溶液、FeCl3溶液性质及反应时,进行了下列实验:
(1) 取1mol•L﹣1的Na2SO3溶液置于空气中,测得其pH随时间的变化曲线如图所示:
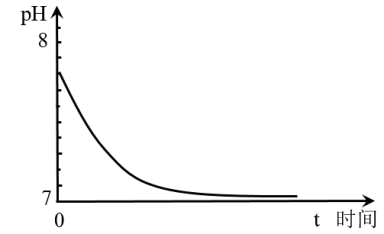
①最初,Na2SO3溶液pH=7.8,解释其原因的离子方程式是___________ 。
②t时间段内,造成其pH发生上述变化,用离子方程式解释是___________ 。
(2) 探究Na2SO3溶液与FeCl3溶液实际反应的情况:
实验ⅰ
实验ⅱ
①实验ⅱ证明,溶液中含有___________ 离子;
②对Na2SO3溶液与FeCl3溶液实际反应存在两种认识:
认识Ⅰ.反应中Fe3+完全转化为Fe2+ ,W溶液中c(Fe2+)一定很大,反应的离子方程式是___________ 。
认识Ⅱ.W溶液中c(Fe2+)应该极小,否则W溶液不会呈红褐色。
(3) 资料显示:Fe2+呈淡绿色、FeSO3是墨绿色沉淀、碱式硫酸铁[Fe4(OH)2(SO4)5]溶液为红褐色。
①实验中始终未出现墨绿色沉淀,说明c(Fe2+)极小,其原因用离子方程式解释是___________ 。
②实验过程和结果显示,O2、Fe3+、SO 的氧化性强弱顺序是
的氧化性强弱顺序是___________ 。
③若Fe4(OH)2(SO4)5是造成溶液W呈红褐色的原因之一,其形成的化学方程式是___________ 。
④用激光笔照射W溶液,发现有丁达尔现象,用离子方程式解释原因是___________ 。
(1) 取1mol•L﹣1的Na2SO3溶液置于空气中,测得其pH随时间的变化曲线如图所示:

①最初,Na2SO3溶液pH=7.8,解释其原因的离子方程式是
②t时间段内,造成其pH发生上述变化,用离子方程式解释是
(2) 探究Na2SO3溶液与FeCl3溶液实际反应的情况:
实验ⅰ
| 装置 | 操作 | 现象 |
 | 向2mL1mol•L﹣1FeCl3溶液中,逐滴滴加1mo•L﹣1Na2SO3溶液2mL | 溶液黄色逐渐加深,最终得红褐色溶液(W) |
| 装置 | 操作 | 现象 |
 | 取1mL溶液W于试管中,向其滴加过量盐酸,再滴加5滴BaCl2溶液 | 产生白色沉淀 |
②对Na2SO3溶液与FeCl3溶液实际反应存在两种认识:
认识Ⅰ.反应中Fe3+完全转化为Fe2+ ,W溶液中c(Fe2+)一定很大,反应的离子方程式是
认识Ⅱ.W溶液中c(Fe2+)应该极小,否则W溶液不会呈红褐色。
(3) 资料显示:Fe2+呈淡绿色、FeSO3是墨绿色沉淀、碱式硫酸铁[Fe4(OH)2(SO4)5]溶液为红褐色。
①实验中始终未出现墨绿色沉淀,说明c(Fe2+)极小,其原因用离子方程式解释是
②实验过程和结果显示,O2、Fe3+、SO
 的氧化性强弱顺序是
的氧化性强弱顺序是③若Fe4(OH)2(SO4)5是造成溶液W呈红褐色的原因之一,其形成的化学方程式是
④用激光笔照射W溶液,发现有丁达尔现象,用离子方程式解释原因是
您最近一年使用:0次
2 . 某化学兴趣小组为探究高锰酸钾与铜的反应,设计实验如下:
资料:a. 在酸性溶液中不能稳定存在:
在酸性溶液中不能稳定存在: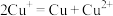
b. 为粉红色沉淀、溶于强酸;
为粉红色沉淀、溶于强酸; 为黑色沉淀、不溶于强酸
为黑色沉淀、不溶于强酸
(1) 被氧化成
被氧化成___________ ,依据是___________ 。
(2)为探究 的还原产物,取A区中溶液
的还原产物,取A区中溶液___________ (填操作和现象),证明有 生成。
生成。
(3)A区中 与
与 反应的离子方程式是
反应的离子方程式是___________ 。
(4)经检验,B区的棕黑色固体是 ,从溶液中离子扩散的角度,结合离子方程式解释B区和C区中的现象:
,从溶液中离子扩散的角度,结合离子方程式解释B区和C区中的现象:___________ 。
(5)小组同学又进行了以下定量实验:
通过计算,分析溶液紫色变浅而未完全褪色的原因:___________ 。
| 实验一 | 现象 |
  酸性溶液 酸性溶液 | 一段时间后,培养皿中由铜片向外侧依次呈现: A区澄清且几乎无色; B区底部覆盖棕黑色固体; C区澄清且紫色变浅 |
 在酸性溶液中不能稳定存在:
在酸性溶液中不能稳定存在: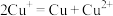
b.
 为粉红色沉淀、溶于强酸;
为粉红色沉淀、溶于强酸; 为黑色沉淀、不溶于强酸
为黑色沉淀、不溶于强酸(1)
 被氧化成
被氧化成(2)为探究
 的还原产物,取A区中溶液
的还原产物,取A区中溶液 生成。
生成。(3)A区中
 与
与 反应的离子方程式是
反应的离子方程式是(4)经检验,B区的棕黑色固体是
 ,从溶液中离子扩散的角度,结合离子方程式解释B区和C区中的现象:
,从溶液中离子扩散的角度,结合离子方程式解释B区和C区中的现象:(5)小组同学又进行了以下定量实验:
| 实验一 | 现象 |
 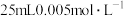  酸性溶液 酸性溶液 | 一段时间后,铜片质量减少了0.02g,溶液中无固体析出、溶液紫色变浅 |
您最近一年使用:0次
解题方法
3 . 已知: ,氢氧化铜悬浊液受热易分解生成
,氢氧化铜悬浊液受热易分解生成 。蚀刻含铜电路板有多种方法,用蚀刻废液可制备
。蚀刻含铜电路板有多种方法,用蚀刻废液可制备 。
。
(1)酸性蚀刻液法(过氧化氢-盐酸法)。
①用过氧化氢和盐酸蚀刻含铜电路板时发生的离子反应方程式为_______ 。
②反应后有气泡产生,且反应一段时间后,随着溶液变蓝,产生气泡的速率加快,可能的原因是_______ 。
(2)碱性蚀刻液法。碱性含铜蚀刻液主要成分为 、氨水、氯化铵等。蚀刻过程中,
、氨水、氯化铵等。蚀刻过程中, 与电路板上的铜发生反应生成
与电路板上的铜发生反应生成 ,失去蚀刻能力,通入空气可恢复蚀刻能力。
,失去蚀刻能力,通入空气可恢复蚀刻能力。
①
 中
中 键的数目为
键的数目为_______ 。
②蚀刻能力恢复的化学方程式为_______ 。
(3)酸性蚀刻废液与碱性蚀刻废液混和可析出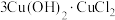 沉淀,pH在4~5之间易生成氢氧化铜胶体。酸性蚀刻废液与碱性蚀刻废液混和反应装置如图1所示。不同pH时,铜元素回收率如图2所示。
沉淀,pH在4~5之间易生成氢氧化铜胶体。酸性蚀刻废液与碱性蚀刻废液混和反应装置如图1所示。不同pH时,铜元素回收率如图2所示。
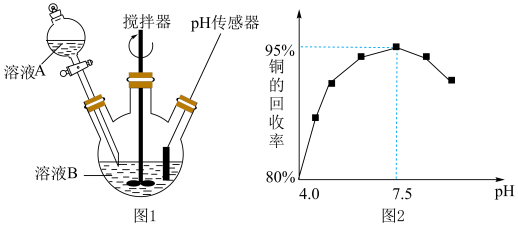
①为减少 胶体形成而影响后续操作,溶液A为
胶体形成而影响后续操作,溶液A为_______ (选填“酸性”或“碱性”)蚀刻废液。
② 时,铜元素回收率下降的原因为
时,铜元素回收率下降的原因为_______ 。
(4)设计从酸性蚀刻废液中制备氧化铜的实验方案。向一定质量的酸性蚀刻废液中_______ 。(实验中必须 使用的试剂:20% 溶液、硝酸银溶液、稀硝酸、蒸馏水)
溶液、硝酸银溶液、稀硝酸、蒸馏水)
 ,氢氧化铜悬浊液受热易分解生成
,氢氧化铜悬浊液受热易分解生成 。蚀刻含铜电路板有多种方法,用蚀刻废液可制备
。蚀刻含铜电路板有多种方法,用蚀刻废液可制备 。
。(1)酸性蚀刻液法(过氧化氢-盐酸法)。
①用过氧化氢和盐酸蚀刻含铜电路板时发生的离子反应方程式为
②反应后有气泡产生,且反应一段时间后,随着溶液变蓝,产生气泡的速率加快,可能的原因是
(2)碱性蚀刻液法。碱性含铜蚀刻液主要成分为
 、氨水、氯化铵等。蚀刻过程中,
、氨水、氯化铵等。蚀刻过程中, 与电路板上的铜发生反应生成
与电路板上的铜发生反应生成 ,失去蚀刻能力,通入空气可恢复蚀刻能力。
,失去蚀刻能力,通入空气可恢复蚀刻能力。①

 中
中 键的数目为
键的数目为②蚀刻能力恢复的化学方程式为
(3)酸性蚀刻废液与碱性蚀刻废液混和可析出
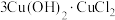 沉淀,pH在4~5之间易生成氢氧化铜胶体。酸性蚀刻废液与碱性蚀刻废液混和反应装置如图1所示。不同pH时,铜元素回收率如图2所示。
沉淀,pH在4~5之间易生成氢氧化铜胶体。酸性蚀刻废液与碱性蚀刻废液混和反应装置如图1所示。不同pH时,铜元素回收率如图2所示。
①为减少
 胶体形成而影响后续操作,溶液A为
胶体形成而影响后续操作,溶液A为②
 时,铜元素回收率下降的原因为
时,铜元素回收率下降的原因为(4)设计从酸性蚀刻废液中制备氧化铜的实验方案。向一定质量的酸性蚀刻废液中
 溶液、硝酸银溶液、稀硝酸、蒸馏水)
溶液、硝酸银溶液、稀硝酸、蒸馏水)
您最近一年使用:0次
21-22高三上·江苏南通·期末
名校
解题方法
4 . 用化学方法降解水中有机物已成为污水处理领域的重要研究方向。
(1)酸性条件下,铁炭混合物处理污水中硝基苯时的物质转化示意图如图1所示。
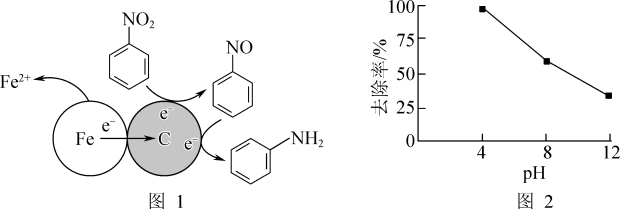
①该物质转化示意图可以描述为_______ 。
②其他条件一定,反应相同时间,硝基苯的去除率与pH的关系如图2所示。pH越大,硝基苯的去除率越低的原因是_______ 。
(2)向含Fe2+和苯胺(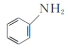 )的酸性溶液中加入双氧水,会发生如下反应:Fe2++H++H2O2=Fe3++HO·+H2O
)的酸性溶液中加入双氧水,会发生如下反应:Fe2++H++H2O2=Fe3++HO·+H2O
①HO·(羟基自由基)具有强氧化性,能将溶液中的苯胺氧化成CO2和N2。写出该反应的离子方程式:_______ 。
②H2O2也具有氧化性,设计验证苯胺是被HO·氧化而不是被H2O2氧化的实验方案:_______ 。
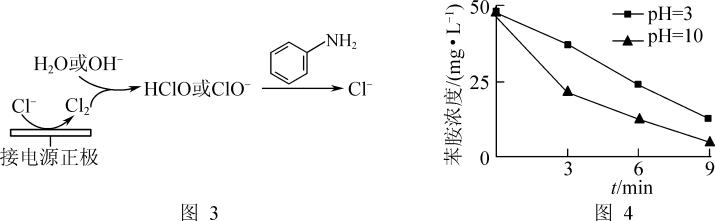
(3)利用电化学装置通过间接氧化法能氧化含苯胺的污水,其原理如图3所示。其他条件一定,测得不同初始pH条件下,溶液中苯胺的浓度与时间的关系如图4所示。反应相同时间,初始溶液pH=3时苯胺浓度大于pH=10时的原因是_______ 。[已知氧化性:HClO(H+)>ClO-(OH-)]
(1)酸性条件下,铁炭混合物处理污水中硝基苯时的物质转化示意图如图1所示。

①该物质转化示意图可以描述为
②其他条件一定,反应相同时间,硝基苯的去除率与pH的关系如图2所示。pH越大,硝基苯的去除率越低的原因是
(2)向含Fe2+和苯胺(
 )的酸性溶液中加入双氧水,会发生如下反应:Fe2++H++H2O2=Fe3++HO·+H2O
)的酸性溶液中加入双氧水,会发生如下反应:Fe2++H++H2O2=Fe3++HO·+H2O①HO·(羟基自由基)具有强氧化性,能将溶液中的苯胺氧化成CO2和N2。写出该反应的离子方程式:
②H2O2也具有氧化性,设计验证苯胺是被HO·氧化而不是被H2O2氧化的实验方案:
(3)利用电化学装置通过间接氧化法能氧化含苯胺的污水,其原理如图3所示。其他条件一定,测得不同初始pH条件下,溶液中苯胺的浓度与时间的关系如图4所示。反应相同时间,初始溶液pH=3时苯胺浓度大于pH=10时的原因是

您最近一年使用:0次
解题方法
5 . 化学需氧量(COD)是指用强氧化剂将1L废水中的还原性物质氧化为二氧化碳和水所消耗的氧化剂的量,并换算成以 为氧化剂时所消耗
为氧化剂时所消耗 的质量。水体COD值常作为水体中有机污染物相对含量的综合指标之一、Fenton(
的质量。水体COD值常作为水体中有机污染物相对含量的综合指标之一、Fenton( )法能产生
)法能产生 和具有强氧化性的羟基自由基(·OH)引发一系列链式反应,被广泛应用于有机废水的治理。
和具有强氧化性的羟基自由基(·OH)引发一系列链式反应,被广泛应用于有机废水的治理。
(1)羟基自由基(·OH)的电子式为_______ 。
(2)分别取初始pH=4、COD=80的废水200mL,加入200mL ,改变起始投加
,改变起始投加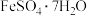 的量,反应相同时间。测得反应后水样COD随
的量,反应相同时间。测得反应后水样COD随 投加量的关系如图所示。当
投加量的关系如图所示。当 投加量超过1
投加量超过1 时,反应后水样COD不降反升的原因可能是
时,反应后水样COD不降反升的原因可能是_______ 。
(3)已知·OH更容易进攻有机物分子中电子云密度较大的基团。1-丁醇比正戊烷更容易受到·OH进攻的原因是_______ 。
(4)在Fenton法的基础上改进的基于硫酸根自由基(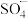 )的氧化技术引起关注。研究发现,一种
)的氧化技术引起关注。研究发现,一种 石墨烯纳米复合材料对催化活化
石墨烯纳米复合材料对催化活化 产生
产生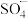 具有很好的效果。
具有很好的效果。 结构为
结构为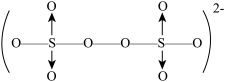 。
。
①与 试剂相比,
试剂相比, 一石墨烯/
一石墨烯/ 的使用范围更广。
的使用范围更广。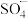 在强碱性条件下反应生成·OH,写出该反应的离子方程式:
在强碱性条件下反应生成·OH,写出该反应的离子方程式:_______ 。
②一种制取 一石墨烯纳米复合材料的物种转化关系可表示为(GO表示石墨烯)
一石墨烯纳米复合材料的物种转化关系可表示为(GO表示石墨烯)
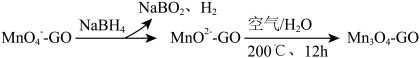
在石墨烯表面制得1mol ,理论上需要消耗
,理论上需要消耗 的物质的量为
的物质的量为_______ mol。
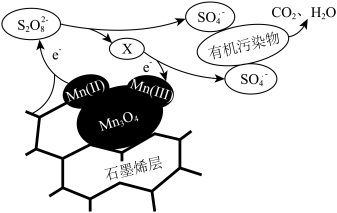
③利用该复合材料催化活化 并去除废水中有机污染物的可能反应机理如图所示。该机理可描述为
并去除废水中有机污染物的可能反应机理如图所示。该机理可描述为_______ 。
 为氧化剂时所消耗
为氧化剂时所消耗 的质量。水体COD值常作为水体中有机污染物相对含量的综合指标之一、Fenton(
的质量。水体COD值常作为水体中有机污染物相对含量的综合指标之一、Fenton( )法能产生
)法能产生 和具有强氧化性的羟基自由基(·OH)引发一系列链式反应,被广泛应用于有机废水的治理。
和具有强氧化性的羟基自由基(·OH)引发一系列链式反应,被广泛应用于有机废水的治理。(1)羟基自由基(·OH)的电子式为
(2)分别取初始pH=4、COD=80的废水200mL,加入200mL
 ,改变起始投加
,改变起始投加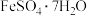 的量,反应相同时间。测得反应后水样COD随
的量,反应相同时间。测得反应后水样COD随 投加量的关系如图所示。当
投加量的关系如图所示。当 投加量超过1
投加量超过1 时,反应后水样COD不降反升的原因可能是
时,反应后水样COD不降反升的原因可能是
(3)已知·OH更容易进攻有机物分子中电子云密度较大的基团。1-丁醇比正戊烷更容易受到·OH进攻的原因是
(4)在Fenton法的基础上改进的基于硫酸根自由基(
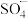 )的氧化技术引起关注。研究发现,一种
)的氧化技术引起关注。研究发现,一种 石墨烯纳米复合材料对催化活化
石墨烯纳米复合材料对催化活化 产生
产生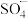 具有很好的效果。
具有很好的效果。 结构为
结构为 。
。①与
 试剂相比,
试剂相比, 一石墨烯/
一石墨烯/ 的使用范围更广。
的使用范围更广。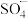 在强碱性条件下反应生成·OH,写出该反应的离子方程式:
在强碱性条件下反应生成·OH,写出该反应的离子方程式:②一种制取
 一石墨烯纳米复合材料的物种转化关系可表示为(GO表示石墨烯)
一石墨烯纳米复合材料的物种转化关系可表示为(GO表示石墨烯)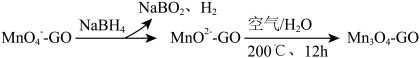
在石墨烯表面制得1mol
 ,理论上需要消耗
,理论上需要消耗 的物质的量为
的物质的量为③利用该复合材料催化活化
 并去除废水中有机污染物的可能反应机理如图所示。该机理可描述为
并去除废水中有机污染物的可能反应机理如图所示。该机理可描述为
您最近一年使用:0次
解题方法
6 . 过硫酸(H2S2O8)和过硫酸盐在工业上均可用作氧化剂。工业上利用过硫酸铵制备过氧化氢的一种方法如图。
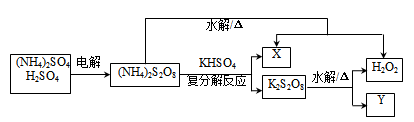
下列说法正确的是

下列说法正确的是
| A.X、Y的化学式分别为为NH4HSO4、KHSO4 |
| B.过硫酸具有强氧化性是因为硫为最高价+7价 |
| C.K2S2O8的水解反应温度越高越有利于生成H2O2 |
| D.过硫酸可用于工业漂白、外科消毒等领域 |
您最近一年使用:0次
名校
解题方法
7 . 水溶性硝态氮(以NO 、NO
、NO 等形式存在)是水体污染物之一,须处理达到国家规定的标准后才能排放。
等形式存在)是水体污染物之一,须处理达到国家规定的标准后才能排放。
(1)在反硝化细菌作用下,用葡萄糖处理酸性废水中的NO ,产生两种对大气无污染的气体。该反应的离子方程式为
,产生两种对大气无污染的气体。该反应的离子方程式为___________ 。
(2)纳米铁铜双金属有巨大的比表面积和很高的反应活性,可用于水体脱硝。
① 纳米铁铜双金属与普通铁铜双金属脱硝效果(以处理某硝酸盐为例)如图-1所示。在0到20min内,纳米铁铜双金属脱硝效果显著,其原因可能是___________ 。
② 研究表明水体中溶解氧的存在降低了纳米铁铜双金属脱硝的效果,验证的实验方案是______ 。

(3)Jetten 等人提出了利用厌氧氨氧化菌细胞中的三种酶处理废水中NH3和NO 的生化反应模型,其反应机理如图-2所示。在NR酶和HH酶作用下的反应过程可分别描述为
的生化反应模型,其反应机理如图-2所示。在NR酶和HH酶作用下的反应过程可分别描述为___________ 、___________ 。
 、NO
、NO 等形式存在)是水体污染物之一,须处理达到国家规定的标准后才能排放。
等形式存在)是水体污染物之一,须处理达到国家规定的标准后才能排放。(1)在反硝化细菌作用下,用葡萄糖处理酸性废水中的NO
 ,产生两种对大气无污染的气体。该反应的离子方程式为
,产生两种对大气无污染的气体。该反应的离子方程式为(2)纳米铁铜双金属有巨大的比表面积和很高的反应活性,可用于水体脱硝。
① 纳米铁铜双金属与普通铁铜双金属脱硝效果(以处理某硝酸盐为例)如图-1所示。在0到20min内,纳米铁铜双金属脱硝效果显著,其原因可能是
② 研究表明水体中溶解氧的存在降低了纳米铁铜双金属脱硝的效果,验证的实验方案是

(3)Jetten 等人提出了利用厌氧氨氧化菌细胞中的三种酶处理废水中NH3和NO
 的生化反应模型,其反应机理如图-2所示。在NR酶和HH酶作用下的反应过程可分别描述为
的生化反应模型,其反应机理如图-2所示。在NR酶和HH酶作用下的反应过程可分别描述为
您最近一年使用:0次
2022-01-11更新
|
899次组卷
|
5卷引用:江苏省南京市、盐城市2021-2022学年高三第一次模拟考试化学试题
江苏省南京市、盐城市2021-2022学年高三第一次模拟考试化学试题(已下线)江苏省南京市、盐城市2021-2022学年高三第一次模拟考试(原理综合题)(已下线)江苏省南京市、盐城市2021-2022学年高三第一次模拟考试(反应原理-氧化还原反应)(已下线)江苏省南京市、盐城市2021-2022学年高三第一次模拟考试(原理综合题)江苏省丹阳高级中学2022-2023学年高一下学期第二次月考化学试卷



