已知: ,氢氧化铜悬浊液受热易分解生成
,氢氧化铜悬浊液受热易分解生成 。蚀刻含铜电路板有多种方法,用蚀刻废液可制备
。蚀刻含铜电路板有多种方法,用蚀刻废液可制备 。
。
(1)酸性蚀刻液法(过氧化氢-盐酸法)。
①用过氧化氢和盐酸蚀刻含铜电路板时发生的离子反应方程式为_______ 。
②反应后有气泡产生,且反应一段时间后,随着溶液变蓝,产生气泡的速率加快,可能的原因是_______ 。
(2)碱性蚀刻液法。碱性含铜蚀刻液主要成分为 、氨水、氯化铵等。蚀刻过程中,
、氨水、氯化铵等。蚀刻过程中, 与电路板上的铜发生反应生成
与电路板上的铜发生反应生成 ,失去蚀刻能力,通入空气可恢复蚀刻能力。
,失去蚀刻能力,通入空气可恢复蚀刻能力。
①
 中
中 键的数目为
键的数目为_______ 。
②蚀刻能力恢复的化学方程式为_______ 。
(3)酸性蚀刻废液与碱性蚀刻废液混和可析出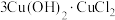 沉淀,pH在4~5之间易生成氢氧化铜胶体。酸性蚀刻废液与碱性蚀刻废液混和反应装置如图1所示。不同pH时,铜元素回收率如图2所示。
沉淀,pH在4~5之间易生成氢氧化铜胶体。酸性蚀刻废液与碱性蚀刻废液混和反应装置如图1所示。不同pH时,铜元素回收率如图2所示。
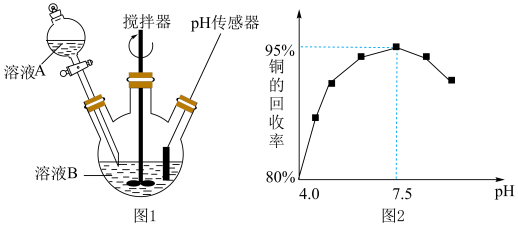
①为减少 胶体形成而影响后续操作,溶液A为
胶体形成而影响后续操作,溶液A为_______ (选填“酸性”或“碱性”)蚀刻废液。
② 时,铜元素回收率下降的原因为
时,铜元素回收率下降的原因为_______ 。
(4)设计从酸性蚀刻废液中制备氧化铜的实验方案。向一定质量的酸性蚀刻废液中_______ 。(实验中必须 使用的试剂:20% 溶液、硝酸银溶液、稀硝酸、蒸馏水)
溶液、硝酸银溶液、稀硝酸、蒸馏水)
 ,氢氧化铜悬浊液受热易分解生成
,氢氧化铜悬浊液受热易分解生成 。蚀刻含铜电路板有多种方法,用蚀刻废液可制备
。蚀刻含铜电路板有多种方法,用蚀刻废液可制备 。
。(1)酸性蚀刻液法(过氧化氢-盐酸法)。
①用过氧化氢和盐酸蚀刻含铜电路板时发生的离子反应方程式为
②反应后有气泡产生,且反应一段时间后,随着溶液变蓝,产生气泡的速率加快,可能的原因是
(2)碱性蚀刻液法。碱性含铜蚀刻液主要成分为
 、氨水、氯化铵等。蚀刻过程中,
、氨水、氯化铵等。蚀刻过程中, 与电路板上的铜发生反应生成
与电路板上的铜发生反应生成 ,失去蚀刻能力,通入空气可恢复蚀刻能力。
,失去蚀刻能力,通入空气可恢复蚀刻能力。①

 中
中 键的数目为
键的数目为②蚀刻能力恢复的化学方程式为
(3)酸性蚀刻废液与碱性蚀刻废液混和可析出
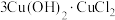 沉淀,pH在4~5之间易生成氢氧化铜胶体。酸性蚀刻废液与碱性蚀刻废液混和反应装置如图1所示。不同pH时,铜元素回收率如图2所示。
沉淀,pH在4~5之间易生成氢氧化铜胶体。酸性蚀刻废液与碱性蚀刻废液混和反应装置如图1所示。不同pH时,铜元素回收率如图2所示。
①为减少
 胶体形成而影响后续操作,溶液A为
胶体形成而影响后续操作,溶液A为②
 时,铜元素回收率下降的原因为
时,铜元素回收率下降的原因为(4)设计从酸性蚀刻废液中制备氧化铜的实验方案。向一定质量的酸性蚀刻废液中
 溶液、硝酸银溶液、稀硝酸、蒸馏水)
溶液、硝酸银溶液、稀硝酸、蒸馏水)
更新时间:2023-12-07 21:22:52
|
相似题推荐
解答题-工业流程题
|
较难
(0.4)
名校
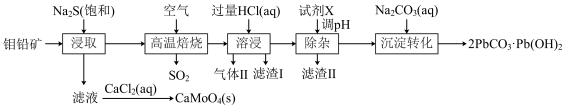
【推荐1】碱式碳酸铅 是一种重要的白色工业颜料,可由钼铅矿(主要成分
是一种重要的白色工业颜料,可由钼铅矿(主要成分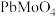 ,含
,含 、
、 等杂质)通过如下工艺流程制备:
等杂质)通过如下工艺流程制备:
已知:①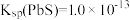 、
、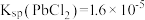 、
、 ;
;
② ;
;
③ 具有强氧化性。
具有强氧化性。
回答下列问题:
(1)“浸取”时,若要提高浸取率,可采取的措施有_______ 。(任答2条)
(2)已知“高温焙烧”铅转化为 ,则产生气体Ⅱ的离子反应方程式为
,则产生气体Ⅱ的离子反应方程式为_______ ,滤渣Ⅱ的成分是_______ 。
(3)“溶浸”过程中,若未加入过量的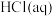 ,则会导致的后果是
,则会导致的后果是_______ 。除杂时,若要保证不引入新杂质,则试剂X最好为_______ (填序号)。
A. B.
B. C.
C. D.
D.
(4)生成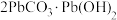 的离子反应方程式为
的离子反应方程式为_______ ,若对提纯后的产品进行热重分析,加热分解后得到如下曲线,则B点对应的物质的化学式为_______ 。

 是一种重要的白色工业颜料,可由钼铅矿(主要成分
是一种重要的白色工业颜料,可由钼铅矿(主要成分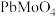 ,含
,含 、
、 等杂质)通过如下工艺流程制备:
等杂质)通过如下工艺流程制备:
已知:①
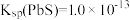 、
、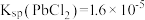 、
、 ;
;②
 ;
;③
 具有强氧化性。
具有强氧化性。回答下列问题:
(1)“浸取”时,若要提高浸取率,可采取的措施有
(2)已知“高温焙烧”铅转化为
 ,则产生气体Ⅱ的离子反应方程式为
,则产生气体Ⅱ的离子反应方程式为(3)“溶浸”过程中,若未加入过量的
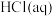 ,则会导致的后果是
,则会导致的后果是A.
 B.
B. C.
C. D.
D.
(4)生成
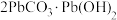 的离子反应方程式为
的离子反应方程式为
您最近半年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
解题方法
【推荐2】实验室以铬铁矿(主要成分是Fe(CrO2)2,还含有少量SiO2、Al2O3 等杂质)为原料制备重铬酸钾晶体( K2Cr2O7相对分子质量为294)的流程如图:

已知:操作1中高温条件下发生的反应有:
4FeO·Cr2O3+ 8Na2CO3 + 7O2 =8Na2CrO4 + 2Fe2O3 +8CO2↑;
Na2CO3 + Al2O3=2NaAlO2+CO2↑;
Na2CO3+ SiO2=Na2SiO3 +CO2↑。
请回答下列问题:
(1)Fe(CrO2)2中各元素化合价均为整数,将它用氧化物的形式表示为_______ 。
(2)“操作1”中的反应,为使反应速率增大,除升高温度外,还可采取的措施为_______ (写出一条)。
(3)固体X中主要含有_______ (填写化学式),固体Y中主要含有_______ (填写化学式)。
(4)加入强酸酸化使pH<3.0的原因是_______ (填写离子方程式和必要的文字)。
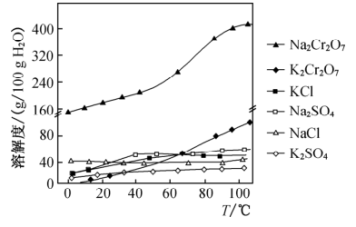
(5)请结合图示中有关物质的溶解度曲线,操作4为_______ ,过滤、洗涤、干燥。
(6)某工厂用152kg铬铁矿粉(含Cr2O340% )制备K2Cr2O7最终得到产品88.2kg,则产率为_______ 。

已知:操作1中高温条件下发生的反应有:
4FeO·Cr2O3+ 8Na2CO3 + 7O2 =8Na2CrO4 + 2Fe2O3 +8CO2↑;
Na2CO3 + Al2O3=2NaAlO2+CO2↑;
Na2CO3+ SiO2=Na2SiO3 +CO2↑。
请回答下列问题:
(1)Fe(CrO2)2中各元素化合价均为整数,将它用氧化物的形式表示为
(2)“操作1”中的反应,为使反应速率增大,除升高温度外,还可采取的措施为
(3)固体X中主要含有
(4)加入强酸酸化使pH<3.0的原因是
(5)请结合图示中有关物质的溶解度曲线,操作4为

(6)某工厂用152kg铬铁矿粉(含Cr2O340% )制备K2Cr2O7最终得到产品88.2kg,则产率为
您最近半年使用:0次
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐3】元素镍(Ni)在溶液中+3价极不稳定,主要以Ni2+(绿色)、[Ni(NH3)6]2+(蓝色)、[Ni(CN)4]2-(橙黄色)、[Ni(CN)5]3-(深红色)等形式存在。Ni(OH)2为难溶于水的浅绿色固体。
(1)Ni2+与Ag+化学性质相似。在NiSO4溶液中逐滴加入氨水直至过量,可观察到的现象是_________________ 。溶液中某离子浓度≤1.0×10-5mol·L-1可认为沉淀完全。室温下Ni(OH)2饱和溶液的pH=9,则溶液中的Ni2+恰好沉淀完全时的pH__________ 9(填“>”或“=”或“<”)。
(2)镍作为一种催化剂被广泛用于有机合成反应中,其制备原料是镍铝合金。通常用_____ 浓液处理该合金可制得多孔结构的镍,制备过程发生反应的离子方程式为____________ 。
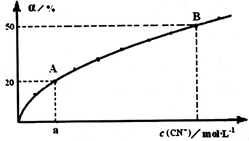
(3)[Ni(CN)4]2-和[Ni(CN)5]3-在溶液中可相互转化。室温下,某溶液中[Ni(CN)4]2-的转化率(α)与平衡时c(CN-)的关系如图所示。
①用离子方程式表示[Ni(CN)4]2-在溶液中的转化反应________________________ 。
②由图可知平衡转化率为50%时,c(CN-)=_________ mol·L-1(用含a的代数式表示)。
③已知该反应的△H<0,升高温度,该反应的平衡常数__________ (选填“增大”或“减小”或“不变”)。
(4)NiO(OH)为难溶于水的黑色固体,但可溶于浓盐酸并形成绿色溶液,其离子方程式为____________________________________ 。
(1)Ni2+与Ag+化学性质相似。在NiSO4溶液中逐滴加入氨水直至过量,可观察到的现象是
(2)镍作为一种催化剂被广泛用于有机合成反应中,其制备原料是镍铝合金。通常用
(3)[Ni(CN)4]2-和[Ni(CN)5]3-在溶液中可相互转化。室温下,某溶液中[Ni(CN)4]2-的转化率(α)与平衡时c(CN-)的关系如图所示。
①用离子方程式表示[Ni(CN)4]2-在溶液中的转化反应
②由图可知平衡转化率为50%时,c(CN-)=
③已知该反应的△H<0,升高温度,该反应的平衡常数
(4)NiO(OH)为难溶于水的黑色固体,但可溶于浓盐酸并形成绿色溶液,其离子方程式为
您最近半年使用:0次
解答题-结构与性质
|
较难
(0.4)
名校
解题方法
【推荐1】全球首次在350公里时速的奥运版复兴号高铁列车上依托5G技术打造的超高清直播演播室,实现了超高清信号的长时间稳定传输。请回答下列问题:
(1)5G芯片主要材质是高纯硅。基态Si原子价层电子的运动状态有_______ 种,若其电子排布式表示为[ Ne]3s2 违背了
违背了_______ 。
(2)高纯硅制备过程中会有SiHCl3、SiCl4等中间产物生成。沸点:SiHCl3_______ SiCl4(填“>”或“<”),与SiCl4互为等电子体的离子为_______ (任写1种即可)。已知电负性:H>Si,则SiHCl3充分水解的化学方程式为_______ 。
(3)复兴号高铁车体材质用到Mn、Co等元素。
①Mn的一种配合物化学式为[ Mn(CO)5( CH3CN)],下列说法正确的是_______ (填字母标号)。
A. CH3CN与Mn原子配位时,提供孤电子对的是C原子
B. Mn原子的配位数为6
C. CH3CN中C原子的杂化类型为sp2、sp3
D. CH3CN中σ键与π键数目之比为5:2
②已知r(Co2+) =65 pm,r(Mn2+) =67 pm,推测MnCO3比CoCO3的分解温度_______ (填“高”或“低”),解释原因_______ 。
(4)时速600公里的磁浮列车需用到超导材料。超导材料TiN具有NaCl型结构(如图) ,晶胞参数(晶胞边长)为aD(1D= 10 -10m) ,其中阴离子( N3- )采用面心立方最密堆积方式,则r(Ti3+)为_______ D,该氮化钛的密度_______ g· cm-3(列出计算式即可)。

(1)5G芯片主要材质是高纯硅。基态Si原子价层电子的运动状态有
 违背了
违背了(2)高纯硅制备过程中会有SiHCl3、SiCl4等中间产物生成。沸点:SiHCl3
(3)复兴号高铁车体材质用到Mn、Co等元素。
①Mn的一种配合物化学式为[ Mn(CO)5( CH3CN)],下列说法正确的是
A. CH3CN与Mn原子配位时,提供孤电子对的是C原子
B. Mn原子的配位数为6
C. CH3CN中C原子的杂化类型为sp2、sp3
D. CH3CN中σ键与π键数目之比为5:2
②已知r(Co2+) =65 pm,r(Mn2+) =67 pm,推测MnCO3比CoCO3的分解温度
(4)时速600公里的磁浮列车需用到超导材料。超导材料TiN具有NaCl型结构(如图) ,晶胞参数(晶胞边长)为aD(1D= 10 -10m) ,其中阴离子( N3- )采用面心立方最密堆积方式,则r(Ti3+)为

您最近半年使用:0次
解答题-结构与性质
|
较难
(0.4)
名校
解题方法
【推荐2】H、C、N、O、Na、Fe、Cu是常见的七种元素。
(1)N、Na+、Fe3+、Cu2+四种微粒基态的核外电子排布式中未成对电子数最多的是____________ 。
(2)根据价层电子对互斥理论判断下列分子或离子中空间构型是V形的是______ (填写序号)。
a.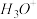 b.
b. 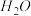 c.
c. 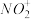 d.
d. 
(3)分子(CN)2中键与键之间的夹角为180°,并有对称性,分子中每个原子最外层均满足8电子稳定结构,其结构式为___________ ,1个分子中含有_________ 个π键。
(4)O和Na形成的一种只含有离子键的离子化合物,其晶胞结构如图,该离子化合物的化学式为_____________ 。已知该晶胞的密度为ρg/cm3,阿伏伽德罗常数为NA,求晶胞边长
_______ cm。(用含ρ、NA的代数式表示)
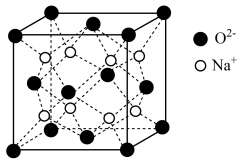
(1)N、Na+、Fe3+、Cu2+四种微粒基态的核外电子排布式中未成对电子数最多的是
(2)根据价层电子对互斥理论判断下列分子或离子中空间构型是V形的是
a.
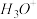 b.
b. 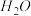 c.
c. 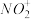 d.
d. 
(3)分子(CN)2中键与键之间的夹角为180°,并有对称性,分子中每个原子最外层均满足8电子稳定结构,其结构式为
(4)O和Na形成的一种只含有离子键的离子化合物,其晶胞结构如图,该离子化合物的化学式为


您最近半年使用:0次
解答题-结构与性质
|
较难
(0.4)
解题方法
【推荐3】2019年10月1日,在庆祝中华人民共和国成立70周年的阅兵仪式上,最后亮相的DF-31A洲际战略导弹是我国大国地位、国防实力的显著标志。其制作材料中包含了Fe、Cr、Ni、C等多种元素。回答下列问题:
(1)基态Cr原子的价电子排布式为___ 。
(2)实验室常用KSCN溶液、苯酚( )检验Fe3+。
)检验Fe3+。
①第一电离能:N___ O(填“>”或“<”)。
②1mol苯酚中含有的σ数目为___ 。
③苯酚中的氧原子和碳原子均采用相同的杂化方式,其类型为___ 。
④从结构的角度分析苯酚的酚羟基有弱酸性的原因为___ 。
(3)碳的一种同素异形体的晶体可采取非最密堆积,然后在空隙中插入金属离子获得超导体。如图为一种超导体的面心立方晶胞,C60分子占据顶点和面心处,K+占据的是C60分子围成的___ 空隙和___ 空隙(填几何空间构型);若C60分子的坐标参数分别为A(0,0,0),B( ,0,
,0, ),C(1,1,1)等,则距离A位置最近的阳离子的原子坐标参数为
),C(1,1,1)等,则距离A位置最近的阳离子的原子坐标参数为___ 。

(4)Ni可以形成多种氧化物,其中一种NiaO晶体晶胞结构为NaCl型,由于晶体缺陷,a的值为0.88,且晶体中的Ni分别为Ni2+、Ni3+,则晶体Ni2与Ni3+产的最简整数比为___ ,晶胞参数为428pm,则晶体密度为___ g•cm-3(NA表示阿伏加 德罗常数的值,列出表达式)。
(1)基态Cr原子的价电子排布式为
(2)实验室常用KSCN溶液、苯酚(
 )检验Fe3+。
)检验Fe3+。①第一电离能:N
②1mol苯酚中含有的σ数目为
③苯酚中的氧原子和碳原子均采用相同的杂化方式,其类型为
④从结构的角度分析苯酚的酚羟基有弱酸性的原因为
(3)碳的一种同素异形体的晶体可采取非最密堆积,然后在空隙中插入金属离子获得超导体。如图为一种超导体的面心立方晶胞,C60分子占据顶点和面心处,K+占据的是C60分子围成的
 ,0,
,0, ),C(1,1,1)等,则距离A位置最近的阳离子的原子坐标参数为
),C(1,1,1)等,则距离A位置最近的阳离子的原子坐标参数为
(4)Ni可以形成多种氧化物,其中一种NiaO晶体晶胞结构为NaCl型,由于晶体缺陷,a的值为0.88,且晶体中的Ni分别为Ni2+、Ni3+,则晶体Ni2与Ni3+产的最简整数比为
您最近半年使用:0次
解答题-实验探究题
|
较难
(0.4)
名校
解题方法
【推荐1】氯化亚铜(CuCl)广泛应用于化工、印染、电镀等行业,是难溶于水的白色固体,能溶解于硝酸,在潮湿空气中可被迅速氧化。实验室用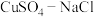 混合液与
混合液与 溶液反应制取CuCl。相关装置及数据如图:
溶液反应制取CuCl。相关装置及数据如图:

回答以下问题:
(1)图甲中仪器1的名称是___________ ;制备过程中 过量会发生副反应生成
过量会发生副反应生成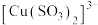 ,为提高产率,仪器2中所加试剂应为
,为提高产率,仪器2中所加试剂应为___________ 。
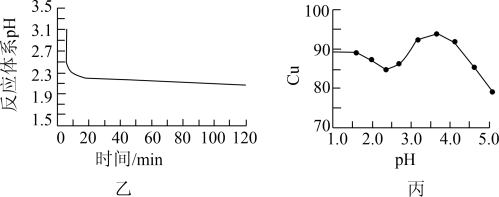
(2)如图乙所示是体系pH随时间变化关系图,写出制备CuCl的离子方程式___________ 。丙图是产率随pH变化关系图,实验过程中往往用 混合溶液代替
混合溶液代替 溶液,其中
溶液,其中 的作用是
的作用是___________ ,为保证较高产率pH应维持在___________ 左右。
(3)反应完成后经抽滤、洗涤、干燥获得产品。洗涤时,用“去氧水”作洗涤剂洗涤产品,作用是___________ 。
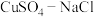 混合液与
混合液与 溶液反应制取CuCl。相关装置及数据如图:
溶液反应制取CuCl。相关装置及数据如图:
回答以下问题:
(1)图甲中仪器1的名称是
 过量会发生副反应生成
过量会发生副反应生成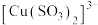 ,为提高产率,仪器2中所加试剂应为
,为提高产率,仪器2中所加试剂应为(2)如图乙所示是体系pH随时间变化关系图,写出制备CuCl的离子方程式
 混合溶液代替
混合溶液代替 溶液,其中
溶液,其中 的作用是
的作用是
(3)反应完成后经抽滤、洗涤、干燥获得产品。洗涤时,用“去氧水”作洗涤剂洗涤产品,作用是
您最近半年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
解题方法
【推荐2】工业上,处理低品位黄铜矿( 含量较低)常采用生物堆浸法。堆浸所得的溶液可用于制备碳酸亚铁和胆矾,相关流程如下图所示。
含量较低)常采用生物堆浸法。堆浸所得的溶液可用于制备碳酸亚铁和胆矾,相关流程如下图所示。
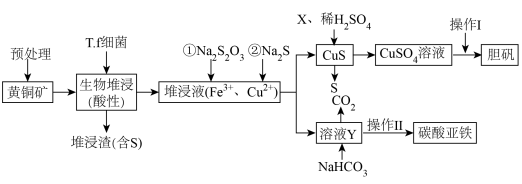
已知:①硫杆菌(T.f细菌)在 为
为 范围内可保持活性。
范围内可保持活性。
②金属离子沉淀的 如下表。
如下表。
回答下列问题:
(1) 中各元素均显常见价态且铜显最高价,则铁显
中各元素均显常见价态且铜显最高价,则铁显___________ 价;预处理的内容包括矿石的筛选、___________ 。
(2)生物堆浸(在空气环境中)过程中,溶液的 范围应控制在
范围应控制在___________ 较好;生物堆浸主要涉及两个反应:①___________ (写离子方程式),②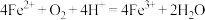 。
。
(3)堆浸液中加入 固体会还原
固体会还原 得到溶液
得到溶液 ,该反应
,该反应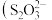 被氧化为
被氧化为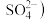 的氧化剂与还原剂物质的量之比为
的氧化剂与还原剂物质的量之比为___________ ,X是常用的绿色氧化剂,如 、
、___________ 。
(4)“操作I”是___________ 、过滤、洗涤、干燥。
(5)写出生成 的化学方程式:
的化学方程式:___________ 。
 含量较低)常采用生物堆浸法。堆浸所得的溶液可用于制备碳酸亚铁和胆矾,相关流程如下图所示。
含量较低)常采用生物堆浸法。堆浸所得的溶液可用于制备碳酸亚铁和胆矾,相关流程如下图所示。
已知:①硫杆菌(T.f细菌)在
 为
为 范围内可保持活性。
范围内可保持活性。②金属离子沉淀的
 如下表。
如下表。 |  |  | |
开始沉淀时的 | 1.5 | 4.2 | 6.3 |
完全沉淀时的 | 2.8 | 6.7 | 8.3 |
(1)
 中各元素均显常见价态且铜显最高价,则铁显
中各元素均显常见价态且铜显最高价,则铁显(2)生物堆浸(在空气环境中)过程中,溶液的
 范围应控制在
范围应控制在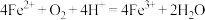 。
。(3)堆浸液中加入
 固体会还原
固体会还原 得到溶液
得到溶液 ,该反应
,该反应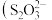 被氧化为
被氧化为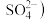 的氧化剂与还原剂物质的量之比为
的氧化剂与还原剂物质的量之比为 、
、(4)“操作I”是
(5)写出生成
 的化学方程式:
的化学方程式:
您最近半年使用:0次
解答题-实验探究题
|
较难
(0.4)
名校
解题方法
【推荐3】某小组为了探究 溶液和
溶液和 溶液反应的情况,开展了如下活动。回答下列问题:
溶液反应的情况,开展了如下活动。回答下列问题:
【查阅资料】
①CuCl、CuI为难溶于水的白色固体;
② 在酸性环境中易歧化为Cu和
在酸性环境中易歧化为Cu和 ;
;
③ (无色溶液)
(无色溶液)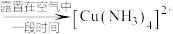 (深蓝色溶液)
(深蓝色溶液)
【理论预测】 溶液和
溶液和 溶液反应的主要含铜产物的可能情况:
溶液反应的主要含铜产物的可能情况:
(1)二者因发生复分解反应生成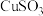 ;二者因发生双水解反应生成
;二者因发生双水解反应生成___________ ;二者因发生氧化还原反应生成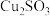 、CuCl;……
、CuCl;……
【实验探究一】 溶液和
溶液和 溶液反应
溶液反应
(2)取少量实验1中已洗净的白色沉淀于试管中,滴加足量浓氨水,先观察到___________ ,反应的离子方程式为___________ ;露置一段时间,又观察到___________ ,证明白色沉淀为CuCl。
【实验探究二】棕黄色沉淀的成分探究
(3)实验1中棕黄色沉淀存在时间较短,难以获得。实验小组将实验1中的 溶液替换为等体积等浓度的
溶液替换为等体积等浓度的___________ 溶液,成功制备了棕黄色沉淀,并进行了如下实验。
(4)实验2中可观察到现象:___________ ,证棕黄色沉淀中含有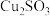 。
。
(5)实验3中因发生了反应___________ 、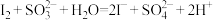 ,使得上层清液呈无色且不能使淀粉溶液变蓝;白色沉淀B是
,使得上层清液呈无色且不能使淀粉溶液变蓝;白色沉淀B是 ,试剂1是
,试剂1是___________ ;据此证明棕黄色沉淀中含有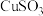 。
。
 溶液和
溶液和 溶液反应的情况,开展了如下活动。回答下列问题:
溶液反应的情况,开展了如下活动。回答下列问题:【查阅资料】
①CuCl、CuI为难溶于水的白色固体;
②
 在酸性环境中易歧化为Cu和
在酸性环境中易歧化为Cu和 ;
;③
 (无色溶液)
(无色溶液)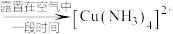 (深蓝色溶液)
(深蓝色溶液)【理论预测】
 溶液和
溶液和 溶液反应的主要含铜产物的可能情况:
溶液反应的主要含铜产物的可能情况:(1)二者因发生复分解反应生成
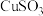 ;二者因发生双水解反应生成
;二者因发生双水解反应生成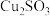 、CuCl;……
、CuCl;……【实验探究一】
 溶液和
溶液和 溶液反应
溶液反应| 编号 | 实验操作 | 实验现象 |
| 1 | 2mL0.2  溶液和1mL0.2 溶液和1mL0.2  溶液混合 溶液混合 | 立即有棕黄色沉淀生成,3min后沉淀颜色变浅并伴有少量白色沉淀产生,再振荡1min后沉淀全部变为白色 |
(2)取少量实验1中已洗净的白色沉淀于试管中,滴加足量浓氨水,先观察到
【实验探究二】棕黄色沉淀的成分探究
(3)实验1中棕黄色沉淀存在时间较短,难以获得。实验小组将实验1中的
 溶液替换为等体积等浓度的
溶液替换为等体积等浓度的| 编号 | 实验操作 |
| 2 | 取少量洗净的裟黄色沉淀于试管中,并加入一定量的稀硫酸 |
| 3 | 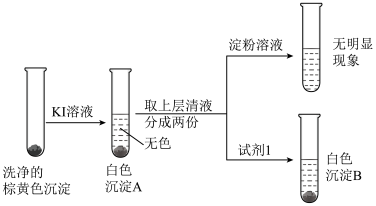 注:实验所用试剂均经过除氧处理 |
(4)实验2中可观察到现象:
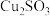 。
。(5)实验3中因发生了反应
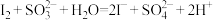 ,使得上层清液呈无色且不能使淀粉溶液变蓝;白色沉淀B是
,使得上层清液呈无色且不能使淀粉溶液变蓝;白色沉淀B是 ,试剂1是
,试剂1是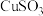 。
。
您最近半年使用:0次



