解题方法
1 . 生活处处离不开化学。阅读材料,完成各题:
材料一:人体胃液中含有胃酸(0.2%~0.4%的盐酸),起杀菌、帮助消化等作用。当胃酸过多时,医生通常用“胃舒平”[主要成分是Al(OH)3] 或“小苏打片”(主要成分是NaHCO3) 给病人治疗。
(1)写出NaHCO3在水中的电离方程式___________ 。
(2)病人同时患有胃溃疡,此时最宜服用___________ (填“小苏打片”或“胃舒平”),发生反应的化学方程式为___________ 。
材料二:维生素C又称“抗坏血酸”,因为它能够保护身体免于氧化剂的威胁。维生素C同时也是一种辅酶,能增强人体对疾病的抵抗能力。
(3)将维生素C溶于水后向溶液中滴加几滴紫色石蕊试液,试液变红,说明维生素C的水溶液呈___________性。
(4)亚铁离子易被吸收,给贫血者补充铁时,应给予含亚铁离子的亚铁盐,如硫酸亚铁。服用维生素C,可使食物中的铁离子转化成亚铁离子,有利于铁的吸收。上述反应中维生素C是___________ 剂。
材料一:人体胃液中含有胃酸(0.2%~0.4%的盐酸),起杀菌、帮助消化等作用。当胃酸过多时,医生通常用“胃舒平”[主要成分是Al(OH)3] 或“小苏打片”(主要成分是NaHCO3) 给病人治疗。
(1)写出NaHCO3在水中的电离方程式
(2)病人同时患有胃溃疡,此时最宜服用
材料二:维生素C又称“抗坏血酸”,因为它能够保护身体免于氧化剂的威胁。维生素C同时也是一种辅酶,能增强人体对疾病的抵抗能力。
(3)将维生素C溶于水后向溶液中滴加几滴紫色石蕊试液,试液变红,说明维生素C的水溶液呈___________性。
| A.酸性 | B.碱性 | C.氧化性 | D.还原性 |
您最近一年使用:0次
名校
解题方法
2 . 生产芯片的半导体材料有硅、锗、砷化镓等,应用比较广泛的是硅。硅可由石英砂(主要成分是二氧化硅)制得,制备高纯硅的主要工艺流程如图所示:

资料:①SiHCl3能与H2O剧烈反应,在空气中易自燃;②粗SiHCl3 (沸点33.0℃)中含有少量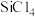 (沸点57.6℃)和HCl(沸点-84.7℃)
(沸点57.6℃)和HCl(沸点-84.7℃)
(1)流程①焦炭体现了___________ (填“氧化性”或“还原性”)。
(2)流程③提纯SiHCl3的操作是___________ 。
(3)流程④的化学反应为置换反应,写出其化学方程式:___________ 。
流程④制备高纯硅的装置如图(热源及夹持装置略去):

(4)若要从下列玻璃仪器中选择部分来组装A处的气体发生装置,需要的是___________ (填选项编号):
a. 分液漏斗 b.烧瓶 c.酒精灯 d.大试管 e.漏斗 f.烧杯 g.导管
装置B中的试剂是___________ (填试剂名称);装置C中的烧瓶需要加热,其目的是___________ 。
(5)反应一段时间后,装置D中观察到的现象是___________ 。
(6)为保证制备高纯硅实验的成功,操作的关键是检查实验装置的气密性,控制好反应温度以及___________ ,该流程中能够循环利用的物质是___________ 。

资料:①SiHCl3能与H2O剧烈反应,在空气中易自燃;②粗SiHCl3 (沸点33.0℃)中含有少量
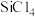 (沸点57.6℃)和HCl(沸点-84.7℃)
(沸点57.6℃)和HCl(沸点-84.7℃)(1)流程①焦炭体现了
(2)流程③提纯SiHCl3的操作是
(3)流程④的化学反应为置换反应,写出其化学方程式:
流程④制备高纯硅的装置如图(热源及夹持装置略去):

(4)若要从下列玻璃仪器中选择部分来组装A处的气体发生装置,需要的是
a. 分液漏斗 b.烧瓶 c.酒精灯 d.大试管 e.漏斗 f.烧杯 g.导管
装置B中的试剂是
(5)反应一段时间后,装置D中观察到的现象是
(6)为保证制备高纯硅实验的成功,操作的关键是检查实验装置的气密性,控制好反应温度以及
您最近一年使用:0次
2022高三·全国·专题练习
解题方法
3 . 亚硝酸钠(NaNO2)外观酷似食盐且有咸味,是一种常用的发色剂和防腐剂。查阅资料知:酸性条件下NaNO2具有氧化性。利用所供试剂,设计实验方案验证此信息:_______ (供选用的试剂有NaNO2溶液、FeSO4溶液、稀硫酸、KSCN溶液)
您最近一年使用:0次
解题方法
4 . 铁及其合金在工农业生产和日常生活中有广泛的应用。
(1)高铁的快速发展方便了人们的出行,工业上利用铝热反应焊接钢轨间的缝隙,写出Al和Fe2O3混合粉末发生铝热反应的化学方程式______ 。该反应的反应原理是______ 。
(2)琥珀酸亚铁,化学式为FeC4H4O4是一种常见高效补血药,易溶于水,在水溶液中发生电离:FeC4H4O4=Fe2++ ,有较强还原性。
,有较强还原性。
①取少量琥珀酸亚铁溶液,滴加NaOH溶液,写出反应的离子方程式______ 。
②取少量琥珀酸亚铁溶液,滴加KSCN溶液,溶液呈很浅的红色,滴加少量氯水溶液颜色变深。
溶液呈很浅的红色是因为Fe2+与氧气反应生成了Fe3+和水,写出酸性条件下发生该反应的离子方程式:______ 。用离子方程式表示滴加少量氯水溶液颜色变深的原因:______ 和Fe3++3SCN- Fe(SCN)3。
Fe(SCN)3。
③服用琥珀酸亚铁时医生经常建议同时服用维生素C(又叫抗坏血酸),说明维生素C具有______ 。
A.强氧化性 B.强还原性 C.强酸性 D.很强的甜味
(3)2019年诺贝尔化学奖颁给锂离子电池领域,获奖科学家的重要贡献之一是研发出了电极材料——磷酸亚铁锂(LiFePO4),LiFePO4的一种制备方法如下。
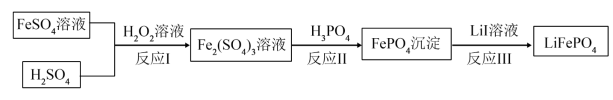
①写出反应Ⅰ的离子方程式______ 。
②反应Ⅲ中氧化剂是______ (填化学式)。
(1)高铁的快速发展方便了人们的出行,工业上利用铝热反应焊接钢轨间的缝隙,写出Al和Fe2O3混合粉末发生铝热反应的化学方程式
(2)琥珀酸亚铁,化学式为FeC4H4O4是一种常见高效补血药,易溶于水,在水溶液中发生电离:FeC4H4O4=Fe2++
 ,有较强还原性。
,有较强还原性。①取少量琥珀酸亚铁溶液,滴加NaOH溶液,写出反应的离子方程式
②取少量琥珀酸亚铁溶液,滴加KSCN溶液,溶液呈很浅的红色,滴加少量氯水溶液颜色变深。
溶液呈很浅的红色是因为Fe2+与氧气反应生成了Fe3+和水,写出酸性条件下发生该反应的离子方程式:
 Fe(SCN)3。
Fe(SCN)3。③服用琥珀酸亚铁时医生经常建议同时服用维生素C(又叫抗坏血酸),说明维生素C具有
A.强氧化性 B.强还原性 C.强酸性 D.很强的甜味
(3)2019年诺贝尔化学奖颁给锂离子电池领域,获奖科学家的重要贡献之一是研发出了电极材料——磷酸亚铁锂(LiFePO4),LiFePO4的一种制备方法如下。

①写出反应Ⅰ的离子方程式
②反应Ⅲ中氧化剂是
您最近一年使用:0次
5 . 下列化学反应中:
① (未配平)
(未配平)
②
③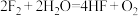
④
⑤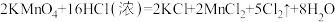
⑥
⑦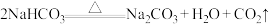
回答下列问题:
(1)上述反应中,既是分解反应,又是氧化还原反应的是___________ (填序号)。
(2)反应①中的氧化剂是___________ ,被氧化的元素是___________ ,用化合价升降法配平①中的反应方程式:___________ 。
(3)反应④中氧化产物和还原产物的质量之比为___________ ;反应⑤中浓盐酸表现出的性质是___________ (填字母)。
A.还原性 B.酸性 C.氧化性 D.挥发性
(4)请用双线桥法标出反应⑥电子转移的方向及数目:___________ ;产生1 mol  时,转移的电子的物质的量为准状况下的气体体积为
时,转移的电子的物质的量为准状况下的气体体积为___________ mol;1 mol  参加反应时,生成标准状况下的气体体积为
参加反应时,生成标准状况下的气体体积为___________ L。
①
 (未配平)
(未配平)②

③
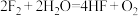
④

⑤
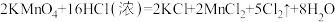
⑥

⑦
回答下列问题:
(1)上述反应中,既是分解反应,又是氧化还原反应的是
(2)反应①中的氧化剂是
(3)反应④中氧化产物和还原产物的质量之比为
A.还原性 B.酸性 C.氧化性 D.挥发性
(4)请用双线桥法标出反应⑥电子转移的方向及数目:
 时,转移的电子的物质的量为准状况下的气体体积为
时,转移的电子的物质的量为准状况下的气体体积为 参加反应时,生成标准状况下的气体体积为
参加反应时,生成标准状况下的气体体积为
您最近一年使用:0次
名校
6 . 铜及其化合物有着广泛的应用。某实验小组探究 的性质。
的性质。
I.实验准备:
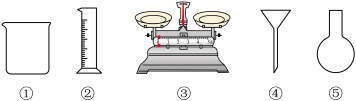
(1)由 固体配制
固体配制 溶液,下列仪器中需要使用的有
溶液,下列仪器中需要使用的有_________ (填序号)。
实验任务:探究 溶液分别与
溶液分别与 、
、 溶液的反应
溶液的反应
查阅资料:
已知:a.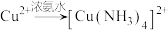 (深蓝色溶液)
(深蓝色溶液)
b. (无色溶液)
(无色溶液) (深蓝色溶液)
(深蓝色溶液)
设计方案并完成实验:
现象分析与验证:
(2)推测实验B产生的无色气体为 ,实验验证:用蘸有碘水的淀粉试纸接近试管口,观察到
,实验验证:用蘸有碘水的淀粉试纸接近试管口,观察到__________ 。
(3)推测实验B中的白色沉淀为 ,实验验证步骤如下:
,实验验证步骤如下:
①实验B完成后,立即过滤、洗涤。
②取少量已洗净的白色沉淀于试管中,滴加足量________ ,观察到沉淀溶解,得到无色溶液,此反应的离子方程式为__________ ;露置在空气中一段时间,观察到溶液变为深蓝色。
(4)对比实验A、B,提出假设: 增强了
增强了 的氧化性。
的氧化性。
①若假设合理,实验B反应的离子方程式为
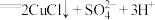 和
和__________ 。
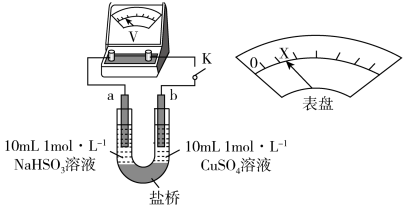
②下述实验C证实了假设合理,装置如图8(两个电极均为碳棒)。实验方案:闭合K,电压表的指针偏转至“X”处;向U形__________ (补全实验操作及现象)。
Ⅱ. 能与
能与 、
、 、
、 、
、 等形成配位数为4的配合物。
等形成配位数为4的配合物。
(5)硫酸铜溶液呈蓝色的原因是溶液中存在配离子_________ (填化学式)。
(6)常见配合物的形成实验
 的性质。
的性质。I.实验准备:
(1)由
 固体配制
固体配制 溶液,下列仪器中需要使用的有
溶液,下列仪器中需要使用的有
实验任务:探究
 溶液分别与
溶液分别与 、
、 溶液的反应
溶液的反应查阅资料:
已知:a.
 (深蓝色溶液)
(深蓝色溶液)b.
 (无色溶液)
(无色溶液) (深蓝色溶液)
(深蓝色溶液)设计方案并完成实验:
实验 | 装置 | 试剂x | 操作及现象 |
A |
|  溶液 溶液 | 加入  溶液,得到绿色溶液, 溶液,得到绿色溶液, 未见明显变化。 未见明显变化。 |
B | 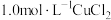 溶液 溶液 | 加入  溶液,得到绿色溶液, 溶液,得到绿色溶液, 时有无色气泡和白色沉淀产生,上层溶液颜色变浅。 时有无色气泡和白色沉淀产生,上层溶液颜色变浅。 |
(2)推测实验B产生的无色气体为
 ,实验验证:用蘸有碘水的淀粉试纸接近试管口,观察到
,实验验证:用蘸有碘水的淀粉试纸接近试管口,观察到(3)推测实验B中的白色沉淀为
 ,实验验证步骤如下:
,实验验证步骤如下:①实验B完成后,立即过滤、洗涤。
②取少量已洗净的白色沉淀于试管中,滴加足量
(4)对比实验A、B,提出假设:
 增强了
增强了 的氧化性。
的氧化性。①若假设合理,实验B反应的离子方程式为

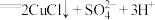 和
和②下述实验C证实了假设合理,装置如图8(两个电极均为碳棒)。实验方案:闭合K,电压表的指针偏转至“X”处;向U形

Ⅱ.
 能与
能与 、
、 、
、 、
、 等形成配位数为4的配合物。
等形成配位数为4的配合物。(5)硫酸铜溶液呈蓝色的原因是溶液中存在配离子
(6)常见配合物的形成实验
实验操作 | 实验现象 | 有关离子方程式 |
| 滴加氨水后,试管中首先出现蓝色沉淀,氨水过量后沉淀逐渐 |  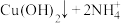   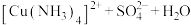 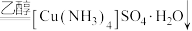 |
您最近一年使用:0次
2023-05-16更新
|
853次组卷
|
2卷引用:广东省梅州市2023届高三下学期第二次质检测试化学试题
7 . 某化学小组在研究Na2SO3溶液、FeCl3溶液性质及反应时,进行了下列实验:
(1) 取1mol•L﹣1的Na2SO3溶液置于空气中,测得其pH随时间的变化曲线如图所示:
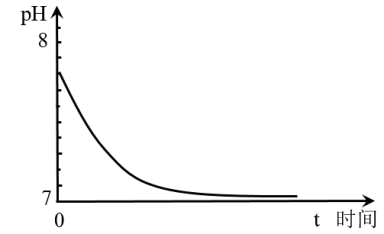
①最初,Na2SO3溶液pH=7.8,解释其原因的离子方程式是___________ 。
②t时间段内,造成其pH发生上述变化,用离子方程式解释是___________ 。
(2) 探究Na2SO3溶液与FeCl3溶液实际反应的情况:
实验ⅰ
实验ⅱ
①实验ⅱ证明,溶液中含有___________ 离子;
②对Na2SO3溶液与FeCl3溶液实际反应存在两种认识:
认识Ⅰ.反应中Fe3+完全转化为Fe2+ ,W溶液中c(Fe2+)一定很大,反应的离子方程式是___________ 。
认识Ⅱ.W溶液中c(Fe2+)应该极小,否则W溶液不会呈红褐色。
(3) 资料显示:Fe2+呈淡绿色、FeSO3是墨绿色沉淀、碱式硫酸铁[Fe4(OH)2(SO4)5]溶液为红褐色。
①实验中始终未出现墨绿色沉淀,说明c(Fe2+)极小,其原因用离子方程式解释是___________ 。
②实验过程和结果显示,O2、Fe3+、SO 的氧化性强弱顺序是
的氧化性强弱顺序是___________ 。
③若Fe4(OH)2(SO4)5是造成溶液W呈红褐色的原因之一,其形成的化学方程式是___________ 。
④用激光笔照射W溶液,发现有丁达尔现象,用离子方程式解释原因是___________ 。
(1) 取1mol•L﹣1的Na2SO3溶液置于空气中,测得其pH随时间的变化曲线如图所示:

①最初,Na2SO3溶液pH=7.8,解释其原因的离子方程式是
②t时间段内,造成其pH发生上述变化,用离子方程式解释是
(2) 探究Na2SO3溶液与FeCl3溶液实际反应的情况:
实验ⅰ
| 装置 | 操作 | 现象 |
 | 向2mL1mol•L﹣1FeCl3溶液中,逐滴滴加1mo•L﹣1Na2SO3溶液2mL | 溶液黄色逐渐加深,最终得红褐色溶液(W) |
| 装置 | 操作 | 现象 |
 | 取1mL溶液W于试管中,向其滴加过量盐酸,再滴加5滴BaCl2溶液 | 产生白色沉淀 |
②对Na2SO3溶液与FeCl3溶液实际反应存在两种认识:
认识Ⅰ.反应中Fe3+完全转化为Fe2+ ,W溶液中c(Fe2+)一定很大,反应的离子方程式是
认识Ⅱ.W溶液中c(Fe2+)应该极小,否则W溶液不会呈红褐色。
(3) 资料显示:Fe2+呈淡绿色、FeSO3是墨绿色沉淀、碱式硫酸铁[Fe4(OH)2(SO4)5]溶液为红褐色。
①实验中始终未出现墨绿色沉淀,说明c(Fe2+)极小,其原因用离子方程式解释是
②实验过程和结果显示,O2、Fe3+、SO
 的氧化性强弱顺序是
的氧化性强弱顺序是③若Fe4(OH)2(SO4)5是造成溶液W呈红褐色的原因之一,其形成的化学方程式是
④用激光笔照射W溶液,发现有丁达尔现象,用离子方程式解释原因是
您最近一年使用:0次
8 . 氧化还原反应在工农业生产、日常生活中具有广泛的用途。
(1)工业干法制备高铁酸钾的第一步反应为: 。该反应中氧化产物为
。该反应中氧化产物为_______ 。
(2)已知下列三个氧化还原反应:①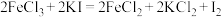 ;②
;②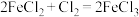 ;③
;③ 。若溶质中
。若溶质中 与
与 共存,为了氧化
共存,为了氧化 而
而 不被氧化,除单质外,还可用反应中的
不被氧化,除单质外,还可用反应中的_______ (从下列三个反应中选择)作氧化剂。
(3)无水情况下, 可以和
可以和 发生如下反应:_______
发生如下反应:_______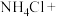 _______
_______ _______
_______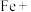 _______
_______ _______
_______ _______
_______ 。配平上述反应方程式,单线桥法标出电子转移的方向和数目
。配平上述反应方程式,单线桥法标出电子转移的方向和数目_______ ;
(4)向含有 、
、 的溶液中通入一定量的氯气,再向反应后的溶液中滴加少量的KSCN溶液,结果溶液变为红色。已知:①还原性
的溶液中通入一定量的氯气,再向反应后的溶液中滴加少量的KSCN溶液,结果溶液变为红色。已知:①还原性 ;②KSCN溶液可用于检验
;②KSCN溶液可用于检验 的存在,溶液呈红色。则下列叙述中正确的是
的存在,溶液呈红色。则下列叙述中正确的是_______ 。
①氧化性: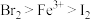
②原溶液中 一定被氧化
一定被氧化
③通入氯气后,原溶液中的 一定被氧化
一定被氧化
④不能确定通入氯气后的溶液中是否还存在
(5)下列转化中,需要加入还原剂才能实现的是_______。
(6)2020年8月初,某海外港口因硝酸铵分解引发剧烈爆炸,已知: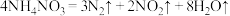 ,则该反应中被还原和被氧化的N原子数之比为
,则该反应中被还原和被氧化的N原子数之比为_______ 。
(7)用如图装置可验证 是否具有漂白性。为达到实验目的,c、d、e三处依次放入的物质为
是否具有漂白性。为达到实验目的,c、d、e三处依次放入的物质为_______ (填序号)。
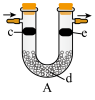
①干燥的有色布条 ②湿润的有色布条 ③浓硫酸 ④碱石灰 ⑤无水
(1)工业干法制备高铁酸钾的第一步反应为:
 。该反应中氧化产物为
。该反应中氧化产物为(2)已知下列三个氧化还原反应:①
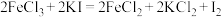 ;②
;②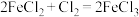 ;③
;③ 。若溶质中
。若溶质中 与
与 共存,为了氧化
共存,为了氧化 而
而 不被氧化,除单质外,还可用反应中的
不被氧化,除单质外,还可用反应中的(3)无水情况下,
 可以和
可以和 发生如下反应:_______
发生如下反应:_______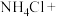 _______
_______ _______
_______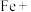 _______
_______ _______
_______ _______
_______ 。配平上述反应方程式,单线桥法标出电子转移的方向和数目
。配平上述反应方程式,单线桥法标出电子转移的方向和数目(4)向含有
 、
、 的溶液中通入一定量的氯气,再向反应后的溶液中滴加少量的KSCN溶液,结果溶液变为红色。已知:①还原性
的溶液中通入一定量的氯气,再向反应后的溶液中滴加少量的KSCN溶液,结果溶液变为红色。已知:①还原性 ;②KSCN溶液可用于检验
;②KSCN溶液可用于检验 的存在,溶液呈红色。则下列叙述中正确的是
的存在,溶液呈红色。则下列叙述中正确的是①氧化性:
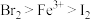
②原溶液中
 一定被氧化
一定被氧化③通入氯气后,原溶液中的
 一定被氧化
一定被氧化④不能确定通入氯气后的溶液中是否还存在

(5)下列转化中,需要加入还原剂才能实现的是_______。
A. | B. |
C. | D. |
(6)2020年8月初,某海外港口因硝酸铵分解引发剧烈爆炸,已知:
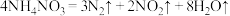 ,则该反应中被还原和被氧化的N原子数之比为
,则该反应中被还原和被氧化的N原子数之比为(7)用如图装置可验证
 是否具有漂白性。为达到实验目的,c、d、e三处依次放入的物质为
是否具有漂白性。为达到实验目的,c、d、e三处依次放入的物质为
①干燥的有色布条 ②湿润的有色布条 ③浓硫酸 ④碱石灰 ⑤无水

您最近一年使用:0次
解题方法
9 . 化学使生活更美好。下列物质使用时涉及的原理不正确的是
| 选项 | 物质用途 | 性质 |
| A | 聚乳酸用于手术缝合线 | 聚乳酸具有生物相容性和可吸收性 |
| B | 中秋节月饼包装袋中放入小袋铁粉 | 铁粉具有还原性 |
| C | 75%酒精溶液用于消毒 |  具有强氧化性 具有强氧化性 |
| D | 化妆品中添加甘油 | 丙三醇具有较强的吸水性能 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
10 . 新型净水剂高铁酸钾( )为暗紫色固体,可溶于水,在强碱性溶液中稳定,在中性或酸性溶液中逐渐分解并有氧气生成。工业上制备
)为暗紫色固体,可溶于水,在强碱性溶液中稳定,在中性或酸性溶液中逐渐分解并有氧气生成。工业上制备 常用次氯酸盐氧化法。工艺流程如图。
常用次氯酸盐氧化法。工艺流程如图。

已知:① 在浓碱中的溶解度大,
在浓碱中的溶解度大, 在浓碱中的溶解度较小;
在浓碱中的溶解度较小;
② 的溶解度远小于
的溶解度远小于 。
。
(1) 是
是_______ (填“正”、“酸式”或“碱式”)盐,其中 元素的化合价为
元素的化合价为_______ 价。
(2) 在中性溶液中逐渐分解的化学方程式为
在中性溶液中逐渐分解的化学方程式为_______ ,其中氧化剂是_______ (填化学式,下同),氧化产物是_______ 。
(3) 是重要的水处理剂,它可以杀菌消毒,还可以净水,在处理水的过程中利用的性质有
是重要的水处理剂,它可以杀菌消毒,还可以净水,在处理水的过程中利用的性质有_______ (填标号)。
A.强氧化性 B.还原性 C.吸附性
(4)若取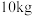 质量分数为39%的氯化铁溶液经过上述流程(铁元素在整个流程中损失率为5%),则制得
质量分数为39%的氯化铁溶液经过上述流程(铁元素在整个流程中损失率为5%),则制得 固体的质量为
固体的质量为_______ g。
 )为暗紫色固体,可溶于水,在强碱性溶液中稳定,在中性或酸性溶液中逐渐分解并有氧气生成。工业上制备
)为暗紫色固体,可溶于水,在强碱性溶液中稳定,在中性或酸性溶液中逐渐分解并有氧气生成。工业上制备 常用次氯酸盐氧化法。工艺流程如图。
常用次氯酸盐氧化法。工艺流程如图。
已知:①
 在浓碱中的溶解度大,
在浓碱中的溶解度大, 在浓碱中的溶解度较小;
在浓碱中的溶解度较小;②
 的溶解度远小于
的溶解度远小于 。
。(1)
 是
是 元素的化合价为
元素的化合价为(2)
 在中性溶液中逐渐分解的化学方程式为
在中性溶液中逐渐分解的化学方程式为(3)
 是重要的水处理剂,它可以杀菌消毒,还可以净水,在处理水的过程中利用的性质有
是重要的水处理剂,它可以杀菌消毒,还可以净水,在处理水的过程中利用的性质有A.强氧化性 B.还原性 C.吸附性
(4)若取
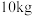 质量分数为39%的氯化铁溶液经过上述流程(铁元素在整个流程中损失率为5%),则制得
质量分数为39%的氯化铁溶液经过上述流程(铁元素在整个流程中损失率为5%),则制得 固体的质量为
固体的质量为
您最近一年使用:0次



 溶液
溶液