2023高三·全国·专题练习
1 . 高铁酸钾 被称为“绿色化学试剂”,在酸性至弱碱性条件下不稳定;
被称为“绿色化学试剂”,在酸性至弱碱性条件下不稳定; 溶液呈紫红色,具有强氧化性,与
溶液呈紫红色,具有强氧化性,与 反应时,溶液颜色会逐渐褪去,并出现红褐色沉淀。
反应时,溶液颜色会逐渐褪去,并出现红褐色沉淀。
(1) 可用于自来水处理,其原理是
可用于自来水处理,其原理是_______ 。
(2)电解法可制得 ,装置如图所示,阳极电极反应式为
,装置如图所示,阳极电极反应式为_______ 。若电解质溶液中混有少量 杂质,电解效果会显著降低,其原因是
杂质,电解效果会显著降低,其原因是_______ 。

 被称为“绿色化学试剂”,在酸性至弱碱性条件下不稳定;
被称为“绿色化学试剂”,在酸性至弱碱性条件下不稳定; 溶液呈紫红色,具有强氧化性,与
溶液呈紫红色,具有强氧化性,与 反应时,溶液颜色会逐渐褪去,并出现红褐色沉淀。
反应时,溶液颜色会逐渐褪去,并出现红褐色沉淀。(1)
 可用于自来水处理,其原理是
可用于自来水处理,其原理是(2)电解法可制得
 ,装置如图所示,阳极电极反应式为
,装置如图所示,阳极电极反应式为 杂质,电解效果会显著降低,其原因是
杂质,电解效果会显著降低,其原因是
您最近一年使用:0次
2 . 铁是应用最广泛的金属,在工农业生产和生活中占有重要的地位。运用铁及其化合物的知识,完成下列问题。
(1)苹果汁中含有 ,它是人们喜欢的一种补铁饮料,现榨苹果汁在空气中由浅绿色变为棕黄色的原因是
,它是人们喜欢的一种补铁饮料,现榨苹果汁在空气中由浅绿色变为棕黄色的原因是___________ 。
(2)中国古代四大发明之一的指南针是由天然磁石制成的,其主要成分是___________ (填化学式)。氧化铁俗称铁红,常用作___________ ;氧化铁与氢碘酸反应的离子方程式为___________ 。
(3)电子工业需要用 的
的 溶液腐蚀敷在绝缘板上的铜,制造印刷电路板,请写出
溶液腐蚀敷在绝缘板上的铜,制造印刷电路板,请写出 溶液与铜反应的离子方程式:
溶液与铜反应的离子方程式:___________ 。
(4)高铁酸钾( )是一种新型、高效、多功能水处理剂。已知:
)是一种新型、高效、多功能水处理剂。已知:
① 与
与 在强碱性条件下反应可制取
在强碱性条件下反应可制取 ;
;
② 具有强氧化性,在酸性或中性溶液中迅速产生氧气:
具有强氧化性,在酸性或中性溶液中迅速产生氧气: ;
;
制取 的离子方程式为
的离子方程式为______ , 作水处理剂的原因
作水处理剂的原因______ 。
(1)苹果汁中含有
 ,它是人们喜欢的一种补铁饮料,现榨苹果汁在空气中由浅绿色变为棕黄色的原因是
,它是人们喜欢的一种补铁饮料,现榨苹果汁在空气中由浅绿色变为棕黄色的原因是(2)中国古代四大发明之一的指南针是由天然磁石制成的,其主要成分是
(3)电子工业需要用
 的
的 溶液腐蚀敷在绝缘板上的铜,制造印刷电路板,请写出
溶液腐蚀敷在绝缘板上的铜,制造印刷电路板,请写出 溶液与铜反应的离子方程式:
溶液与铜反应的离子方程式:(4)高铁酸钾(
 )是一种新型、高效、多功能水处理剂。已知:
)是一种新型、高效、多功能水处理剂。已知:①
 与
与 在强碱性条件下反应可制取
在强碱性条件下反应可制取 ;
; ②
 具有强氧化性,在酸性或中性溶液中迅速产生氧气:
具有强氧化性,在酸性或中性溶液中迅速产生氧气: ;
;制取
 的离子方程式为
的离子方程式为 作水处理剂的原因
作水处理剂的原因
您最近一年使用:0次
21-22高三上·江苏南通·期末
名校
解题方法
3 . 用化学方法降解水中有机物已成为污水处理领域的重要研究方向。
(1)酸性条件下,铁炭混合物处理污水中硝基苯时的物质转化示意图如图1所示。
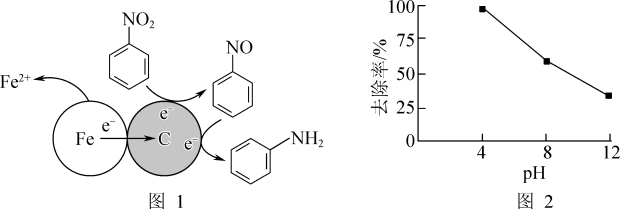
①该物质转化示意图可以描述为_______ 。
②其他条件一定,反应相同时间,硝基苯的去除率与pH的关系如图2所示。pH越大,硝基苯的去除率越低的原因是_______ 。
(2)向含Fe2+和苯胺(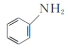 )的酸性溶液中加入双氧水,会发生如下反应:Fe2++H++H2O2=Fe3++HO·+H2O
)的酸性溶液中加入双氧水,会发生如下反应:Fe2++H++H2O2=Fe3++HO·+H2O
①HO·(羟基自由基)具有强氧化性,能将溶液中的苯胺氧化成CO2和N2。写出该反应的离子方程式:_______ 。
②H2O2也具有氧化性,设计验证苯胺是被HO·氧化而不是被H2O2氧化的实验方案:_______ 。
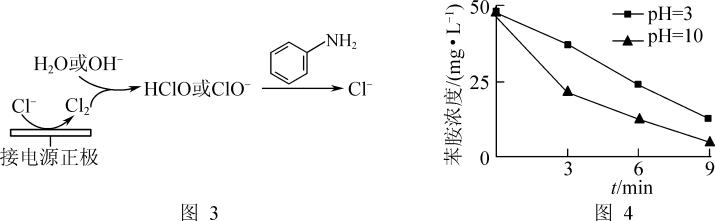
(3)利用电化学装置通过间接氧化法能氧化含苯胺的污水,其原理如图3所示。其他条件一定,测得不同初始pH条件下,溶液中苯胺的浓度与时间的关系如图4所示。反应相同时间,初始溶液pH=3时苯胺浓度大于pH=10时的原因是_______ 。[已知氧化性:HClO(H+)>ClO-(OH-)]
(1)酸性条件下,铁炭混合物处理污水中硝基苯时的物质转化示意图如图1所示。

①该物质转化示意图可以描述为
②其他条件一定,反应相同时间,硝基苯的去除率与pH的关系如图2所示。pH越大,硝基苯的去除率越低的原因是
(2)向含Fe2+和苯胺(
 )的酸性溶液中加入双氧水,会发生如下反应:Fe2++H++H2O2=Fe3++HO·+H2O
)的酸性溶液中加入双氧水,会发生如下反应:Fe2++H++H2O2=Fe3++HO·+H2O①HO·(羟基自由基)具有强氧化性,能将溶液中的苯胺氧化成CO2和N2。写出该反应的离子方程式:
②H2O2也具有氧化性,设计验证苯胺是被HO·氧化而不是被H2O2氧化的实验方案:
(3)利用电化学装置通过间接氧化法能氧化含苯胺的污水,其原理如图3所示。其他条件一定,测得不同初始pH条件下,溶液中苯胺的浓度与时间的关系如图4所示。反应相同时间,初始溶液pH=3时苯胺浓度大于pH=10时的原因是

您最近一年使用:0次
名校
解题方法
4 . 某化学兴趣小组设计一种从硫矿石(主要成分为硫黄及少量FeS2)中提取硫黄的方法如下:
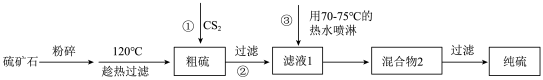
查阅资料:S的熔点为115.2℃; 的沸点为46.2℃。
的沸点为46.2℃。
下列说法错误的是

查阅资料:S的熔点为115.2℃;
 的沸点为46.2℃。
的沸点为46.2℃。下列说法错误的是
| A.单质硫是分子晶体 |
B.过程①中 可用乙醇代替 可用乙醇代替 |
C.过程③的目的是使 挥发,同时使硫从水中析出 挥发,同时使硫从水中析出 |
D.将趁热过滤所得滤渣煅烧: ,反应中每生成1 mol ,反应中每生成1 mol  ,转移电子的物质的量为5.5 mol ,转移电子的物质的量为5.5 mol |
您最近一年使用:0次
2023-03-08更新
|
478次组卷
|
3卷引用:湖南省邵阳市2023届高三下学期第二次联考(二模)化学试题
5 . 某学习小组拟研究FeSO4的分解实验探究,请你利用所学知识帮该小组完成以下实验方案。
[实验目的]探究FeSO4分解产物与温度关系。
[提出假设]
假设1:Fe2O3、SO3、SO2 ;
假设2:FeO、SO3、SO2;
假设3:Fe3O4、SO3、SO2。
[查阅资料]几种物质的物理性质如表所示。
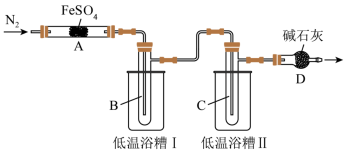
回答下列问题:
(1)根据所学知识判断,假设2肯定不成立,理由是_______ 。
(2)实验过程中,在检查装置气密性之后点燃A处酒精灯之前的操作是_______ ,(只填操作),当A处固体完全分解后通入N2的目的是_______ 。
(3)实验室用饱和氯化铵溶液和亚硝酸钠溶液共热制备N2,该反应的离子方程式为_______ 。
(4)低温浴槽Ⅰ收集的物质是_______ (填化学式),低温浴槽Ⅱ控制的温度范围为_______ 。
(5)甲、乙组分别进行实验,实验数据如下(不考虑损失,固体已完全分解且固体产物为纯净物):
甲组实验中A装置得到固体产物是_______ (填化学式)。
(6)为进一步确认固体产物成分,取乙组实验得到的固体溶于稀硫酸,将溶液分成两份,进行如下实验:在一份溶液中滴加铁氰化钾K3[Fe(CN)6]溶液,产生蓝色沉淀。在另一份溶液中滴加NH4SCN溶液,观察到的现象是_______ 。
[实验结论]通过上述实验,FeSO4分解产物与温度有关。
[交流反思]FeSO4分解反应中是否有O2生成?
(7)为验证实验猜想,他们设计两种方案检验O2:
方案1:将D管导出的气体通入酸化的淀粉-KI溶液中。
方案2:用带火星的木条放在D管口处。
假设过程中持续缓缓通入N2,对比以上两种方案,其中方案_______ (填“1”或“2”)可行。
[实验目的]探究FeSO4分解产物与温度关系。
[提出假设]
假设1:Fe2O3、SO3、SO2 ;
假设2:FeO、SO3、SO2;
假设3:Fe3O4、SO3、SO2。
[查阅资料]几种物质的物理性质如表所示。
| 物质 | SO3 | SO2 | O2 | N2 |
| 熔点/℃ | 16.8 | - 72.4 | -218.4 | -209.9 |
| 沸点/℃ | 44.8 | - 10 | -182.9 | - 195.8 |

回答下列问题:
(1)根据所学知识判断,假设2肯定不成立,理由是
(2)实验过程中,在检查装置气密性之后点燃A处酒精灯之前的操作是
(3)实验室用饱和氯化铵溶液和亚硝酸钠溶液共热制备N2,该反应的离子方程式为
(4)低温浴槽Ⅰ收集的物质是
(5)甲、乙组分别进行实验,实验数据如下(不考虑损失,固体已完全分解且固体产物为纯净物):
| 实验 | A处温度/℃ | FeSO4质量/g | 低温浴槽Ⅰ净增质量/g | 低温浴槽Ⅱ净增质量/g |
| 甲 | T1 | 3.04 | 0.80 | 0.64 |
| 乙 | T2 | 4.56 | 1.60 | 0.64 |
(6)为进一步确认固体产物成分,取乙组实验得到的固体溶于稀硫酸,将溶液分成两份,进行如下实验:在一份溶液中滴加铁氰化钾K3[Fe(CN)6]溶液,产生蓝色沉淀。在另一份溶液中滴加NH4SCN溶液,观察到的现象是
[实验结论]通过上述实验,FeSO4分解产物与温度有关。
[交流反思]FeSO4分解反应中是否有O2生成?
(7)为验证实验猜想,他们设计两种方案检验O2:
方案1:将D管导出的气体通入酸化的淀粉-KI溶液中。
方案2:用带火星的木条放在D管口处。
假设过程中持续缓缓通入N2,对比以上两种方案,其中方案
您最近一年使用:0次
名校
解题方法
6 . 物质的大小会对其性质有极大影响。
(1)纳米金:具有高电子密度、介电特性和催化作用。纳米金的制法:将0.01%的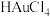 溶液煮沸,迅速加入1%的柠檬酸钠(
溶液煮沸,迅速加入1%的柠檬酸钠( )溶液,持续煮沸7~10分钟。制备时溶液会因为加入的柠檬酸钠的量不同而产生不同的颜色,如下表所示。
)溶液,持续煮沸7~10分钟。制备时溶液会因为加入的柠檬酸钠的量不同而产生不同的颜色,如下表所示。
资料: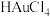 的溶液呈黄色,其酸性比柠檬酸强。
的溶液呈黄色,其酸性比柠檬酸强。
①在制备过程中,存在如下反应,已知产物 是柠檬酸脱去一个羧基得到的,核磁共振氢谱显示其有4组峰。请补全并配平下面的反应方程式(要写出
是柠檬酸脱去一个羧基得到的,核磁共振氢谱显示其有4组峰。请补全并配平下面的反应方程式(要写出 的结构简式)
的结构简式) _______ 。
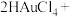 □
□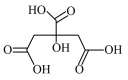 →□_______+□_______(
→□_______+□_______( )+□
)+□ +□HCl
+□HCl
②柠檬酸钠的作用是_______ ,如果一段时间后的液体仍为黄色,则可以_______ (填操作)来检验是否生成纳米金。
(2)微米水:可以高效诱导分子的还原反应,且不需要任何的外加还原剂或外加电荷。科学家使用上述方法制取纳米金时,引入了不加柠檬酸的对照组。令人惊奇的是对照组也发生了反应,他经过猜想与论证,最终将目光锁定在水身上,用如下装置(如图1所示)进行验证。

①使用丙酮酸( )来验证,通过检验由丙酮酸生成的产物
)来验证,通过检验由丙酮酸生成的产物_______ ,证明猜想成立。
②发现随着丙酮酸浓度的增加,还原效率会迅速降低,图2与图3中丙酮酸浓度均为10mol/L。

还原效率会随着雾化气体压强的增大而增大的原因是_______ 。
③为探究还原反应的具体过程,继续设计实验:向水中加入一种指示剂R,这种指示剂正常状态下不显色,R在遇到一定浓度的 与还原剂后会显示红色荧光,过程可以表示为:R(无色)
与还原剂后会显示红色荧光,过程可以表示为:R(无色) (红色荧光)。加入R后观测到的现象如图4所示。
(红色荧光)。加入R后观测到的现象如图4所示。

结合图4和上述实验,你可以得出什么推论?_______ 。
(3)综合上述内容,你对物质有了哪些更深入的认识?_______ 。
(1)纳米金:具有高电子密度、介电特性和催化作用。纳米金的制法:将0.01%的
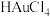 溶液煮沸,迅速加入1%的柠檬酸钠(
溶液煮沸,迅速加入1%的柠檬酸钠( )溶液,持续煮沸7~10分钟。制备时溶液会因为加入的柠檬酸钠的量不同而产生不同的颜色,如下表所示。
)溶液,持续煮沸7~10分钟。制备时溶液会因为加入的柠檬酸钠的量不同而产生不同的颜色,如下表所示。| 纳米金颗粒大小(nm) | 颜色 |
| 2~5 | 黄 |
| 10~20 | 红 |
| 30~80 | 紫 |
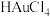 的溶液呈黄色,其酸性比柠檬酸强。
的溶液呈黄色,其酸性比柠檬酸强。①在制备过程中,存在如下反应,已知产物
 是柠檬酸脱去一个羧基得到的,核磁共振氢谱显示其有4组峰。请补全并配平下面的反应方程式(要写出
是柠檬酸脱去一个羧基得到的,核磁共振氢谱显示其有4组峰。请补全并配平下面的反应方程式(要写出 的结构简式)
的结构简式) 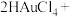 □
□ →□_______+□_______(
→□_______+□_______( )+□
)+□ +□HCl
+□HCl②柠檬酸钠的作用是
(2)微米水:可以高效诱导分子的还原反应,且不需要任何的外加还原剂或外加电荷。科学家使用上述方法制取纳米金时,引入了不加柠檬酸的对照组。令人惊奇的是对照组也发生了反应,他经过猜想与论证,最终将目光锁定在水身上,用如下装置(如图1所示)进行验证。

①使用丙酮酸(
 )来验证,通过检验由丙酮酸生成的产物
)来验证,通过检验由丙酮酸生成的产物②发现随着丙酮酸浓度的增加,还原效率会迅速降低,图2与图3中丙酮酸浓度均为10mol/L。

还原效率会随着雾化气体压强的增大而增大的原因是
③为探究还原反应的具体过程,继续设计实验:向水中加入一种指示剂R,这种指示剂正常状态下不显色,R在遇到一定浓度的
 与还原剂后会显示红色荧光,过程可以表示为:R(无色)
与还原剂后会显示红色荧光,过程可以表示为:R(无色) (红色荧光)。加入R后观测到的现象如图4所示。
(红色荧光)。加入R后观测到的现象如图4所示。
结合图4和上述实验,你可以得出什么推论?
(3)综合上述内容,你对物质有了哪些更深入的认识?
您最近一年使用:0次
2022-05-31更新
|
261次组卷
|
2卷引用:北京市东城区第五中学2022届高三三模化学试题
7 . 以MnO2粉(含少量Fe3O4、CaO、MgO等杂质)和MnS(溶于酸,不溶于水)为原料制备MnSO4·H2O的过程如下:
(1)反应:将一定量MnO2粉和稀硫酸加入到如图所示实验装置的三颈烧瓶中,加热到90℃后开始加入MnS,并不断搅拌,充分反应。
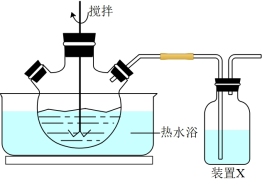
①三颈烧瓶中MnO2与MnS反应转化为Mn2+和S的离子方程式为_______ 。
②装置X中是NaOH溶液,作用是_______ 。
(2)除杂。查阅资料可知:
Ⅰ.常温下Ka(HF)=7.4×10-4。
Ⅱ.常温下Ksp(CaF2)=2.7×10−11,Ksp(MgF2)=6.5×10−9。
Ⅲ.有关氢氧化物开始沉淀和沉淀完全的pH如下表:
①将三颈烧瓶中的混合物过滤,加入MnF2将滤液中的Ca2+、Mg2+转化为沉淀除去。在Ca2+、Mg2+浓度相同的条件下,pH变化对钙镁去除率的影响如图所示。
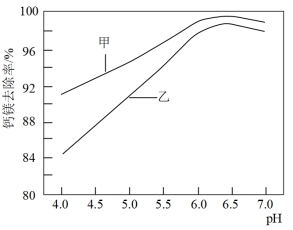
Mg2+去除率曲线为_______ (填写“甲”或“乙”)。随pH减小,钙镁去除率下降的原因是_______ 。
②以除去Ca2+、Mg2+所得的滤液为原料,制备MnSO4·H2O的实验方案:_______ ,控制温度在80~90℃之间蒸发结晶至有大量晶体出现,趁热过滤,用80~90℃的蒸馏水洗涤2~3次,干燥。(可选用的试剂:H2O2溶液、MnCO3固体、Na2CO3固体、蒸馏水等)。
(3)测定。准确称取0.3850 g MnSO4·H2O样品置于锥形瓶中,加入H3PO4和NH4NO3溶液,加热使Mn2+全部氧化成Mn3+,用0.1000 mol·L-1硫酸亚铁铵[Fe(NH4)2(SO4)2]标准溶液滴定至终点(滴定过程中Mn3+被还原为Mn2+),消耗标准溶液20.00 mL。计算MnSO4·H2O样品的纯度_______ (请写出计算过程)。
(1)反应:将一定量MnO2粉和稀硫酸加入到如图所示实验装置的三颈烧瓶中,加热到90℃后开始加入MnS,并不断搅拌,充分反应。

①三颈烧瓶中MnO2与MnS反应转化为Mn2+和S的离子方程式为
②装置X中是NaOH溶液,作用是
(2)除杂。查阅资料可知:
Ⅰ.常温下Ka(HF)=7.4×10-4。
Ⅱ.常温下Ksp(CaF2)=2.7×10−11,Ksp(MgF2)=6.5×10−9。
Ⅲ.有关氢氧化物开始沉淀和沉淀完全的pH如下表:
| 氢氧化物 | Fe(OH)2 | Fe(OH)3 | Mn(OH)2 |
| 开始沉淀pH | 7.6 | 1.5 | 8.3 |
| 沉淀完全pH | 9.7 | 3.2 | 9.8 |

Mg2+去除率曲线为
②以除去Ca2+、Mg2+所得的滤液为原料,制备MnSO4·H2O的实验方案:
(3)测定。准确称取0.3850 g MnSO4·H2O样品置于锥形瓶中,加入H3PO4和NH4NO3溶液,加热使Mn2+全部氧化成Mn3+,用0.1000 mol·L-1硫酸亚铁铵[Fe(NH4)2(SO4)2]标准溶液滴定至终点(滴定过程中Mn3+被还原为Mn2+),消耗标准溶液20.00 mL。计算MnSO4·H2O样品的纯度
您最近一年使用:0次
名校
8 . 化学知识在生活中有广泛的应用,下列有关说法正确的是
| A.维生素C又名抗坏血酸,有较强的还原性,在食品中添加适量维生素C可以延长食品的保质期 |
| B.节日燃放的烟花所呈现的艳丽色彩,是利用了钠、镁、铝等金属元素的焰色反应 |
| C.碳酸钠溶液呈碱性能与盐酸反应,胃酸过多的病人可以在饮用水中加适量碳酸钠 |
D.使用氯气对自来水消毒时可能产生对人体有害的有机氯化物,因此使用 、 、 的同素异形体 的同素异形体 、 、 做为新的自来水消毒剂 做为新的自来水消毒剂 |
您最近一年使用:0次
2022-10-06更新
|
351次组卷
|
3卷引用:浙江省瓯海中学2022-2023学年高一上学期10月月考化学试题
名校
9 . 水合肼(N2H4·H2O)有强还原性,易溶于水,溶液呈弱碱性,能与多种金属离子形成配合物。用水合肼处理碱性铜氨{[Cu(NH3)4]2+}废液获得纳米铜的工艺流程如下:

(1)水合肼溶于水呈弱碱性的原因是_______ (用电离方程式表示)。
(2)电解饱和食盐水阳极材料常用石墨而不用铁的原因是_______ 。
(3)反应I中温度升高时易产生副产物NaClO3。提高NaClO产率的措施有_______ 。
(4)①合成水合肼时,原料的混合方式为_______ ;②合成水合肼时,反应的离子方程式为_______ 。
(5)保持其它条件不变,水合肼的浓度对纳米铜的沉淀率影响如图所示。水合肼的浓度大于3.25mol·L-1时,纳米铜的沉淀率下降的原因可能是_______ 。


(1)水合肼溶于水呈弱碱性的原因是
(2)电解饱和食盐水阳极材料常用石墨而不用铁的原因是
(3)反应I中温度升高时易产生副产物NaClO3。提高NaClO产率的措施有
(4)①合成水合肼时,原料的混合方式为
(5)保持其它条件不变,水合肼的浓度对纳米铜的沉淀率影响如图所示。水合肼的浓度大于3.25mol·L-1时,纳米铜的沉淀率下降的原因可能是

您最近一年使用:0次
解题方法
10 . 有色金属冶炼废水中的砷元素主要以亚砷酸(H3AsO3)和砷酸(H3AsO4)形式存在,酸性废水中砷元素回收再利用的工业流程如图所示。回答下列问题:

经查阅资料,可将废水中的砷元素转化为Ca5(AsO4)3OH沉淀,从而脱离液相体系。
(1)“滤液2”的主要成分为_______ ,“废渣”的主要成分是:_______ 。
(2)流程中可循环利用的物质为_______ 。
(3)先“碱浸”“沉砷”后“酸化”的目的是_______ 。
(4)“还原”发生反应的化学方程式为_______ 。
(5)研究表明:“沉砷”的最佳温度是85℃。用化学平衡原理解释温度高于85℃后,随温度升高,沉淀率下降的原因_______ 。
(6)查阅资料,As2O3在不同温度和不同浓度硫酸中的溶解度(S)曲线如图所示,结合图象分析,“结晶”的具体操作是_______ 。


经查阅资料,可将废水中的砷元素转化为Ca5(AsO4)3OH沉淀,从而脱离液相体系。
(1)“滤液2”的主要成分为
(2)流程中可循环利用的物质为
(3)先“碱浸”“沉砷”后“酸化”的目的是
(4)“还原”发生反应的化学方程式为
(5)研究表明:“沉砷”的最佳温度是85℃。用化学平衡原理解释温度高于85℃后,随温度升高,沉淀率下降的原因
(6)查阅资料,As2O3在不同温度和不同浓度硫酸中的溶解度(S)曲线如图所示,结合图象分析,“结晶”的具体操作是

您最近一年使用:0次



