解题方法
1 . 在包装糕点盒中会附有食品保鲜剂,里边的主要成分是铁粉,它可以预防食物变质,这说明铁粉具有
| A.酸性 | B.碱性 | C.氧化性 | D.还原性 |
您最近一年使用:0次
解题方法
2 . 生活处处离不开化学。阅读材料,完成各题:
材料一:人体胃液中含有胃酸(0.2%~0.4%的盐酸),起杀菌、帮助消化等作用。当胃酸过多时,医生通常用“胃舒平”[主要成分是Al(OH)3] 或“小苏打片”(主要成分是NaHCO3) 给病人治疗。
(1)写出NaHCO3在水中的电离方程式___________ 。
(2)病人同时患有胃溃疡,此时最宜服用___________ (填“小苏打片”或“胃舒平”),发生反应的化学方程式为___________ 。
材料二:维生素C又称“抗坏血酸”,因为它能够保护身体免于氧化剂的威胁。维生素C同时也是一种辅酶,能增强人体对疾病的抵抗能力。
(3)将维生素C溶于水后向溶液中滴加几滴紫色石蕊试液,试液变红,说明维生素C的水溶液呈___________性。
(4)亚铁离子易被吸收,给贫血者补充铁时,应给予含亚铁离子的亚铁盐,如硫酸亚铁。服用维生素C,可使食物中的铁离子转化成亚铁离子,有利于铁的吸收。上述反应中维生素C是___________ 剂。
材料一:人体胃液中含有胃酸(0.2%~0.4%的盐酸),起杀菌、帮助消化等作用。当胃酸过多时,医生通常用“胃舒平”[主要成分是Al(OH)3] 或“小苏打片”(主要成分是NaHCO3) 给病人治疗。
(1)写出NaHCO3在水中的电离方程式
(2)病人同时患有胃溃疡,此时最宜服用
材料二:维生素C又称“抗坏血酸”,因为它能够保护身体免于氧化剂的威胁。维生素C同时也是一种辅酶,能增强人体对疾病的抵抗能力。
(3)将维生素C溶于水后向溶液中滴加几滴紫色石蕊试液,试液变红,说明维生素C的水溶液呈___________性。
| A.酸性 | B.碱性 | C.氧化性 | D.还原性 |
您最近一年使用:0次
名校
解题方法
3 . 生产芯片的半导体材料有硅、锗、砷化镓等,应用比较广泛的是硅。硅可由石英砂(主要成分是二氧化硅)制得,制备高纯硅的主要工艺流程如图所示:

资料:①SiHCl3能与H2O剧烈反应,在空气中易自燃;②粗SiHCl3 (沸点33.0℃)中含有少量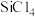 (沸点57.6℃)和HCl(沸点-84.7℃)
(沸点57.6℃)和HCl(沸点-84.7℃)
(1)流程①焦炭体现了___________ (填“氧化性”或“还原性”)。
(2)流程③提纯SiHCl3的操作是___________ 。
(3)流程④的化学反应为置换反应,写出其化学方程式:___________ 。
流程④制备高纯硅的装置如图(热源及夹持装置略去):

(4)若要从下列玻璃仪器中选择部分来组装A处的气体发生装置,需要的是___________ (填选项编号):
a. 分液漏斗 b.烧瓶 c.酒精灯 d.大试管 e.漏斗 f.烧杯 g.导管
装置B中的试剂是___________ (填试剂名称);装置C中的烧瓶需要加热,其目的是___________ 。
(5)反应一段时间后,装置D中观察到的现象是___________ 。
(6)为保证制备高纯硅实验的成功,操作的关键是检查实验装置的气密性,控制好反应温度以及___________ ,该流程中能够循环利用的物质是___________ 。

资料:①SiHCl3能与H2O剧烈反应,在空气中易自燃;②粗SiHCl3 (沸点33.0℃)中含有少量
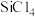 (沸点57.6℃)和HCl(沸点-84.7℃)
(沸点57.6℃)和HCl(沸点-84.7℃)(1)流程①焦炭体现了
(2)流程③提纯SiHCl3的操作是
(3)流程④的化学反应为置换反应,写出其化学方程式:
流程④制备高纯硅的装置如图(热源及夹持装置略去):

(4)若要从下列玻璃仪器中选择部分来组装A处的气体发生装置,需要的是
a. 分液漏斗 b.烧瓶 c.酒精灯 d.大试管 e.漏斗 f.烧杯 g.导管
装置B中的试剂是
(5)反应一段时间后,装置D中观察到的现象是
(6)为保证制备高纯硅实验的成功,操作的关键是检查实验装置的气密性,控制好反应温度以及
您最近一年使用:0次
4 . 下列化学反应中:
① (未配平)
(未配平)
②
③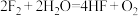
④
⑤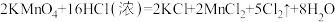
⑥
⑦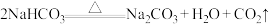
回答下列问题:
(1)上述反应中,既是分解反应,又是氧化还原反应的是___________ (填序号)。
(2)反应①中的氧化剂是___________ ,被氧化的元素是___________ ,用化合价升降法配平①中的反应方程式:___________ 。
(3)反应④中氧化产物和还原产物的质量之比为___________ ;反应⑤中浓盐酸表现出的性质是___________ (填字母)。
A.还原性 B.酸性 C.氧化性 D.挥发性
(4)请用双线桥法标出反应⑥电子转移的方向及数目:___________ ;产生1 mol  时,转移的电子的物质的量为准状况下的气体体积为
时,转移的电子的物质的量为准状况下的气体体积为___________ mol;1 mol  参加反应时,生成标准状况下的气体体积为
参加反应时,生成标准状况下的气体体积为___________ L。
①
 (未配平)
(未配平)②

③
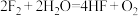
④

⑤
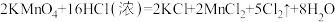
⑥

⑦
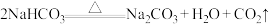
回答下列问题:
(1)上述反应中,既是分解反应,又是氧化还原反应的是
(2)反应①中的氧化剂是
(3)反应④中氧化产物和还原产物的质量之比为
A.还原性 B.酸性 C.氧化性 D.挥发性
(4)请用双线桥法标出反应⑥电子转移的方向及数目:
 时,转移的电子的物质的量为准状况下的气体体积为
时,转移的电子的物质的量为准状况下的气体体积为 参加反应时,生成标准状况下的气体体积为
参加反应时,生成标准状况下的气体体积为
您最近一年使用:0次
5 . 某化学小组在研究Na2SO3溶液、FeCl3溶液性质及反应时,进行了下列实验:
(1) 取1mol•L﹣1的Na2SO3溶液置于空气中,测得其pH随时间的变化曲线如图所示:
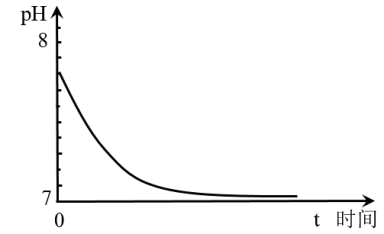
①最初,Na2SO3溶液pH=7.8,解释其原因的离子方程式是___________ 。
②t时间段内,造成其pH发生上述变化,用离子方程式解释是___________ 。
(2) 探究Na2SO3溶液与FeCl3溶液实际反应的情况:
实验ⅰ
实验ⅱ
①实验ⅱ证明,溶液中含有___________ 离子;
②对Na2SO3溶液与FeCl3溶液实际反应存在两种认识:
认识Ⅰ.反应中Fe3+完全转化为Fe2+ ,W溶液中c(Fe2+)一定很大,反应的离子方程式是___________ 。
认识Ⅱ.W溶液中c(Fe2+)应该极小,否则W溶液不会呈红褐色。
(3) 资料显示:Fe2+呈淡绿色、FeSO3是墨绿色沉淀、碱式硫酸铁[Fe4(OH)2(SO4)5]溶液为红褐色。
①实验中始终未出现墨绿色沉淀,说明c(Fe2+)极小,其原因用离子方程式解释是___________ 。
②实验过程和结果显示,O2、Fe3+、SO 的氧化性强弱顺序是
的氧化性强弱顺序是___________ 。
③若Fe4(OH)2(SO4)5是造成溶液W呈红褐色的原因之一,其形成的化学方程式是___________ 。
④用激光笔照射W溶液,发现有丁达尔现象,用离子方程式解释原因是___________ 。
(1) 取1mol•L﹣1的Na2SO3溶液置于空气中,测得其pH随时间的变化曲线如图所示:

①最初,Na2SO3溶液pH=7.8,解释其原因的离子方程式是
②t时间段内,造成其pH发生上述变化,用离子方程式解释是
(2) 探究Na2SO3溶液与FeCl3溶液实际反应的情况:
实验ⅰ
| 装置 | 操作 | 现象 |
 | 向2mL1mol•L﹣1FeCl3溶液中,逐滴滴加1mo•L﹣1Na2SO3溶液2mL | 溶液黄色逐渐加深,最终得红褐色溶液(W) |
| 装置 | 操作 | 现象 |
 | 取1mL溶液W于试管中,向其滴加过量盐酸,再滴加5滴BaCl2溶液 | 产生白色沉淀 |
②对Na2SO3溶液与FeCl3溶液实际反应存在两种认识:
认识Ⅰ.反应中Fe3+完全转化为Fe2+ ,W溶液中c(Fe2+)一定很大,反应的离子方程式是
认识Ⅱ.W溶液中c(Fe2+)应该极小,否则W溶液不会呈红褐色。
(3) 资料显示:Fe2+呈淡绿色、FeSO3是墨绿色沉淀、碱式硫酸铁[Fe4(OH)2(SO4)5]溶液为红褐色。
①实验中始终未出现墨绿色沉淀,说明c(Fe2+)极小,其原因用离子方程式解释是
②实验过程和结果显示,O2、Fe3+、SO
 的氧化性强弱顺序是
的氧化性强弱顺序是③若Fe4(OH)2(SO4)5是造成溶液W呈红褐色的原因之一,其形成的化学方程式是
④用激光笔照射W溶液,发现有丁达尔现象,用离子方程式解释原因是
您最近一年使用:0次
名校
6 . 按要求填空。
(1)标准状况下,10.8g某气体的体积是8.96L,则此气体的相对分子质量为___________ 。
(2)现有标准状况下CO和 混合气体8.96L,其质量为16g,则此混合气体中,CO气体的体积分数为
混合气体8.96L,其质量为16g,则此混合气体中,CO气体的体积分数为___________ 。
(3)已知16g A和20g B恰好完全反应生成0.04mol C和31.76g D,则C的摩尔质量为___________ 。
(4)维生素C能帮助人体将食物中摄取的、不易吸收的 转变为易吸收的
转变为易吸收的 ,这说明维生素C具有
,这说明维生素C具有___________ 性(填氧化性或还原性)。
(5)已知: 难溶于水,但可溶于醋酸氨溶液中形成无色溶液,生成的
难溶于水,但可溶于醋酸氨溶液中形成无色溶液,生成的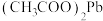 是难电离的物质,其化学方程式为
是难电离的物质,其化学方程式为 。写出该反应的离子方程式:
。写出该反应的离子方程式:___________ 。
(1)标准状况下,10.8g某气体的体积是8.96L,则此气体的相对分子质量为
(2)现有标准状况下CO和
 混合气体8.96L,其质量为16g,则此混合气体中,CO气体的体积分数为
混合气体8.96L,其质量为16g,则此混合气体中,CO气体的体积分数为(3)已知16g A和20g B恰好完全反应生成0.04mol C和31.76g D,则C的摩尔质量为
(4)维生素C能帮助人体将食物中摄取的、不易吸收的
 转变为易吸收的
转变为易吸收的 ,这说明维生素C具有
,这说明维生素C具有(5)已知:
 难溶于水,但可溶于醋酸氨溶液中形成无色溶液,生成的
难溶于水,但可溶于醋酸氨溶液中形成无色溶液,生成的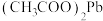 是难电离的物质,其化学方程式为
是难电离的物质,其化学方程式为 。写出该反应的离子方程式:
。写出该反应的离子方程式:
您最近一年使用:0次
7 . 氧化还原反应在工农业生产、日常生活中具有广泛的用途。
(1)工业干法制备高铁酸钾的第一步反应为: 。该反应中氧化产物为
。该反应中氧化产物为_______ 。
(2)已知下列三个氧化还原反应:①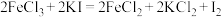 ;②
;②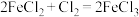 ;③
;③ 。若溶质中
。若溶质中 与
与 共存,为了氧化
共存,为了氧化 而
而 不被氧化,除单质外,还可用反应中的
不被氧化,除单质外,还可用反应中的_______ (从下列三个反应中选择)作氧化剂。
(3)无水情况下, 可以和
可以和 发生如下反应:_______
发生如下反应:_______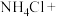 _______
_______ _______
_______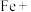 _______
_______ _______
_______ _______
_______ 。配平上述反应方程式,单线桥法标出电子转移的方向和数目
。配平上述反应方程式,单线桥法标出电子转移的方向和数目_______ ;
(4)向含有 、
、 的溶液中通入一定量的氯气,再向反应后的溶液中滴加少量的KSCN溶液,结果溶液变为红色。已知:①还原性
的溶液中通入一定量的氯气,再向反应后的溶液中滴加少量的KSCN溶液,结果溶液变为红色。已知:①还原性 ;②KSCN溶液可用于检验
;②KSCN溶液可用于检验 的存在,溶液呈红色。则下列叙述中正确的是
的存在,溶液呈红色。则下列叙述中正确的是_______ 。
①氧化性: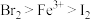
②原溶液中 一定被氧化
一定被氧化
③通入氯气后,原溶液中的 一定被氧化
一定被氧化
④不能确定通入氯气后的溶液中是否还存在
(5)下列转化中,需要加入还原剂才能实现的是_______。
(6)2020年8月初,某海外港口因硝酸铵分解引发剧烈爆炸,已知: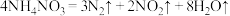 ,则该反应中被还原和被氧化的N原子数之比为
,则该反应中被还原和被氧化的N原子数之比为_______ 。
(7)用如图装置可验证 是否具有漂白性。为达到实验目的,c、d、e三处依次放入的物质为
是否具有漂白性。为达到实验目的,c、d、e三处依次放入的物质为_______ (填序号)。
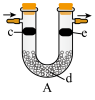
①干燥的有色布条 ②湿润的有色布条 ③浓硫酸 ④碱石灰 ⑤无水
(1)工业干法制备高铁酸钾的第一步反应为:
 。该反应中氧化产物为
。该反应中氧化产物为(2)已知下列三个氧化还原反应:①
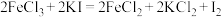 ;②
;②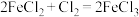 ;③
;③ 。若溶质中
。若溶质中 与
与 共存,为了氧化
共存,为了氧化 而
而 不被氧化,除单质外,还可用反应中的
不被氧化,除单质外,还可用反应中的(3)无水情况下,
 可以和
可以和 发生如下反应:_______
发生如下反应:_______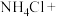 _______
_______ _______
_______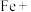 _______
_______ _______
_______ _______
_______ 。配平上述反应方程式,单线桥法标出电子转移的方向和数目
。配平上述反应方程式,单线桥法标出电子转移的方向和数目(4)向含有
 、
、 的溶液中通入一定量的氯气,再向反应后的溶液中滴加少量的KSCN溶液,结果溶液变为红色。已知:①还原性
的溶液中通入一定量的氯气,再向反应后的溶液中滴加少量的KSCN溶液,结果溶液变为红色。已知:①还原性 ;②KSCN溶液可用于检验
;②KSCN溶液可用于检验 的存在,溶液呈红色。则下列叙述中正确的是
的存在,溶液呈红色。则下列叙述中正确的是①氧化性:
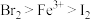
②原溶液中
 一定被氧化
一定被氧化③通入氯气后,原溶液中的
 一定被氧化
一定被氧化④不能确定通入氯气后的溶液中是否还存在

(5)下列转化中,需要加入还原剂才能实现的是_______。
A. | B. |
C. | D. |
(6)2020年8月初,某海外港口因硝酸铵分解引发剧烈爆炸,已知:
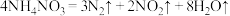 ,则该反应中被还原和被氧化的N原子数之比为
,则该反应中被还原和被氧化的N原子数之比为(7)用如图装置可验证
 是否具有漂白性。为达到实验目的,c、d、e三处依次放入的物质为
是否具有漂白性。为达到实验目的,c、d、e三处依次放入的物质为
①干燥的有色布条 ②湿润的有色布条 ③浓硫酸 ④碱石灰 ⑤无水

您最近一年使用:0次
解题方法
8 . 氧化还原反应在工农业生产,日常生活中具有广泛应用。
(1)下列成语中,涉及有氧化还原反应的是___________。
(2)维生素C又称“抗坏血酸”,在人体内有重要的功能。例如,能帮助人体将食物中摄取的、不易吸收的Fe3+转变为易吸收的Fe2+,这说明维生素C具有___________ (填“氧化性”或“还原性”)。
(3)高温下铝粉与氧化铁的反应可用来焊接钢轨。其原理是:反应放出大量的热,置换出的铁呈熔融态,熔融的铁流入钢轨的裂缝里,冷却后就将钢轨牢牢地焊接在一起。该反应的化学方程式为___________ ,其中,氧化剂是___________ (填化学式,下同),被氧化的物质是___________ 。
(4)油画所用颜料含有某种白色铅化合物,久置于空气中就会变成黑色PbS,从而使油画色彩变暗。若用H2O2来“清洗”,则可将PbS转变成白色的PbSO4,从而使油画的色彩“复原”。上述“清洗”反应的化学方程式为 ,请用单线桥法标出该反应中电子转移情况
,请用单线桥法标出该反应中电子转移情况___________ 。
(5)宋代著名法医学家宋慈的《洗冤集录》中有关于银针验毒的记载。“银针验毒”的原理是 。X为只含两种元素的黑色固体,它的化学式是
。X为只含两种元素的黑色固体,它的化学式是___________ ,该反应的氧化剂与还原剂的质量比为___________ 。
(1)下列成语中,涉及有氧化还原反应的是___________。
| A.沙里淘金 | B.蜡炬成灰 | C.木已成舟 | D.铁杵成针 |
(3)高温下铝粉与氧化铁的反应可用来焊接钢轨。其原理是:反应放出大量的热,置换出的铁呈熔融态,熔融的铁流入钢轨的裂缝里,冷却后就将钢轨牢牢地焊接在一起。该反应的化学方程式为
(4)油画所用颜料含有某种白色铅化合物,久置于空气中就会变成黑色PbS,从而使油画色彩变暗。若用H2O2来“清洗”,则可将PbS转变成白色的PbSO4,从而使油画的色彩“复原”。上述“清洗”反应的化学方程式为
 ,请用单线桥法标出该反应中电子转移情况
,请用单线桥法标出该反应中电子转移情况(5)宋代著名法医学家宋慈的《洗冤集录》中有关于银针验毒的记载。“银针验毒”的原理是
 。X为只含两种元素的黑色固体,它的化学式是
。X为只含两种元素的黑色固体,它的化学式是
您最近一年使用:0次
解题方法
9 . 化学使生活更美好。下列物质使用时涉及的原理不正确的是
| 选项 | 物质用途 | 性质 |
| A | 聚乳酸用于手术缝合线 | 聚乳酸具有生物相容性和可吸收性 |
| B | 中秋节月饼包装袋中放入小袋铁粉 | 铁粉具有还原性 |
| C | 75%酒精溶液用于消毒 |  具有强氧化性 具有强氧化性 |
| D | 化妆品中添加甘油 | 丙三醇具有较强的吸水性能 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
解题方法
10 . 回答下问题:
(1)从氯碱工业的副产品中能够得到一种含氯消毒剂,有效成分为NaClO,该消毒剂的消毒原理是利用了NaClO的_____ (填强氧化性”或“强还原性”)。
(2)向蔗糖中滴加浓硫酸,可观察到蔗糖变黑,体积膨胀且有刺激性气味的气体产生,该过程中浓硫酸表现的性质是_______ 。
(3)写出工业制取漂白粉的化学方程式_______
(4)兴趣小组同学用如图所示装置进行氨的催化氧化实验。在50mL 锥形瓶中加入20mL浓氨水,向氨水中鼓入氧气并迅速将烧红的铂丝伸人瓶中并接近浓氨水的液面(如图所示)。

①氨的催化氧化反应方程式为_______ 。该反应中,NH3_____ (填“作氧化剂”“作还原剂”或“既作氧化剂又作还原剂”)。
②下列说法正确的是_______ (填字母)
A.铂丝持续保持红热说明在铂丝上发生的反应会吸热
B.锥形瓶内有白烟产生该白烟是氨气与硝酸反应生成的硝酸铵
C.锥形瓶内可观察到有红棕色气体生成
D.锥形瓶内只发生了两个化学反应
(1)从氯碱工业的副产品中能够得到一种含氯消毒剂,有效成分为NaClO,该消毒剂的消毒原理是利用了NaClO的
(2)向蔗糖中滴加浓硫酸,可观察到蔗糖变黑,体积膨胀且有刺激性气味的气体产生,该过程中浓硫酸表现的性质是
(3)写出工业制取漂白粉的化学方程式
(4)兴趣小组同学用如图所示装置进行氨的催化氧化实验。在50mL 锥形瓶中加入20mL浓氨水,向氨水中鼓入氧气并迅速将烧红的铂丝伸人瓶中并接近浓氨水的液面(如图所示)。

①氨的催化氧化反应方程式为
②下列说法正确的是
A.铂丝持续保持红热说明在铂丝上发生的反应会吸热
B.锥形瓶内有白烟产生该白烟是氨气与硝酸反应生成的硝酸铵
C.锥形瓶内可观察到有红棕色气体生成
D.锥形瓶内只发生了两个化学反应
您最近一年使用:0次



