1 . 新型净水剂高铁酸钾( )为暗紫色固体,可溶于水,在强碱性溶液中稳定,在中性或酸性溶液中逐渐分解并有氧气生成。工业上制备
)为暗紫色固体,可溶于水,在强碱性溶液中稳定,在中性或酸性溶液中逐渐分解并有氧气生成。工业上制备 常用次氯酸盐氧化法。工艺流程如图。
常用次氯酸盐氧化法。工艺流程如图。

已知:① 在浓碱中的溶解度大,
在浓碱中的溶解度大, 在浓碱中的溶解度较小;
在浓碱中的溶解度较小;
② 的溶解度远小于
的溶解度远小于 。
。
(1) 是
是_______ (填“正”、“酸式”或“碱式”)盐,其中 元素的化合价为
元素的化合价为_______ 价。
(2) 在中性溶液中逐渐分解的化学方程式为
在中性溶液中逐渐分解的化学方程式为_______ ,其中氧化剂是_______ (填化学式,下同),氧化产物是_______ 。
(3) 是重要的水处理剂,它可以杀菌消毒,还可以净水,在处理水的过程中利用的性质有
是重要的水处理剂,它可以杀菌消毒,还可以净水,在处理水的过程中利用的性质有_______ (填标号)。
A.强氧化性 B.还原性 C.吸附性
(4)若取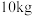 质量分数为39%的氯化铁溶液经过上述流程(铁元素在整个流程中损失率为5%),则制得
质量分数为39%的氯化铁溶液经过上述流程(铁元素在整个流程中损失率为5%),则制得 固体的质量为
固体的质量为_______ g。
 )为暗紫色固体,可溶于水,在强碱性溶液中稳定,在中性或酸性溶液中逐渐分解并有氧气生成。工业上制备
)为暗紫色固体,可溶于水,在强碱性溶液中稳定,在中性或酸性溶液中逐渐分解并有氧气生成。工业上制备 常用次氯酸盐氧化法。工艺流程如图。
常用次氯酸盐氧化法。工艺流程如图。
已知:①
 在浓碱中的溶解度大,
在浓碱中的溶解度大, 在浓碱中的溶解度较小;
在浓碱中的溶解度较小;②
 的溶解度远小于
的溶解度远小于 。
。(1)
 是
是 元素的化合价为
元素的化合价为(2)
 在中性溶液中逐渐分解的化学方程式为
在中性溶液中逐渐分解的化学方程式为(3)
 是重要的水处理剂,它可以杀菌消毒,还可以净水,在处理水的过程中利用的性质有
是重要的水处理剂,它可以杀菌消毒,还可以净水,在处理水的过程中利用的性质有A.强氧化性 B.还原性 C.吸附性
(4)若取
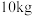 质量分数为39%的氯化铁溶液经过上述流程(铁元素在整个流程中损失率为5%),则制得
质量分数为39%的氯化铁溶液经过上述流程(铁元素在整个流程中损失率为5%),则制得 固体的质量为
固体的质量为
您最近一年使用:0次
名校
解题方法
2 . 化学和生活、社会发展息息相关。下列说法正确的组合是
①飞船返回舱表层材料中的玻璃纤维属于天然有机高分子材料
②液化石油气、汽油、煤油、柴油的主要成分都是烃
③工业上通过石油分馏得到大量化工原料苯
④活性炭疏松多孔,可用于除异味和杀菌
⑤维生素C是NaNO2中毒的急救药之一,利用了维生素C的氧化性
⑥“光化学烟雾”“臭氧空洞”“硝酸型酸雨”的形成都与氮氧化物有关
⑦用四氯乙烯干洗剂除去衣服上油污,发生的是物理变化
⑧波尔多液(硫酸铜、石灰和水配成)用作农药,利用Cu2+使病毒蛋白变性
⑨漂白粉与盐酸可混合使用以提高漂白效果
①飞船返回舱表层材料中的玻璃纤维属于天然有机高分子材料
②液化石油气、汽油、煤油、柴油的主要成分都是烃
③工业上通过石油分馏得到大量化工原料苯
④活性炭疏松多孔,可用于除异味和杀菌
⑤维生素C是NaNO2中毒的急救药之一,利用了维生素C的氧化性
⑥“光化学烟雾”“臭氧空洞”“硝酸型酸雨”的形成都与氮氧化物有关
⑦用四氯乙烯干洗剂除去衣服上油污,发生的是物理变化
⑧波尔多液(硫酸铜、石灰和水配成)用作农药,利用Cu2+使病毒蛋白变性
⑨漂白粉与盐酸可混合使用以提高漂白效果
| A.②⑤⑦⑨ | B.②⑥⑦⑧ | C.③④⑥⑧ | D.①③④⑤ |
您最近一年使用:0次
2023-09-10更新
|
260次组卷
|
2卷引用:辽宁省沈阳市第二十中学2023-2024学年高三上学期一模考试化学试题
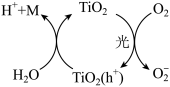
3 .  接受一定强度的光照后可产生光电子(
接受一定强度的光照后可产生光电子( )与成对空穴
)与成对空穴 ,二者与水体中的
,二者与水体中的 、
、 作用后,可产生氧化性极强的微粒(
作用后,可产生氧化性极强的微粒( 、M),如图,这些微粒可将水体中烃的含氧衍生物降解为
、M),如图,这些微粒可将水体中烃的含氧衍生物降解为 、
、 。某实验小组利用
。某实验小组利用 及苯酚溶液模拟该降解过程,下列有关说法错误的是
及苯酚溶液模拟该降解过程,下列有关说法错误的是
 接受一定强度的光照后可产生光电子(
接受一定强度的光照后可产生光电子( )与成对空穴
)与成对空穴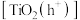 ,二者与水体中的
,二者与水体中的 、
、 作用后,可产生氧化性极强的微粒(
作用后,可产生氧化性极强的微粒( 、M),如图,这些微粒可将水体中烃的含氧衍生物降解为
、M),如图,这些微粒可将水体中烃的含氧衍生物降解为 、
、 。某实验小组利用
。某实验小组利用 及苯酚溶液模拟该降解过程,下列有关说法错误的是
及苯酚溶液模拟该降解过程,下列有关说法错误的是
A. 是该降解过程的催化剂 是该降解过程的催化剂 |
B.微粒M的电子式为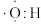 |
C.可用 溶液检验苯酚是否降解完全 溶液检验苯酚是否降解完全 |
D.该降解过程中,若0.02mol苯酚完全降解为 与 与 ,理论上需消耗 ,理论上需消耗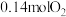 |
您最近一年使用:0次
2023-03-08更新
|
287次组卷
|
2卷引用:辽宁省名校联盟2023届高三3月份联合考试化学试题
名校
4 . 化学与生产、生活、环境密切相关,下列说法错误的是
| A.一些食品袋内常装有干燥剂生石灰和抗氧化剂还原铁粉 |
| B.84消毒液、漂白粉、医用酒精可灭活新冠病毒均利用了强氧化性 |
C.维生素C又称“抗坏血酸”,有助于人体将从食物中摄取的 转变为易吸收的 转变为易吸收的 |
D.汽车尾气系统的催化转化器可把尾气中的CO和NO在催化剂作用下转化成 和 和 |
您最近一年使用:0次
名校
解题方法
5 . PH3是一种易自燃的气体,能被CuSO4溶液吸收生成Cu3P。实验室利用白磷与过量的NaOH溶液制备PH3,其装置如图所示(加热装置已略去;反应过程中同时有NaH2PO2生成)。下列说法错误的是


| A.不可用排空气法收集PH3 |
| B.制取PH3时,n(PH3):n(NaH2PO2)=3:1 |
| C.加入白磷前应先通入氮气 |
| D.CuSO4溶液吸收PH3利用了Cu2+的氧化性 |
您最近一年使用:0次
2022-12-09更新
|
81次组卷
|
3卷引用:辽宁省朝阳市建平县2022-2023学年高三上学期11月期中考试化学试题
名校
解题方法
6 . 中国传统文化蕴含了许多化学知识。下列说法合理的是
| A.宋·王希孟《千里江山图》卷中的绿色颜料铜绿的主要成分是氢氧化铜 |
| B.“雨过天晴云破处,这般颜色做将来。”所描述的瓷器青色,来自氧化铁 |
| C.赵孟頫诗句“纷纷灿烂如星陨,霍霍喧逐似火攻。”灿烂美丽的烟花是某些金属的焰色试验,属于化学变化 |
D.《本草纲目》中记载:“(火药)乃焰消( )、硫黄、杉木炭所合,以为烽燧铳机诸药者”,其中 )、硫黄、杉木炭所合,以为烽燧铳机诸药者”,其中 体现氧化性 体现氧化性 |
您最近一年使用:0次
2021-12-12更新
|
454次组卷
|
3卷引用:辽宁省名校联盟2021-2022学年高一上学期12月联合考试化学试题
名校
7 . 用化学方法降解水中有机物已成为污水处理领域的重要研究方向。酸性条件下,铁炭混合物处理污水中硝基苯时的物质转化示意图如图1所示。其他条件一定,反应相同时间,硝基苯的去除率与pH的关系如图2所示。下列说法错误的是


| A.图1中,炭只起导电传递电子的作用 |
| B.反应中可能会生成氢气 |
C.该反应中转化关系为:3Fe+ +6H+=3Fe2++ +6H+=3Fe2++ +2H2O +2H2O |
D.pH越大,硝基苯的去除率越低的原因是 显碱性,平衡逆向移动 显碱性,平衡逆向移动 |
您最近一年使用:0次
8 . 目前新能源技术被不断利用,高铁电池技术就是科研机构着力研究的一个方向。
(1)高铁酸钾—锌电池(碱性介质)是一种典型的高铁电池,则该种电池负极材料是___________ 。
(2)工业上常采用NaClO氧化法生产高铁酸钾(K2FeO4),K2FeO4在碱性环境中稳定,在中性和酸性条件下不稳定。反应原理为:
Ⅰ.在碱性条件下,利用NaClO氧化Fe(NO3)3制得Na2FeO4:3NaClO+2Fe(NO3)3+10NaOH=2Na2FeO4+3NaCl+6NaNO3+5H2O
Ⅱ.Na2FeO4与KOH反应生成K2FeO4,主要的生产流程如下:
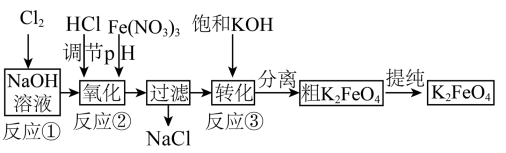
①写出反应①的离子方程式___________ 。
②请写出生产流程中“转化”(反应③)的化学方程式___________ 。
③该反应是在低温下进行的,说明此温度下Ksp(K2FeO4)___________ Ksp(Na2FeO4)(填“>”“<”或“=”)。
④“提纯”K2FeO4中采用重结晶、洗涤、低温烘干的方法,则洗涤剂最好选用___________ 溶液。
a.H2O B.CH3COONa、异丙醇 C.NH4Cl、异丙醇 D.Fe(NO3)3、异丙醇
(3)已知K2FeO4在水溶液中可以发生:4 +10H2O
+10H2O 4Fe(OH)3+8OH-+3O2↑,则K2FeO4可以在水处理中的作用是
4Fe(OH)3+8OH-+3O2↑,则K2FeO4可以在水处理中的作用是___________ 。
(4) 在水溶液中的存在形态图如图所示。
在水溶液中的存在形态图如图所示。
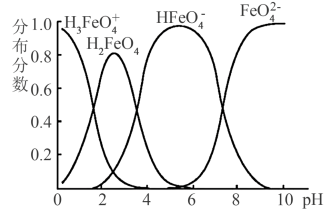
①若向pH=10的这种溶液中加硫酸至pH=2,HFeO 的分布分数的变化情况是
的分布分数的变化情况是___________ 。
②若向pH=6的这种溶液中滴加KOH溶液,则溶液中含铁元素的微粒中,___________ 转化为___________ 。(填化学式)
(1)高铁酸钾—锌电池(碱性介质)是一种典型的高铁电池,则该种电池负极材料是
(2)工业上常采用NaClO氧化法生产高铁酸钾(K2FeO4),K2FeO4在碱性环境中稳定,在中性和酸性条件下不稳定。反应原理为:
Ⅰ.在碱性条件下,利用NaClO氧化Fe(NO3)3制得Na2FeO4:3NaClO+2Fe(NO3)3+10NaOH=2Na2FeO4+3NaCl+6NaNO3+5H2O
Ⅱ.Na2FeO4与KOH反应生成K2FeO4,主要的生产流程如下:

①写出反应①的离子方程式
②请写出生产流程中“转化”(反应③)的化学方程式
③该反应是在低温下进行的,说明此温度下Ksp(K2FeO4)
④“提纯”K2FeO4中采用重结晶、洗涤、低温烘干的方法,则洗涤剂最好选用
a.H2O B.CH3COONa、异丙醇 C.NH4Cl、异丙醇 D.Fe(NO3)3、异丙醇
(3)已知K2FeO4在水溶液中可以发生:4
 +10H2O
+10H2O 4Fe(OH)3+8OH-+3O2↑,则K2FeO4可以在水处理中的作用是
4Fe(OH)3+8OH-+3O2↑,则K2FeO4可以在水处理中的作用是(4)
 在水溶液中的存在形态图如图所示。
在水溶液中的存在形态图如图所示。
①若向pH=10的这种溶液中加硫酸至pH=2,HFeO
 的分布分数的变化情况是
的分布分数的变化情况是②若向pH=6的这种溶液中滴加KOH溶液,则溶液中含铁元素的微粒中,
您最近一年使用:0次
2021-11-03更新
|
740次组卷
|
3卷引用:辽宁省锦州市黑山县第四高级中学2021-2022学年高三3月月考化学试题



