1 . 下列说法不正确 的是
| A.自嗨锅的发热包主要成分是生石灰,其与水反应放热从而使食材加热 |
| B.抗坏血酸(即维生素C)是水果罐头中常用的抗氧化剂,是因为其具有较强的氧化性 |
| C.在食品包装袋内放入铁系保鲜剂可以防止食品因氧化而变质 |
| D.臭氧是饮用水的理想消毒剂之一,因为它杀菌能力强且不影响水质 |
您最近一年使用:0次
2022-03-09更新
|
206次组卷
|
2卷引用:四川省南充高级中学2021-2022学年高二上学期入学考试化学试题
名校
2 . 有研究采用ZVI零价铁活化过硫酸钠的方法去除废水中的正五价砷[As(V)],其机制模型如图。反应过程中产生自由基,自由基有强氧化性,利于形成Fe2+和Fe3+以确保AS(V)去除完全。已知,室温下Ksp[Fe(OH)3]=2.7×10-39。下列叙述不正确的是


A.1molSO ·(自由基)电子数为49NA ·(自由基)电子数为49NA |
B.废水处理过程中铁只被S2O 氧化 氧化 |
| C.ZVI(Fe0)活化去除As(V)的机制主要包括吸附和共沉淀作用 |
| D.室温下,中间产物Fe(OH)3溶于水后所得饱和溶液中c(Fe3+)约为2.7×10-18mol/L |
您最近一年使用:0次
3 . 钒酸钇(YVO4)广泛应用于光纤通信领域,一种用废钒催化剂(含V2O3、K2O、SiO2、少量Fe2O3)制取YVO4的工艺流程如下:
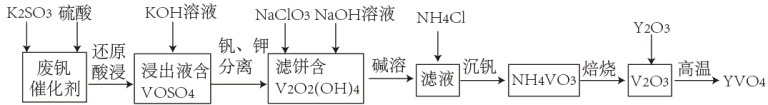
已知:V2O2(OH)4既能与强酸反应,又能与强碱反应。
25℃,浸取液中部分阳离子以氢氧化物形式沉淀时溶液的pH如下表所示:
回答下列问题:
(1)“还原酸浸”时,钒以VO2+浸出,“浸出液”中含有的金属离子是_______ 。V2O5被还原的离子方程式为_______ 。
(2)常温下,“钒、钾分离”时为了提高钒的沉淀率,应调节pH_______ 7(填“>”“<”或“=”)。
(3)结合“碱溶”和“沉钒”可知, 、
、 中
中_______ 的氧化性更强,“沉钒”时发生反应的化学方程式为_______ 。
(4)利用上述表格数据,计算Fe(OH)2的Ksp=_______ 。
(5)某工厂用该工艺流程生产YVO4,当用去1吨该废钒催化剂(V2O5的含量为26.0%)时,得到408kg,YVO4,则整个流程中V的损耗率为_______ 。

已知:V2O2(OH)4既能与强酸反应,又能与强碱反应。
25℃,浸取液中部分阳离子以氢氧化物形式沉淀时溶液的pH如下表所示:
| 阳离子 | VO2+ | Fe3+ | Fe2+ |
| 开始沉淀时(c=0.01mo/L)的pH | 3.0 | 2.2 | 7.5 |
| 沉淀完全时(c=1.0×10-5mol/L)的pH | 7.0 | 3.2 | 9.0 |
回答下列问题:
(1)“还原酸浸”时,钒以VO2+浸出,“浸出液”中含有的金属离子是
(2)常温下,“钒、钾分离”时为了提高钒的沉淀率,应调节pH
(3)结合“碱溶”和“沉钒”可知,
 、
、 中
中(4)利用上述表格数据,计算Fe(OH)2的Ksp=
(5)某工厂用该工艺流程生产YVO4,当用去1吨该废钒催化剂(V2O5的含量为26.0%)时,得到408kg,YVO4,则整个流程中V的损耗率为
您最近一年使用:0次
名校
4 . 化学与我们的生活、生产息息相关。回答下列问题:
(1)维生素 又名抗坏血酸,能帮助人体将食物中摄取的、不易吸收的
又名抗坏血酸,能帮助人体将食物中摄取的、不易吸收的 转化为易吸收的
转化为易吸收的 ,这说明维生素
,这说明维生素 具有
具有___________ 性,该转化反应中 作
作___________ 剂。
(2)氧元素形成的常见单质有 和
和 ,互称同素异形体。大气层中的
,互称同素异形体。大气层中的 不稳定吸收紫外光线,转化为更稳定的
不稳定吸收紫外光线,转化为更稳定的 从而使地球生物免受紫外线的伤害,其转化的化学方程式为
从而使地球生物免受紫外线的伤害,其转化的化学方程式为___________ 。
(3)加碘食盐中含少量碘添加剂名为碘酸钾 ,在酸性条件下碘酸钾可与
,在酸性条件下碘酸钾可与 发生反应生成碘单质和水:
发生反应生成碘单质和水:
①配平:
___________
②买来试剂KI后,再选用家用厨房中的某些物品也可检验加碘食盐是否含有碘添加剂,你选择的厨房用品有___________ 。
A.食醋 B.白酒 C.淀粉 D.小苏打 E.鸡精
(4)某化学课外活动小组在调查一化正层时,发现该后有甲乙两个车间,排出的废水澄清透明,经分析知其分别含有三种不同的离子,两厂废水共有 六种离子。
六种离子。
①经检测,甲车间废水 ,则乙车间废水一定含有离子有
,则乙车间废水一定含有离子有___________ 。
②该活动小组设想变废为宝,将甲乙两车间废水按适当比例混合;既可以除去有害沉淀又利用澄清溶液浇灌农田,该溶液为农作物提供的营养元素有___________ (填元素名称)。
(1)维生素
 又名抗坏血酸,能帮助人体将食物中摄取的、不易吸收的
又名抗坏血酸,能帮助人体将食物中摄取的、不易吸收的 转化为易吸收的
转化为易吸收的 ,这说明维生素
,这说明维生素 具有
具有 作
作(2)氧元素形成的常见单质有
 和
和 ,互称同素异形体。大气层中的
,互称同素异形体。大气层中的 不稳定吸收紫外光线,转化为更稳定的
不稳定吸收紫外光线,转化为更稳定的 从而使地球生物免受紫外线的伤害,其转化的化学方程式为
从而使地球生物免受紫外线的伤害,其转化的化学方程式为(3)加碘食盐中含少量碘添加剂名为碘酸钾
 ,在酸性条件下碘酸钾可与
,在酸性条件下碘酸钾可与 发生反应生成碘单质和水:
发生反应生成碘单质和水:①配平:

②买来试剂KI后,再选用家用厨房中的某些物品也可检验加碘食盐是否含有碘添加剂,你选择的厨房用品有
A.食醋 B.白酒 C.淀粉 D.小苏打 E.鸡精
(4)某化学课外活动小组在调查一化正层时,发现该后有甲乙两个车间,排出的废水澄清透明,经分析知其分别含有三种不同的离子,两厂废水共有
 六种离子。
六种离子。①经检测,甲车间废水
 ,则乙车间废水一定含有离子有
,则乙车间废水一定含有离子有②该活动小组设想变废为宝,将甲乙两车间废水按适当比例混合;既可以除去有害沉淀又利用澄清溶液浇灌农田,该溶液为农作物提供的营养元素有
您最近一年使用:0次



