自来水是自然界中的淡水经过絮凝、沉淀、过滤、消毒等工艺处理后得到的。高铁酸钾(K2FeO4,极易溶于水)是常见的水处理剂,其原理如图所示。完成下列问题:

(1)K2FeO4的电离方程式_______ 。过程①中K2FeO4表现了_______ (填“氧化”或“还原”)性。
(2)根据上述原理分析,作水处理剂时,K2FeO4的作用有_______ 、_______ (填两个)。
(3)制备高铁酸钾常用的反应原理为:Fe(OH)3+KClO+KOH→K2FeO4+KCl+H2O(反应未配平)。
①通过该反应说明:在碱性条件下,氧化性KClO_______ K2FeO4。
A.大于 B.小于 C.等于 D.无法比较
②配平该反应的化学方程式,并用单线桥法 表示电子转移的方向和数目说明_______ ;
(4)世界环保联盟要求ClO2逐渐取代Cl2作为自来水消毒剂
已知:NaCl+3H2O NaClO3+3H2↑
NaClO3+3H2↑
发生器:2NaClO3+4HCl=2ClO2↑+Cl2↑+2NaCl+2H2O
ClO2的生产流程示意图如图:

该工艺中,需要补充的物质X为_______ (填化学式,下同),能参与循环的物质有_______ 。
(5)已知:ClO2是极易溶于水的气体,具有强氧化性。用如图装置探究ClO2性质。回答下列问题:

锥形瓶内ClO2进气导管不伸入液面以下,原因是_______ 。

(1)K2FeO4的电离方程式
(2)根据上述原理分析,作水处理剂时,K2FeO4的作用有
(3)制备高铁酸钾常用的反应原理为:Fe(OH)3+KClO+KOH→K2FeO4+KCl+H2O(反应未配平)。
①通过该反应说明:在碱性条件下,氧化性KClO
A.大于 B.小于 C.等于 D.无法比较
②配平该反应的化学方程式,并用
(4)世界环保联盟要求ClO2逐渐取代Cl2作为自来水消毒剂
已知:NaCl+3H2O
 NaClO3+3H2↑
NaClO3+3H2↑发生器:2NaClO3+4HCl=2ClO2↑+Cl2↑+2NaCl+2H2O
ClO2的生产流程示意图如图:

该工艺中,需要补充的物质X为
(5)已知:ClO2是极易溶于水的气体,具有强氧化性。用如图装置探究ClO2性质。回答下列问题:

锥形瓶内ClO2进气导管不伸入液面以下,原因是
更新时间:2023-05-23 10:13:23
|
相似题推荐
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐1】已知实验室制取氯气的反应原理为:MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O,据此回答下列问题:
MnCl2+Cl2↑+2H2O,据此回答下列问题:
(1)该反应中氧化剂是__________ (填化学式,下同),被氧化的元素是_______ 元素,氧化产物是__________ 。
(2)若反应中生成1mol Cl2,则转移的电子为_____ mol。
(3)用单线桥法表示电子转移的方向和数目:_______________ MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
(4)有一种“地康法”制取氯气的反应原理如下所示:
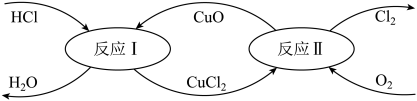
反应Ⅰ:CuO + 2HCl=CuCl2 + H2O
反应Ⅱ:2CuCl2 + O2 =2CuO + 2Cl2
①反应Ⅰ的离子方程式为______________________________________________________ 。
②反应Ⅱ属于____________ 反应。(填四种基本反应类型之一)
③工业生产中常用氨气检查输送氯气的管道是否有Cl2泄漏。若Cl2有泄漏,可以观察到有大量的白烟生成(为NH4Cl固体),同时会生成一种空气中含量最多的物质,试写出该反应的化学方程式:____________________________________________________ 。
 MnCl2+Cl2↑+2H2O,据此回答下列问题:
MnCl2+Cl2↑+2H2O,据此回答下列问题:(1)该反应中氧化剂是
(2)若反应中生成1mol Cl2,则转移的电子为
(3)用单线桥法表示电子转移的方向和数目:
 MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O(4)有一种“地康法”制取氯气的反应原理如下所示:

反应Ⅰ:CuO + 2HCl=CuCl2 + H2O
反应Ⅱ:2CuCl2 + O2 =2CuO + 2Cl2
①反应Ⅰ的离子方程式为
②反应Ⅱ属于
③工业生产中常用氨气检查输送氯气的管道是否有Cl2泄漏。若Cl2有泄漏,可以观察到有大量的白烟生成(为NH4Cl固体),同时会生成一种空气中含量最多的物质,试写出该反应的化学方程式:
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐2】 是一种常用的化学试剂,某化学小组同学利用一定浓度的
是一种常用的化学试剂,某化学小组同学利用一定浓度的 溶液制备
溶液制备 。该小组同学设计了如图气体发生装置(夹持装置省略)
。该小组同学设计了如图气体发生装置(夹持装置省略)
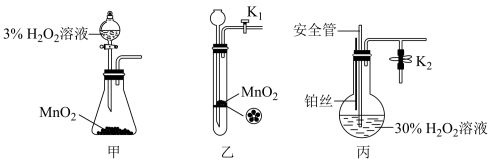
(1)甲装置中主要仪器的名称为_______ 。
(2)检查乙装置气密性的方法_______ 。
(3)乙装置中,用粘合剂将 制成团,放在多孔塑料片上,连接好装置,气密性良好后打开活塞
制成团,放在多孔塑料片上,连接好装置,气密性良好后打开活塞 ,经长颈漏斗向试管中缓慢加入
,经长颈漏斗向试管中缓慢加入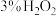 溶液至
溶液至_______ 。欲使反应停止,关闭活塞 即可,此时装置中的现象是
即可,此时装置中的现象是_______ 。
(4)丙装置可用于制备较多 ,催化剂铂丝可上下移动。制备过程中如果体系内压强过大,安全管中的现象是
,催化剂铂丝可上下移动。制备过程中如果体系内压强过大,安全管中的现象是_______ ,此时可以将铂丝抽离 溶液,还可以采取的安全措施是
溶液,还可以采取的安全措施是_______ 。
(5)将 气体通入到
气体通入到 溶液中,得到强酸性溶液A,向溶液A中滴加
溶液中,得到强酸性溶液A,向溶液A中滴加 溶液有白色沉淀B生成。写出得到溶液A的化学方程式,并用双线桥标出电子转移的方向与数目
溶液有白色沉淀B生成。写出得到溶液A的化学方程式,并用双线桥标出电子转移的方向与数目_______ ,写出生成沉淀B的离子方程式_______ 。
 是一种常用的化学试剂,某化学小组同学利用一定浓度的
是一种常用的化学试剂,某化学小组同学利用一定浓度的 溶液制备
溶液制备 。该小组同学设计了如图气体发生装置(夹持装置省略)
。该小组同学设计了如图气体发生装置(夹持装置省略)
(1)甲装置中主要仪器的名称为
(2)检查乙装置气密性的方法
(3)乙装置中,用粘合剂将
 制成团,放在多孔塑料片上,连接好装置,气密性良好后打开活塞
制成团,放在多孔塑料片上,连接好装置,气密性良好后打开活塞 ,经长颈漏斗向试管中缓慢加入
,经长颈漏斗向试管中缓慢加入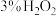 溶液至
溶液至 即可,此时装置中的现象是
即可,此时装置中的现象是(4)丙装置可用于制备较多
 ,催化剂铂丝可上下移动。制备过程中如果体系内压强过大,安全管中的现象是
,催化剂铂丝可上下移动。制备过程中如果体系内压强过大,安全管中的现象是 溶液,还可以采取的安全措施是
溶液,还可以采取的安全措施是(5)将
 气体通入到
气体通入到 溶液中,得到强酸性溶液A,向溶液A中滴加
溶液中,得到强酸性溶液A,向溶液A中滴加 溶液有白色沉淀B生成。写出得到溶液A的化学方程式,并用双线桥标出电子转移的方向与数目
溶液有白色沉淀B生成。写出得到溶液A的化学方程式,并用双线桥标出电子转移的方向与数目
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐3】测定某明矾样品(含砷酸盐)中砷的含量,实验步骤如下:
实验一:配制砷标准溶液
①取一定质量的As2O3,用NaOH溶液完全溶解后,配制成1LNa3AsO3溶液(此溶液1.0mL相当于0.10g砷)。
②取一定量上述溶液,配制500mL含砷量为1.0g·L-1的砷标准溶液。
(1)②需取用①中Na3AsO3溶液___________ mL。
实验二:测定样品中砷含量(实验装置如图,夹持装置已略去)
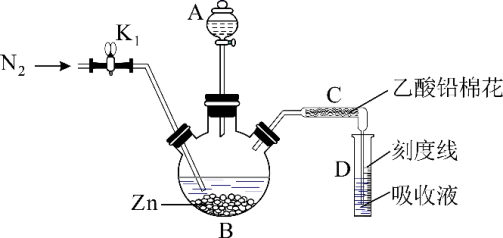
①往B瓶中加入20.00mL砷标准溶液,再依次加入一定量的盐酸、KI试液和SnCl2溶液,室温放置10min,使砷元素全部转化为H3AsO3。
②往B瓶中加入足量锌粒(含有ZnS杂质),立即塞上装有乙酸铅棉花的导气管C,并使C管右侧末端插入比色管D中银盐吸收液的液面下,控制反应温度25~40℃。45 min后,打开K1通入N2,生成的砷化氢气体被完全吸收,Ag+被还原为红色胶态银。
③用明矾样品代替20.00mL砷标准溶液进行实验,相同条件下生成相同量红色胶态银,需要5.0g明矾样品。
(2)量取20.00mL砷标准溶液使用的定量仪器为___________ ,乙酸铅棉花的作用是___________ 。
(3)写出Zn与H3AsO3生成砷化氢反应的离子方程式并用单线桥表示电子转移的方向和数目___________ 。
(4)控制B瓶中反应温度的方法是___________ ,反应中通入N2的作用是___________ 。
(5)明矾样品中砷的含量为___________ %。
实验一:配制砷标准溶液
①取一定质量的As2O3,用NaOH溶液完全溶解后,配制成1LNa3AsO3溶液(此溶液1.0mL相当于0.10g砷)。
②取一定量上述溶液,配制500mL含砷量为1.0g·L-1的砷标准溶液。
(1)②需取用①中Na3AsO3溶液
实验二:测定样品中砷含量(实验装置如图,夹持装置已略去)

①往B瓶中加入20.00mL砷标准溶液,再依次加入一定量的盐酸、KI试液和SnCl2溶液,室温放置10min,使砷元素全部转化为H3AsO3。
②往B瓶中加入足量锌粒(含有ZnS杂质),立即塞上装有乙酸铅棉花的导气管C,并使C管右侧末端插入比色管D中银盐吸收液的液面下,控制反应温度25~40℃。45 min后,打开K1通入N2,生成的砷化氢气体被完全吸收,Ag+被还原为红色胶态银。
③用明矾样品代替20.00mL砷标准溶液进行实验,相同条件下生成相同量红色胶态银,需要5.0g明矾样品。
(2)量取20.00mL砷标准溶液使用的定量仪器为
(3)写出Zn与H3AsO3生成砷化氢反应的离子方程式并用单线桥表示电子转移的方向和数目
(4)控制B瓶中反应温度的方法是
(5)明矾样品中砷的含量为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐1】氯化亚铜(CuCl)广泛应用于化工、印染、电镀等行业。CuCl难溶于乙醇和水,可溶于氯离子浓度较大的体系,在潮湿空气中易水解、氧化。
【制备】方法一:
【资料查阅】
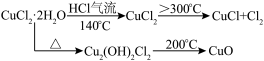

(1)仪器X的名称是______ ,在实验过程中,B中试纸的颜色变化是______ 。
(2)实验操作的先后顺序是
______  (填操作的编号)
(填操作的编号)
a.检查装置的气密性后加入药品 b.熄灭酒精灯,冷却 c.在气体入口处通入干燥HCl
d.点燃酒精灯,加热 e.停止通入HCI,然后通入
(3)反应结束后发现含有少量CuO杂质,产生的原因是______ 。
方法二:
(4)向 ,溶液中加入一定量NaCl和
,溶液中加入一定量NaCl和 可生成自色沉淀CuCl离子方程式为
可生成自色沉淀CuCl离子方程式为______ ,过滤,沉淀用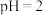 的酸洗,水洗,乙醇洗三步操作,酸洗采用的酸是
的酸洗,水洗,乙醇洗三步操作,酸洗采用的酸是______ (写名称),用乙醇洗涤的原因是______ (任写一点)。
【含量测定】
(5)准确称取所制备的氯化亚铜样品m g,将其置于过量的 溶液中,待样品完全溶解后,加入适量稀硫酸,用a mol/L的
溶液中,待样品完全溶解后,加入适量稀硫酸,用a mol/L的 溶液滴定
溶液滴定 到终点,消耗
到终点,消耗 溶液b mL,反应中
溶液b mL,反应中 被还原为
被还原为 ,样品中CuCl的质量分数为
,样品中CuCl的质量分数为______ (CuCl分子量: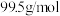 )
)
【应用】利用如下图所示装置,测定高炉煤气中CO、 、
、 和
和 )的百分组成。
)的百分组成。

(6)已知:
i.CuCl的盐酸溶液能吸收CO形成 。
。
ii.保险粉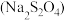 和KOH的混合溶液能吸收氧气。
和KOH的混合溶液能吸收氧气。
①出保险粉和KOH混合溶液吸收 的离子方程式:
的离子方程式:______ 。
②D、F洗气瓶中宜盛放的试剂分别是______ 、______ 。
【制备】方法一:
【资料查阅】
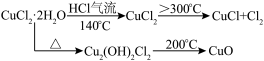

(1)仪器X的名称是
(2)实验操作的先后顺序是

 (填操作的编号)
(填操作的编号)a.检查装置的气密性后加入药品 b.熄灭酒精灯,冷却 c.在气体入口处通入干燥HCl
d.点燃酒精灯,加热 e.停止通入HCI,然后通入

(3)反应结束后发现含有少量CuO杂质,产生的原因是
方法二:
(4)向
 ,溶液中加入一定量NaCl和
,溶液中加入一定量NaCl和 可生成自色沉淀CuCl离子方程式为
可生成自色沉淀CuCl离子方程式为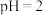 的酸洗,水洗,乙醇洗三步操作,酸洗采用的酸是
的酸洗,水洗,乙醇洗三步操作,酸洗采用的酸是【含量测定】
(5)准确称取所制备的氯化亚铜样品m g,将其置于过量的
 溶液中,待样品完全溶解后,加入适量稀硫酸,用a mol/L的
溶液中,待样品完全溶解后,加入适量稀硫酸,用a mol/L的 溶液滴定
溶液滴定 到终点,消耗
到终点,消耗 溶液b mL,反应中
溶液b mL,反应中 被还原为
被还原为 ,样品中CuCl的质量分数为
,样品中CuCl的质量分数为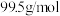 )
)【应用】利用如下图所示装置,测定高炉煤气中CO、
 、
、 和
和 )的百分组成。
)的百分组成。
(6)已知:
i.CuCl的盐酸溶液能吸收CO形成
 。
。ii.保险粉
 和KOH的混合溶液能吸收氧气。
和KOH的混合溶液能吸收氧气。①出保险粉和KOH混合溶液吸收
 的离子方程式:
的离子方程式:②D、F洗气瓶中宜盛放的试剂分别是
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐2】三草酸合铁酸钾是制备负载型活性催化剂的主要原料,易溶于水,难溶于乙醇。实验室制备流程如图:

(1)制备FeC2O4•2H2O晶体。
①“溶解”时加入硫酸的目的是___ 。
②“沉淀”得到FeC2O4•2H2O晶体,“沉淀”时发生反应的离子方程式为___ 。
③“沉淀”时需要煮沸,其目的是___ 。
(2)制备K3[Fe(C2O4)3]·3H2O晶体。
【查阅资料】
①K2Fe(C2O4)2溶于水;Fe2(C2O4)3难溶于水。
②实验条件下,pH=3.2时,Fe3+沉淀完全;过氧化氢在40℃发生显著分解。
③铁氰化钾(K3[Fe(CN)6])溶液与Fe2+反应产生深蓝色沉淀,与Fe3+不反应。以FeC2O4•2H2O晶体作为原料,制备K3[Fe(C2O4)3]·3H2O晶体时,请补充完整相应的实验方案:取一定量的FeC2O4•2H2O晶体,边加入饱和H2C2O4溶液边搅拌,至pH约为3,___ ,过滤、晾干、得到K3[Fe(C2O4)3]•3H2O晶体。(实验中须使用的试剂:10%H2O2溶液,饱和K2C2O4溶液,无水乙醇,K3[Fe(CN)6]溶液。)
(3)通过下列方法测定产品纯度:准确称取1.250gK3[Fe(C2O4)3]·3H2O样品,加入适量水溶解并用稀硫酸酸化,加热至80℃,趁热用0.1500mol·L-1KMnO4标准溶液滴定至终点,消耗KMnO4标准溶液18.30mL。测定过程中发生的反应为:2MnO +5C2O
+5C2O +16H+=2Mn2++10CO2↑+8H2O。计算样品的纯度(写出计算过程):
+16H+=2Mn2++10CO2↑+8H2O。计算样品的纯度(写出计算过程):___ 。

(1)制备FeC2O4•2H2O晶体。
①“溶解”时加入硫酸的目的是
②“沉淀”得到FeC2O4•2H2O晶体,“沉淀”时发生反应的离子方程式为
③“沉淀”时需要煮沸,其目的是
(2)制备K3[Fe(C2O4)3]·3H2O晶体。
【查阅资料】
①K2Fe(C2O4)2溶于水;Fe2(C2O4)3难溶于水。
②实验条件下,pH=3.2时,Fe3+沉淀完全;过氧化氢在40℃发生显著分解。
③铁氰化钾(K3[Fe(CN)6])溶液与Fe2+反应产生深蓝色沉淀,与Fe3+不反应。以FeC2O4•2H2O晶体作为原料,制备K3[Fe(C2O4)3]·3H2O晶体时,请补充完整相应的实验方案:取一定量的FeC2O4•2H2O晶体,边加入饱和H2C2O4溶液边搅拌,至pH约为3,
(3)通过下列方法测定产品纯度:准确称取1.250gK3[Fe(C2O4)3]·3H2O样品,加入适量水溶解并用稀硫酸酸化,加热至80℃,趁热用0.1500mol·L-1KMnO4标准溶液滴定至终点,消耗KMnO4标准溶液18.30mL。测定过程中发生的反应为:2MnO
 +5C2O
+5C2O +16H+=2Mn2++10CO2↑+8H2O。计算样品的纯度(写出计算过程):
+16H+=2Mn2++10CO2↑+8H2O。计算样品的纯度(写出计算过程):
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
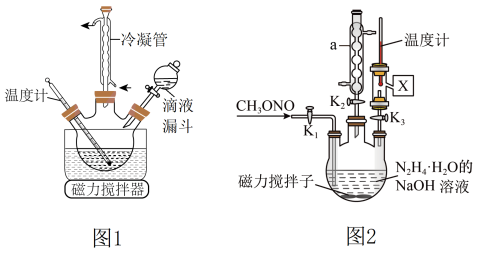
【推荐3】工业水合肼法制备叠氮化钠的工艺流程如图所示:

一、合成水合肼
已知: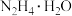 (水合肼)与水互溶,有毒且不稳定,100℃以上易分解失水,具有强还原性和强碱性。
(水合肼)与水互溶,有毒且不稳定,100℃以上易分解失水,具有强还原性和强碱性。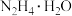 (水合肼)熔点-40℃,沸点118.5℃。
(水合肼)熔点-40℃,沸点118.5℃。
合成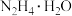 的装置如图1所示。
的装置如图1所示。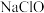 碱性溶液与尿素
碱性溶液与尿素 水溶液在40℃以下反应一段时间后,再迅速升温至110℃继续反应可以制得水合肼。
水溶液在40℃以下反应一段时间后,再迅速升温至110℃继续反应可以制得水合肼。
(1)写出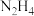 的结构式
的结构式____________ ,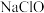 的电子式
的电子式____________
(2)①写出制取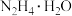 的离子方程式
的离子方程式___________________________
②实验中通过滴液漏斗滴加的溶液是_________ 理由是_______________ 图1使用冷凝管的目的是____________________________________
③从反应后的混合溶分离出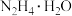 ,应该采用的分离方法最合理的是
,应该采用的分离方法最合理的是________ 。
二、合成叠氮化钠(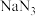 )晶体
)晶体
已知:相关物质的物理性质如下表
(3)实验室模拟工艺流程步骤Ⅱ的实验装置如图2
①根据实验发现温度在20℃左右反应的选择性和转化率最高,但是该反应属于放热反应,因此可以采取的措施是________________ 。(写出1点即可)
②图中 处连接的最合适装置应为下图中的
处连接的最合适装置应为下图中的__________ 。
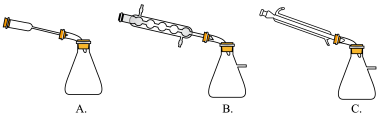
③步骤Ⅱ中制备叠氮化钠的操作是________ (填序号)步骤Ⅲ中溶液 进行蒸馏的合理操作顺序是
进行蒸馏的合理操作顺序是_______ 。(填序号)
①打开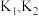 ,关闭
,关闭 ②打开
②打开 ③加热④关闭
③加热④关闭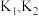
(4)步骤Ⅳ对溶液 加热蒸发至溶液体积的
加热蒸发至溶液体积的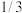 ,
,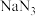 结晶析出。步骤Ⅴ可以用
结晶析出。步骤Ⅴ可以用________ 洗涤晶体。
A.水B.乙醚C.乙醇水溶液D.乙醇
(5)工业上还可以用水合肼还原法制取碘化钠,工艺流程如图:
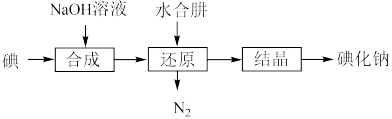
还原过程中可用硫化钠或铁屑等物质替代水合肼,但水合肼还原法制得的产品纯度更高,原因是______________________________________ 。


一、合成水合肼
已知:
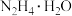 (水合肼)与水互溶,有毒且不稳定,100℃以上易分解失水,具有强还原性和强碱性。
(水合肼)与水互溶,有毒且不稳定,100℃以上易分解失水,具有强还原性和强碱性。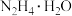 (水合肼)熔点-40℃,沸点118.5℃。
(水合肼)熔点-40℃,沸点118.5℃。合成
 的装置如图1所示。
的装置如图1所示。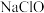 碱性溶液与尿素
碱性溶液与尿素 水溶液在40℃以下反应一段时间后,再迅速升温至110℃继续反应可以制得水合肼。
水溶液在40℃以下反应一段时间后,再迅速升温至110℃继续反应可以制得水合肼。(1)写出
 的结构式
的结构式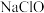 的电子式
的电子式(2)①写出制取
 的离子方程式
的离子方程式②实验中通过滴液漏斗滴加的溶液是
③从反应后的混合溶分离出
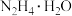 ,应该采用的分离方法最合理的是
,应该采用的分离方法最合理的是二、合成叠氮化钠(
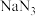 )晶体
)晶体已知:相关物质的物理性质如下表
| 熔点℃ | 沸点℃ | 溶解性 | |
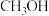 | -97 | 67.1 | 与水互溶 |
水合肼(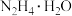 ) ) | -40 | 118.5 | 与水、醇互溶,不溶于乙醚和氯仿 |
亚硝酸甲酯(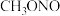 ) ) | -17 | -12 | 溶于乙醇、乙醚 |
| NaN3 | 与水互溶,不溶于乙醚、微溶于乙醇 |
(3)实验室模拟工艺流程步骤Ⅱ的实验装置如图2
①根据实验发现温度在20℃左右反应的选择性和转化率最高,但是该反应属于放热反应,因此可以采取的措施是
②图中
 处连接的最合适装置应为下图中的
处连接的最合适装置应为下图中的
③步骤Ⅱ中制备叠氮化钠的操作是
 进行蒸馏的合理操作顺序是
进行蒸馏的合理操作顺序是①打开
 ,关闭
,关闭 ②打开
②打开 ③加热④关闭
③加热④关闭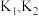
(4)步骤Ⅳ对溶液
 加热蒸发至溶液体积的
加热蒸发至溶液体积的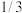 ,
,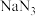 结晶析出。步骤Ⅴ可以用
结晶析出。步骤Ⅴ可以用A.水B.乙醚C.乙醇水溶液D.乙醇
(5)工业上还可以用水合肼还原法制取碘化钠,工艺流程如图:

还原过程中可用硫化钠或铁屑等物质替代水合肼,但水合肼还原法制得的产品纯度更高,原因是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐1】氯化亚铜(CuCl)具有还原常用于气体CO、C2H2测定,它是白色粉末,微溶于水,不溶于乙醇。某小组设计实验利用SO2和含NaCl的CuCl2溶液反应制备CuCl。

实验步骤:
①按如图装置进行实验:
②当B中产生大量固体时停止反应:
③对B中混合物进行过滤,用15%酒精洗涤、干燥。
回答下列问题:
(1)A中试剂宜选择___ (填字母)。
a.铜和98%浓硫酸
b.亚硫酸钠粉末和10%硫酸
c.亚硫酸钠粉末和75%硫酸
d.亚硫酸钠粉末和98%硫酸
(2)写出B中发生反应的化学方程式:___ ;其中,从勒夏特列原理角度分析NaCl的作用是___ 。
(3)用75%的酒精洗涤CuCl产品的优点是___ (答一条即可)。
(4)证明C中SO2是否过量。猜想1:SO2少量,发生反应Ca(ClO)2+SO2+H2O=CaSO4↓+HCl+HClO;
猜想2:SO2过量,发生反应的离子方程式为___ 。取C中上层清液于试管中,___ (补充实验),则猜想1正确;否则猜想2正确。
(5)实验完毕后,取少量D中溶液于试管,滴加下列试剂,可证明有Fe2+生成的最佳试剂是___ (填字母)。
a酸性(KMnO4)溶液
b氨水和KSCN溶液
c.K3[Fe(CN)6]溶液
d.NaOH溶液
(6)测定产品纯度:取wgCuCl产品溶于氨水中向所得溶液中通入足量的C2H2(乙炔),得综红色固体(CuC CCu)ag。该产品纯度为
CCu)ag。该产品纯度为___ (假设杂质不参加反应)。
(已知CuCl+2NH3•H2O=[Cu(NH3)2]Cl+2H2O,CH CH+2[Cu(NH3)2]Cl→CuC
CH+2[Cu(NH3)2]Cl→CuC CCu↓+2NH4Cl+2NH3)
CCu↓+2NH4Cl+2NH3)

实验步骤:
①按如图装置进行实验:
②当B中产生大量固体时停止反应:
③对B中混合物进行过滤,用15%酒精洗涤、干燥。
回答下列问题:
(1)A中试剂宜选择
a.铜和98%浓硫酸
b.亚硫酸钠粉末和10%硫酸
c.亚硫酸钠粉末和75%硫酸
d.亚硫酸钠粉末和98%硫酸
(2)写出B中发生反应的化学方程式:
(3)用75%的酒精洗涤CuCl产品的优点是
(4)证明C中SO2是否过量。猜想1:SO2少量,发生反应Ca(ClO)2+SO2+H2O=CaSO4↓+HCl+HClO;
猜想2:SO2过量,发生反应的离子方程式为
(5)实验完毕后,取少量D中溶液于试管,滴加下列试剂,可证明有Fe2+生成的最佳试剂是
a酸性(KMnO4)溶液
b氨水和KSCN溶液
c.K3[Fe(CN)6]溶液
d.NaOH溶液
(6)测定产品纯度:取wgCuCl产品溶于氨水中向所得溶液中通入足量的C2H2(乙炔),得综红色固体(CuC
 CCu)ag。该产品纯度为
CCu)ag。该产品纯度为(已知CuCl+2NH3•H2O=[Cu(NH3)2]Cl+2H2O,CH
 CH+2[Cu(NH3)2]Cl→CuC
CH+2[Cu(NH3)2]Cl→CuC CCu↓+2NH4Cl+2NH3)
CCu↓+2NH4Cl+2NH3)
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐2】在 时,将氯气通入
时,将氯气通入 和炭粉的混合物中,反应生成四氯化钛和氯化铁,同时产生一种还原性气体。现制取并收集四氯化钛的装置如图1所示(部分夹持装置略)。
和炭粉的混合物中,反应生成四氯化钛和氯化铁,同时产生一种还原性气体。现制取并收集四氯化钛的装置如图1所示(部分夹持装置略)。

已知:① 高温时能与
高温时能与 反应,不与
反应,不与 反应;②
反应;② 与
与 的部分物理性质如下表。
的部分物理性质如下表。
(1)组装好仪器,添加试剂前,应该进行的操作是_________ 。
(2)用 与浓盐酸制备
与浓盐酸制备 ,反应的离子方程式为
,反应的离子方程式为_________ 。实验中需先后通入 两次,第二次通入
两次,第二次通入 时活塞
时活塞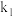 、
、 的状态为
的状态为___________ ,作用是_________________ 。
(3) 时,瓷舟中发生反应的化学方程式为
时,瓷舟中发生反应的化学方程式为__________ 。
(4)控温箱的温度在 ,目的是
,目的是__________ 。
(5)装置单元X的作用是________ 。
(6)利用如图2所示装置测定所得 的纯度:取
的纯度:取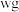 产品加入烧瓶,向安全漏斗中加入适量蒸馏水,待
产品加入烧瓶,向安全漏斗中加入适量蒸馏水,待 充分反应后,将烧瓶和安全漏斗中的液体一并转入锥形瓶中,滴入3滴
充分反应后,将烧瓶和安全漏斗中的液体一并转入锥形瓶中,滴入3滴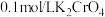 溶液作指示剂.用
溶液作指示剂.用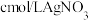 标准溶液滴定至终点,消耗
标准溶液滴定至终点,消耗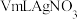 标准溶液。已知:
标准溶液。已知: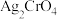 呈砖红色。
呈砖红色。
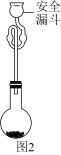
①安全漏斗在本实验中的作用除加水外,还有___________ .
②达到滴定终点时的现象为_________ 。
③产品中 的纯度为
的纯度为________ (用含w,c和V的代数式表示)。
 时,将氯气通入
时,将氯气通入 和炭粉的混合物中,反应生成四氯化钛和氯化铁,同时产生一种还原性气体。现制取并收集四氯化钛的装置如图1所示(部分夹持装置略)。
和炭粉的混合物中,反应生成四氯化钛和氯化铁,同时产生一种还原性气体。现制取并收集四氯化钛的装置如图1所示(部分夹持装置略)。
已知:①
 高温时能与
高温时能与 反应,不与
反应,不与 反应;②
反应;② 与
与 的部分物理性质如下表。
的部分物理性质如下表。熔点/ | 沸点/ | 水溶性 | |
|
| 136.4 | 极易水解生成白色沉淀 |
| 306 | 315 | 易水解生成红褐色沉淀 |
(2)用
 与浓盐酸制备
与浓盐酸制备 ,反应的离子方程式为
,反应的离子方程式为 两次,第二次通入
两次,第二次通入 时活塞
时活塞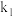 、
、 的状态为
的状态为(3)
 时,瓷舟中发生反应的化学方程式为
时,瓷舟中发生反应的化学方程式为(4)控温箱的温度在
 ,目的是
,目的是(5)装置单元X的作用是
(6)利用如图2所示装置测定所得
 的纯度:取
的纯度:取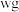 产品加入烧瓶,向安全漏斗中加入适量蒸馏水,待
产品加入烧瓶,向安全漏斗中加入适量蒸馏水,待 充分反应后,将烧瓶和安全漏斗中的液体一并转入锥形瓶中,滴入3滴
充分反应后,将烧瓶和安全漏斗中的液体一并转入锥形瓶中,滴入3滴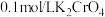 溶液作指示剂.用
溶液作指示剂.用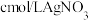 标准溶液滴定至终点,消耗
标准溶液滴定至终点,消耗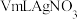 标准溶液。已知:
标准溶液。已知: 呈砖红色。
呈砖红色。
①安全漏斗在本实验中的作用除加水外,还有
②达到滴定终点时的现象为
③产品中
 的纯度为
的纯度为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐3】印刷电路板是由有机复合材料和铜箔复合构成,刻制印刷电路时,要用FeCl3溶液作为“腐蚀液”,研究其制备及性质是一个重要的课题。
(1)氯化铁晶体的制备(夹持及加热装置省略)

①实验过程中装置甲中发生反应的离子方程式_________________________________ 。
②为顺利达成实验目的,上述装置中甲中活塞、乙中活塞、弹簧夹1、2、3打开和关闭的顺序为__________ 。
③反应结束后,将乙中溶液边加入___________ ,边进行加热浓缩、___________ 、过滤、洗涤、干燥即得到产品。
(2)氯化铁的性质探究:
已知:①氯化铁的熔点为306℃、沸点为315℃,易升华,气态FeCl3会分解成FeCl2和Cl2②FeCl2熔点670℃)
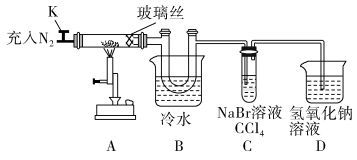
(1)氯化铁晶体的制备(夹持及加热装置省略)

①实验过程中装置甲中发生反应的离子方程式
②为顺利达成实验目的,上述装置中甲中活塞、乙中活塞、弹簧夹1、2、3打开和关闭的顺序为
③反应结束后,将乙中溶液边加入
(2)氯化铁的性质探究:
已知:①氯化铁的熔点为306℃、沸点为315℃,易升华,气态FeCl3会分解成FeCl2和Cl2②FeCl2熔点670℃)

| 操作步骤 | 实验现象 | 解释原因 |
| 打开K,充入氮气 | D中有气泡产生 | ①充入N2的原因 |
| 关闭K,加热至600℃,充分灼烧固体 | B中出现棕黄色固体 | ②产生现象的原因 |
| 实验结束,振荡C静置 | ③ | ④ |
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐1】实验室用浓硫酸和乙醇反应制备乙烯,若温度过高或加热时间过长,制得的乙稀往往混有CO2、SO2、H2O(气体少量)。请回答下列问题:
(1)试分析CO2和SO2是怎么样产生的?_____________________ (用一句话说明)。
(2)试用下图所示的装置设计一个实验,验证制得的气体中确实含有CO2和SO2、H2O(g),按气流的方向,各装置的连接顺序是:_______________ 。
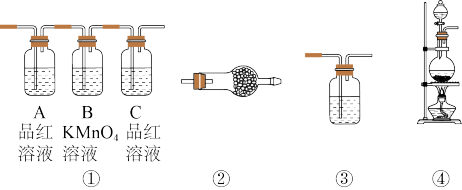
(3)实验时若观察到:①中从左到右A瓶中品红溶液褪色,B瓶中高锰酸钾溶液颜色逐渐变浅,C瓶中品红溶液不褪色,则A瓶的作用是______ ,B瓶的作用是______ ,C瓶的作用是______ 。
(4)装置②中所加的试剂名称是______ ,它可以验证的气体是______ ,简述确定装置②在整套装置中的位置的理由是_________________________ 。
(5)装置③中所盛溶液的名称是______ ,它可以用来验证的气体是______ 。
(1)试分析CO2和SO2是怎么样产生的?
(2)试用下图所示的装置设计一个实验,验证制得的气体中确实含有CO2和SO2、H2O(g),按气流的方向,各装置的连接顺序是:

(3)实验时若观察到:①中从左到右A瓶中品红溶液褪色,B瓶中高锰酸钾溶液颜色逐渐变浅,C瓶中品红溶液不褪色,则A瓶的作用是
(4)装置②中所加的试剂名称是
(5)装置③中所盛溶液的名称是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐2】某同学欲在实验室中完成Fe与水蒸气反应的实验,实验装置如图甲、乙所示。

已知B中放入的是铁粉与石棉绒的混合物,C中放的是干燥剂,E为酒精喷灯,G为带有铁丝网罩的酒精灯。对比两装置,回答下列问题:
(1)如何检查乙装置的气密性?________________ 。
(2)乙装置中湿沙子的作用是________________ 。
(3)B处发生反应的化学方程式为_________________ 。
(4)该同学认为欲在乙装置的导管口处点燃反应产生的气体,装置H必不可少,H的作用是________________ 。
(5)对比甲、乙两装置的B和K,B的优点是____________ 。

已知B中放入的是铁粉与石棉绒的混合物,C中放的是干燥剂,E为酒精喷灯,G为带有铁丝网罩的酒精灯。对比两装置,回答下列问题:
(1)如何检查乙装置的气密性?
(2)乙装置中湿沙子的作用是
(3)B处发生反应的化学方程式为
(4)该同学认为欲在乙装置的导管口处点燃反应产生的气体,装置H必不可少,H的作用是
(5)对比甲、乙两装置的B和K,B的优点是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐3】已知苯与液溴的反应是放热反应,某校学生为探究苯与液溴发生的反应,用如图装置(夹持装置已略去)进行实验。

根据相关知识回答下列问题:
(1)实验开始时,关闭 ,打开
,打开 和分液漏斗活塞,滴加苯和液溴的混合液,反应开始。一段时间后,在装置Ⅲ中可能观察到的现象是
和分液漏斗活塞,滴加苯和液溴的混合液,反应开始。一段时间后,在装置Ⅲ中可能观察到的现象是_______ 。
(2)冷凝管的作用是_______ 。
(3)反应结束后要使装置Ⅰ中的水倒吸入装置Ⅱ中。这样操作的目的是_______ ,简述这一操作的方法:_______ 。
(4)写出苯与液溴反应的化学方程式:_______ 。

根据相关知识回答下列问题:
(1)实验开始时,关闭
 ,打开
,打开 和分液漏斗活塞,滴加苯和液溴的混合液,反应开始。一段时间后,在装置Ⅲ中可能观察到的现象是
和分液漏斗活塞,滴加苯和液溴的混合液,反应开始。一段时间后,在装置Ⅲ中可能观察到的现象是(2)冷凝管的作用是
(3)反应结束后要使装置Ⅰ中的水倒吸入装置Ⅱ中。这样操作的目的是
(4)写出苯与液溴反应的化学方程式:
您最近一年使用:0次





