解题方法
1 . Ⅰ.实验小组利用传感器探究Na2CO3和NaHCO3的性质。
【查阅资料】pH越小,OH-浓度越小,溶液碱性越弱。
【实验过程】
【分析与解释】
(1)实验①中,溶解时吸收热量的物质是___________ 。
(2)实验②中,Na2CO3溶液和澄清石灰水反应的离子方程式为___________ ,OH-未参与该反应的实验证据是___________ 。
(3)实验②中,滴加NaHCO3溶液的pH变化与滴加Na2CO3溶液的有明显差异,原因是滴加NaHCO3溶液的烧杯中,参与反应的离子有___________ 。
(4)工业上制得的纯碱中常含有一定量的NaHCO3,取质量为a g的纯碱样品,充分加热后,质量减少b g,此样品中Na2CO3的质量分数___________ 。
Ⅱ.可用Cl2和Ca(OH)2制备漂粉精,漂粉精常用于游泳池的消毒,起消毒作用的是HClO,池水的酸碱性对漂粉精的消毒效果影响明显。
(5)写出制备漂粉精的化学方程式___________ 。
(6)若池水碱性过强,消毒作用会___________ (填“增强”或“减弱”)。
(7)若池水酸性过强,会刺激眼睛和皮肤。有时加入Na2CO3、NaHCO3以降低酸性,起到降低酸性作用的离子分别是___________ (填离子符号)。
【查阅资料】pH越小,OH-浓度越小,溶液碱性越弱。
【实验过程】
| 编号 | 实验操作 | 实验数据 |
| 实验① | 测量下述实验过程的温度变化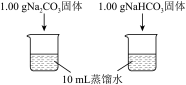 |  |
| 实验② | 测量下述实验过程的pH变化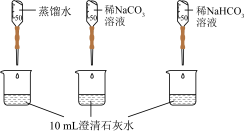 | 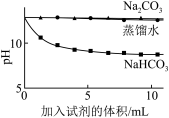 |
(1)实验①中,溶解时吸收热量的物质是
(2)实验②中,Na2CO3溶液和澄清石灰水反应的离子方程式为
(3)实验②中,滴加NaHCO3溶液的pH变化与滴加Na2CO3溶液的有明显差异,原因是滴加NaHCO3溶液的烧杯中,参与反应的离子有
(4)工业上制得的纯碱中常含有一定量的NaHCO3,取质量为a g的纯碱样品,充分加热后,质量减少b g,此样品中Na2CO3的质量分数
Ⅱ.可用Cl2和Ca(OH)2制备漂粉精,漂粉精常用于游泳池的消毒,起消毒作用的是HClO,池水的酸碱性对漂粉精的消毒效果影响明显。
(5)写出制备漂粉精的化学方程式
(6)若池水碱性过强,消毒作用会
(7)若池水酸性过强,会刺激眼睛和皮肤。有时加入Na2CO3、NaHCO3以降低酸性,起到降低酸性作用的离子分别是
您最近一年使用:0次
名校
解题方法
2 . 某兴趣小组的同学模拟侯德榜制碱法制取纯碱,流程如图:

(1)向饱和NaCl溶液中通入 和氨气时,应先通入
和氨气时,应先通入___________ (填化学式)。操作①的名称为___________ 。
(2)写出反应①的化学方程式:___________ 。
(3)该流程中可循环利用的物质是___________ (填化学式)。
(4)现将 和
和 的固体均匀混合分成两等份。第一份充分加热至恒重,固体质量减少6.2g;第二份与足量稀盐酸充分反应后,加热、蒸干,得到固体23.4g。则混合物中
的固体均匀混合分成两等份。第一份充分加热至恒重,固体质量减少6.2g;第二份与足量稀盐酸充分反应后,加热、蒸干,得到固体23.4g。则混合物中 和
和 的物质的量之比为
的物质的量之比为___________ 。
(5)下列选项中哪种方法可以鉴别 溶液和
溶液和 溶液___________。
溶液___________。
(6)下列实验方案中,不能测定出 和
和 的混合物中
的混合物中 质量分数的是_______。
质量分数的是_______。
(7)钠是一种典型的碱金属元素,下列性质的递变规律正确,且能作为碱金属元素金属性递变规律判断依据的是___________(填字母)。

(1)向饱和NaCl溶液中通入
 和氨气时,应先通入
和氨气时,应先通入(2)写出反应①的化学方程式:
(3)该流程中可循环利用的物质是
(4)现将
 和
和 的固体均匀混合分成两等份。第一份充分加热至恒重,固体质量减少6.2g;第二份与足量稀盐酸充分反应后,加热、蒸干,得到固体23.4g。则混合物中
的固体均匀混合分成两等份。第一份充分加热至恒重,固体质量减少6.2g;第二份与足量稀盐酸充分反应后,加热、蒸干,得到固体23.4g。则混合物中 和
和 的物质的量之比为
的物质的量之比为(5)下列选项中哪种方法可以鉴别
 溶液和
溶液和 溶液___________。
溶液___________。| A.加入澄清石灰水 | B.加入氢氧化钠溶液 |
| C.加热 | D.逐滴加入稀盐酸 |
(6)下列实验方案中,不能测定出
 和
和 的混合物中
的混合物中 质量分数的是_______。
质量分数的是_______。| A.取ag混合物充分加热,质量减少bg |
| B.取ag混合物与足量稀盐酸充分反应,加热、蒸干、灼烧,得到bg固体 |
| C.取ag混合物与足量NaOH溶液充分反应,得到bg溶液 |
| D.取ag混合物与足量稀硫酸充分反应,逸出气体经干燥后用碱石灰吸收,质量增加bg |
(7)钠是一种典型的碱金属元素,下列性质的递变规律正确,且能作为碱金属元素金属性递变规律判断依据的是___________(填字母)。
| A.Li、Na、K的原子半径和密度都随原子序数的增加而增大 |
B.碱性: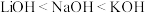 |
C.还原性: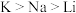 ,故K可以从NaCl溶液中置换出金属钠 ,故K可以从NaCl溶液中置换出金属钠 |
D.熔、沸点: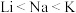 |
您最近一年使用:0次
2023-12-23更新
|
141次组卷
|
3卷引用:湖南省长沙市南雅中学2023-2024学年高一上学期第三次12月月考化学试卷
3 . 钠是浩瀚大海中含量较高的元素之一,下列关于钠及其化合物的叙述中不正确的是
| A.钠在常温下容易被氧化,实验室里要把钠保存在石蜡油或煤油中 |
B.不可用 溶液区分 溶液区分 溶液和 溶液和 溶液 溶液 |
C. 和 和 都能和水反应生成碱,它们都是碱性氧化物 都能和水反应生成碱,它们都是碱性氧化物 |
| D.液态钠可以用作核反应堆的传热介质 |
您最近一年使用:0次
4 . 海洋是一个巨大的化学资源宝库,其中钠元素是海洋中含量较高的元素。
(1)已知在太阳光作用下,绿色植物体内的叶绿素能将水、CO2转化为葡萄糖。海水吸收CO2并进行碳循环的原理示意图如下:
(2)某同学欲用碳酸钠晶体(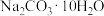 )配制220mL1mol/L的Na2CO3溶液。
)配制220mL1mol/L的Na2CO3溶液。
①所需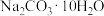 的质量为
的质量为___________ g。
②实验中除需要托盘天平(带砝码)、药匙、量筒、烧杯、玻璃棒、试剂瓶外,还需要的玻璃仪器有___________ 。
③配制溶液时正确的操作顺序是:_________ (填字母,下同)
计算→称量→___________→___________→___________→___________→___________→装瓶贴标签。
a.转移 b.定容 c.摇匀 d.洗涤 e.溶解
④下列实验操作会使配制溶液浓度偏高的是___________ 。
A.容量瓶清洗后,未经过干燥处理
B.定容时,俯视刻度线
C.定容后倒转容量瓶几次,发现液面最低点低于刻度线,再补加几滴水至刻度线
D.所用碳酸钠晶体失去结晶水
(1)已知在太阳光作用下,绿色植物体内的叶绿素能将水、CO2转化为葡萄糖。海水吸收CO2并进行碳循环的原理示意图如下:
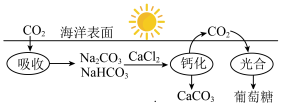
| A.CO2是碱性氧化物 |
| B.等质量的NaHCO3和Na2CO3分别与足量的盐酸反应,前者产生的二氧化碳气体较多 |
C.碳酸氢钠的电离方程式为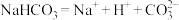 |
| D.该循环过程中未涉及氧化还原反应 |
(2)某同学欲用碳酸钠晶体(
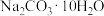 )配制220mL1mol/L的Na2CO3溶液。
)配制220mL1mol/L的Na2CO3溶液。①所需
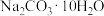 的质量为
的质量为②实验中除需要托盘天平(带砝码)、药匙、量筒、烧杯、玻璃棒、试剂瓶外,还需要的玻璃仪器有
③配制溶液时正确的操作顺序是:
计算→称量→___________→___________→___________→___________→___________→装瓶贴标签。
a.转移 b.定容 c.摇匀 d.洗涤 e.溶解
④下列实验操作会使配制溶液浓度偏高的是
A.容量瓶清洗后,未经过干燥处理
B.定容时,俯视刻度线
C.定容后倒转容量瓶几次,发现液面最低点低于刻度线,再补加几滴水至刻度线
D.所用碳酸钠晶体失去结晶水
您最近一年使用:0次
2024-01-25更新
|
58次组卷
|
2卷引用:陕西省汉中市汉台区2023-2024学年高一上学期1月期末化学试题
解题方法
5 .  和
和 的性质存在差异,为进一步探究其性质,请根据某实验小组的实验探究回答有关问题。
的性质存在差异,为进一步探究其性质,请根据某实验小组的实验探究回答有关问题。
(1)分别将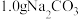 和
和 的固体加入50mL盛有10mL蒸馏水的烧杯中,测定烧杯中溶液的温度变化如下图所示。溶解时吸收热量的物质是
的固体加入50mL盛有10mL蒸馏水的烧杯中,测定烧杯中溶液的温度变化如下图所示。溶解时吸收热量的物质是_____ (填化学式)。

(2)如下图所示,分别向盛有10mL澄清石灰水的烧杯中加入蒸馏水和等浓度的 、
、 溶液,利用传感器测得溶液pH与加入试剂体积的变化曲线如下图所示。滴加
溶液,利用传感器测得溶液pH与加入试剂体积的变化曲线如下图所示。滴加 溶液的烧杯中
溶液的烧杯中 未参与该反应的实验证据是
未参与该反应的实验证据是_____ ;滴加 溶液的烧杯中开始时发生反应的离子方程式为
溶液的烧杯中开始时发生反应的离子方程式为_____ 。(提示:溶液pH越小, 的浓度越小,溶液碱性越弱。)
的浓度越小,溶液碱性越弱。)

(3)某 固体样品中含有
固体样品中含有 杂质,某小组拟通过下列装置测定
杂质,某小组拟通过下列装置测定 的质量来计算样品中
的质量来计算样品中 的含量,装置的连接顺序为
的含量,装置的连接顺序为_____ (每个装置仅使用一次);经分析,上述方案仍存在缺陷,会导致测定结果_____ 。(填“偏大”或“偏小”)
 和
和 的性质存在差异,为进一步探究其性质,请根据某实验小组的实验探究回答有关问题。
的性质存在差异,为进一步探究其性质,请根据某实验小组的实验探究回答有关问题。(1)分别将
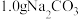 和
和 的固体加入50mL盛有10mL蒸馏水的烧杯中,测定烧杯中溶液的温度变化如下图所示。溶解时吸收热量的物质是
的固体加入50mL盛有10mL蒸馏水的烧杯中,测定烧杯中溶液的温度变化如下图所示。溶解时吸收热量的物质是
(2)如下图所示,分别向盛有10mL澄清石灰水的烧杯中加入蒸馏水和等浓度的
 、
、 溶液,利用传感器测得溶液pH与加入试剂体积的变化曲线如下图所示。滴加
溶液,利用传感器测得溶液pH与加入试剂体积的变化曲线如下图所示。滴加 溶液的烧杯中
溶液的烧杯中 未参与该反应的实验证据是
未参与该反应的实验证据是 溶液的烧杯中开始时发生反应的离子方程式为
溶液的烧杯中开始时发生反应的离子方程式为 的浓度越小,溶液碱性越弱。)
的浓度越小,溶液碱性越弱。)
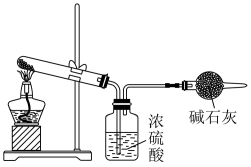
(3)某
 固体样品中含有
固体样品中含有 杂质,某小组拟通过下列装置测定
杂质,某小组拟通过下列装置测定 的质量来计算样品中
的质量来计算样品中 的含量,装置的连接顺序为
的含量,装置的连接顺序为
您最近一年使用:0次
6 . 烧碱、纯碱等都是重要的化工原料。
(1)利用如图装置可以证明二氧化碳与烧碱溶液发生了反应。

①若将A与B连接,打开止水夹,将胶头滴管中的液体挤入烧瓶,此时的实验现象是_______ 。
②若其他操作不变,将A与C连接,可观察到的现象是_______ 。
(2)向含4gNaOH的烧碱溶液中通入一定量CO2充分反应后,将溶液在低温下蒸干得到白色固体X,X的组成可能有四种情况,按出现的先后顺序分别是I.NaOH、Na2CO3;II._______ ;III.Na2CO3、NaHCO3;IV._______ 。
①常温下,将得到的固体X重新溶于水,在所得溶液中加入盐酸,使溶液的pH=7,再将溶液蒸干,得到固体的质量为____ g。
②若要验证白色固体X是第I种组成,依次加入的试剂为____ (填字母,下同)。
a.盐酸 b.MgCl2溶液 c.BaCl2溶液 d.Ba(OH)2溶液
在验证的过程中,一定需要进行的操作是_______ 。
a.洗气 b.洗涤 c.过滤 d.分馏
③若白色固体X为第III种组成,下列实验方案中不能准确测定其中NaHCO3质量分数的是_______ 。
a.取mgX与足量Ba(OH)2溶液充分反应,过滤,洗涤,烘干得ng固体
b.取mgX与足量盐酸充分反应,加热,蒸干,灼烧得ng固体
c.取mgX充分加热,减重ng
d.取mgX与足量稀硫酸充分反应,逸出的气体被足量碱石灰吸收,增重ng
④若白色固体X的质量为7.0g,则X的组成为_______ (填“I”“II”“III”或“IV”)。
(1)利用如图装置可以证明二氧化碳与烧碱溶液发生了反应。

①若将A与B连接,打开止水夹,将胶头滴管中的液体挤入烧瓶,此时的实验现象是
②若其他操作不变,将A与C连接,可观察到的现象是
(2)向含4gNaOH的烧碱溶液中通入一定量CO2充分反应后,将溶液在低温下蒸干得到白色固体X,X的组成可能有四种情况,按出现的先后顺序分别是I.NaOH、Na2CO3;II.
①常温下,将得到的固体X重新溶于水,在所得溶液中加入盐酸,使溶液的pH=7,再将溶液蒸干,得到固体的质量为
②若要验证白色固体X是第I种组成,依次加入的试剂为
a.盐酸 b.MgCl2溶液 c.BaCl2溶液 d.Ba(OH)2溶液
在验证的过程中,一定需要进行的操作是
a.洗气 b.洗涤 c.过滤 d.分馏
③若白色固体X为第III种组成,下列实验方案中不能准确测定其中NaHCO3质量分数的是
a.取mgX与足量Ba(OH)2溶液充分反应,过滤,洗涤,烘干得ng固体
b.取mgX与足量盐酸充分反应,加热,蒸干,灼烧得ng固体
c.取mgX充分加热,减重ng
d.取mgX与足量稀硫酸充分反应,逸出的气体被足量碱石灰吸收,增重ng
④若白色固体X的质量为7.0g,则X的组成为
您最近一年使用:0次
解题方法
7 . I.为比较Na2CO3和NaHCO3的热稳定性,某同学设计了如下实验装置。实验时,先检查装置的气密性,再取少量Na2CO3粉末加在大试管的底部,另取少量NaHCO3粉末加在小试管底部。预热后在大试管底部加热。

回答下列问题:
(1)开始加热一段时间后,试管___________ (填“A”或“B”)中会出现浑浊现象。
(2)实验现象证明,加热条件下,Na2CO3比NaHCO3更___________ (填“稳定”或“不稳定”)。
II.为确定碳酸钠和碳酸氢钠混合样品中碳酸钠的质量分数,可通过加热分解得到的CO2质量进行计算,某同学设计的实验装置示意图如下,请回答:

(1)仪器a的名称是___________ 。
(2)装置B中冰水的作用是___________ 。
(3)该同学设计的实验装置存在缺陷,有关该实验装置及实验过程中,下列因素可能使碳酸钠的质量分数偏高的是___________ 。
A.样品分解不完全
B.装置B、C之间缺少CO2的干燥装置
C.产生CO2气体的速率太快,没有被碱石灰完全吸收
D.反应完全后停止加热,通入过量的空气

回答下列问题:
(1)开始加热一段时间后,试管
(2)实验现象证明,加热条件下,Na2CO3比NaHCO3更
II.为确定碳酸钠和碳酸氢钠混合样品中碳酸钠的质量分数,可通过加热分解得到的CO2质量进行计算,某同学设计的实验装置示意图如下,请回答:

(1)仪器a的名称是
(2)装置B中冰水的作用是
(3)该同学设计的实验装置存在缺陷,有关该实验装置及实验过程中,下列因素可能使碳酸钠的质量分数偏高的是
A.样品分解不完全
B.装置B、C之间缺少CO2的干燥装置
C.产生CO2气体的速率太快,没有被碱石灰完全吸收
D.反应完全后停止加热,通入过量的空气
您最近一年使用:0次
2021-05-26更新
|
830次组卷
|
5卷引用:浙江省嘉兴市第五高级中学2020-2021学年高一下学期期中考试化学试题
浙江省嘉兴市第五高级中学2020-2021学年高一下学期期中考试化学试题(已下线)2.1.2 钠盐及其焰色试验-2021-2022学年高一化学课后培优练(人教版2019必修第一册)(已下线)周末培优2 有关钠和氯的实验题-2021-2022学年高一化学课后培优练(人教版2019必修第一册)第2章第一节第3课时碳酸钠和碳酸氢钠(课后)——课前、课中、课后同步专题精编(人教版2019必修第一册)浙江省嘉兴市第五高级中学2021-2022学年高一上学期期中考试化学试题
名校
8 . 为确定碳酸钠和碳酸氢钠混合样品中碳酸钠的质量分数,可通过加热分解得到的CO2质量进行计算,某同学设计的实验装置示意图如下,则下列说法正确的是


| A.X气体可以是空气,反应前和反应后均需通一段时间空气 |
| B.装置B、C之间缺少CO2的干燥装置 |
| C.没有a装置会导致所测碳酸钠的质量分数偏高 |
| D.a装置内应装碱石灰,目的是为了尾气处理 |
您最近一年使用:0次
名校
解题方法
9 . 已知某固体样品中含有 、
、 中的一种或两种,下列说法正确的是
中的一种或两种,下列说法正确的是
 、
、 中的一种或两种,下列说法正确的是
中的一种或两种,下列说法正确的是
A.取适量样品配成溶液,滴加1滴酚酞溶液,若溶液变红,则样品中只含有 |
B.取样在试管中加热,将可能产生的气体全部通入澄清石灰水,若最终仍为澄清溶液,则样品中不含 |
C.取一定量的样品,利用如图所示装置测定样品中 的含量,若球形干燥管增重4.4g,则所取样品中含有0.1mol 的含量,若球形干燥管增重4.4g,则所取样品中含有0.1mol  |
D.已知固体样品同时含有 和 和 。现取一定质量的样品配成溶液,滴加 。现取一定质量的样品配成溶液,滴加 溶液至沉淀完全,根据白色沉淀的质量可求出 溶液至沉淀完全,根据白色沉淀的质量可求出 的含量 的含量 |
您最近一年使用:0次
2021-11-22更新
|
361次组卷
|
2卷引用:广东省广雅中学2021-2022学年高一上学期期中考试化学试题
名校
10 . Na2CO3、NaHCO3是生活中常见的盐,某实验小组通过以下实验了探究这两种物质的性质。
(1)称取两种固体各1g分别放入两支试管中,再各加入5mL水,充分振荡,并恢复至室温。发现Na2CO3完全溶解,而NaHCO3有剩余。由此得出结论:在相同温度下,________ 。
(2)①取少量NaHCO3按下图装置进行实验。可观察到的现象是:大试管口有水珠生成,____________ 。

②用______________ 的方法除去混在Na2CO3粉末中少量的NaHCO3。
(3)测定Na2CO3样品(含氯化钠杂质)中Na2CO3的质量分数:
①称取mg样品放入烧杯内加水溶解。
②加入过量的氯化钙溶液充分反应,反应的化学方程式为_________________ 。
③过滤、洗涤、干燥,称量沉淀的质量为ng。则样品中Na2CO3的质量分数为______ 。
(1)称取两种固体各1g分别放入两支试管中,再各加入5mL水,充分振荡,并恢复至室温。发现Na2CO3完全溶解,而NaHCO3有剩余。由此得出结论:在相同温度下,
(2)①取少量NaHCO3按下图装置进行实验。可观察到的现象是:大试管口有水珠生成,

②用
(3)测定Na2CO3样品(含氯化钠杂质)中Na2CO3的质量分数:
①称取mg样品放入烧杯内加水溶解。
②加入过量的氯化钙溶液充分反应,反应的化学方程式为
③过滤、洗涤、干燥,称量沉淀的质量为ng。则样品中Na2CO3的质量分数为
您最近一年使用:0次
2018-12-31更新
|
615次组卷
|
6卷引用:【全国百强校】云南省玉溪市第一中学2018-2019学年高一上学期第一次月考化学试题



