名校
解题方法
1 . Na2CO3和NaHCO3是两种重要的化工原料,二者的性质存在差异,为进一步探究其性质,请根据某实验小组的实验探究回答有关问题。
(1)分别将1.0g Na2CO3和NaHCO3的固体加入50mL盛有10mL蒸馏水的烧杯中,测定烧杯中溶液的温度变化如图所示。则曲线②代表的物质是(填化学式)______ 。
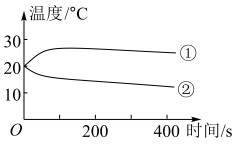
(2)如下图所示,分别向盛有10mL澄清石灰水的烧杯中加入蒸馏水和等浓度的Na2CO3、NaHCO3溶液,利用传感器测得溶液pH与加入试剂体积的变化曲线如下图所示。滴加Na2CO3溶液的烧杯中OH-未参与该反应的实验证据是___________ ;滴加NaHCO3溶液的烧杯中开始时发生反应的离子方程式为:___________ 。(提示:溶液pH越小,OH-的浓度越小,溶液碱性越弱。)

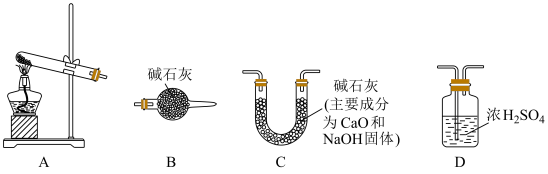
(3)某NaHCO3固体样品中含有Na2CO3杂质,某小组拟通过下列装置(气密性良好)测定CO2的质量来计算样品中NaHCO3的含量,装置的连接顺序为___→___→___→ B (每个装置仅使用一次),_____ 。经分析,上述方案存在缺陷(假定固体充分反应),会导致测定结果偏小,原因可能为:________ 。利用改进装置进行实验,ag样品加热至恒重后,称量所得固体质量为bg,则样品中NaHCO3质量分数为____ %(用含a、b的代数式表示)。
(1)分别将1.0g Na2CO3和NaHCO3的固体加入50mL盛有10mL蒸馏水的烧杯中,测定烧杯中溶液的温度变化如图所示。则曲线②代表的物质是(填化学式)

(2)如下图所示,分别向盛有10mL澄清石灰水的烧杯中加入蒸馏水和等浓度的Na2CO3、NaHCO3溶液,利用传感器测得溶液pH与加入试剂体积的变化曲线如下图所示。滴加Na2CO3溶液的烧杯中OH-未参与该反应的实验证据是

(3)某NaHCO3固体样品中含有Na2CO3杂质,某小组拟通过下列装置(气密性良好)测定CO2的质量来计算样品中NaHCO3的含量,装置的连接顺序为___→___→___→ B (每个装置仅使用一次),

您最近半年使用:0次
名校
解题方法
2 . Ⅰ.现代工业常以氯化钠为原料制备纯碱,部分工艺流程如图:已知 在低温下溶解度较小。
在低温下溶解度较小。
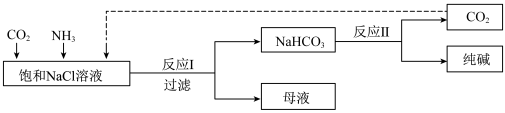
(1)一定温度下,往一定量饱和NaCl溶液中先通入___________ 达到饱和后,再不断通入另一种气体,一段时间后,出现沉淀,过滤得到 晶体。
晶体。
(2)得到的 晶体中可能含有少量NaCl、
晶体中可能含有少量NaCl、 等杂质,检验该晶体中是否含有氯离子杂质的操作方法是
等杂质,检验该晶体中是否含有氯离子杂质的操作方法是___________ 。
(3) 和
和 是两种常见的钠盐,
是两种常见的钠盐, 和
和 溶于水溶液均显
溶于水溶液均显___________ (填“酸性”、“中性”或“碱性”)。写出向饱和碳酸钠溶液中通入 的离子方程式
的离子方程式___________ 。
Ⅱ.工业纯碱中常含有少量NaCl,某校化学课外活动小组设计如图所示装置,测定工业纯碱中 的含量。
的含量。
(4)检验装置B气密性的方法是:塞紧带长颈漏斗的三孔橡胶塞,夹紧两侧弹簧夹后,从漏斗注入一定量的水,使漏斗内的水面高于瓶内的水面,停止加水后,若___________ ,说明装置不漏气。
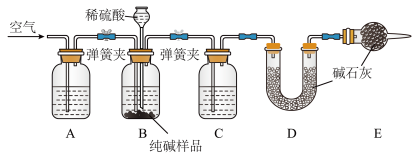
(5)装置A中的试剂为___________ ,装置C中的试剂为___________ 。
(6)实验前称取28.80g样品,实验后测得D装置增重8.80g,则样品中 的质量分数为
的质量分数为___________ (保留小数点后一位):若缺少E装置,会使测定结果___________ (填“偏高”或“偏低”)。
 在低温下溶解度较小。
在低温下溶解度较小。
(1)一定温度下,往一定量饱和NaCl溶液中先通入
 晶体。
晶体。(2)得到的
 晶体中可能含有少量NaCl、
晶体中可能含有少量NaCl、 等杂质,检验该晶体中是否含有氯离子杂质的操作方法是
等杂质,检验该晶体中是否含有氯离子杂质的操作方法是(3)
 和
和 是两种常见的钠盐,
是两种常见的钠盐, 和
和 溶于水溶液均显
溶于水溶液均显 的离子方程式
的离子方程式Ⅱ.工业纯碱中常含有少量NaCl,某校化学课外活动小组设计如图所示装置,测定工业纯碱中
 的含量。
的含量。(4)检验装置B气密性的方法是:塞紧带长颈漏斗的三孔橡胶塞,夹紧两侧弹簧夹后,从漏斗注入一定量的水,使漏斗内的水面高于瓶内的水面,停止加水后,若

(5)装置A中的试剂为
(6)实验前称取28.80g样品,实验后测得D装置增重8.80g,则样品中
 的质量分数为
的质量分数为
您最近半年使用:0次
2023-12-03更新
|
76次组卷
|
2卷引用:陕西省西安市碑林区教育局2023-2024学年高一上学期期中教育质量监测化学试题
解题方法
3 . 课外兴趣小组的同学探究Na2CO3和NaHCO3的性质,并测定混合物中NaHCO3的含量。
实验一:Na2CO3和NaHCO3溶解性与碱性的比较
(1)室温下,Na2CO3的溶解度大于NaHCO3的实验证据是_____________ 。
(2)该实验_____________ (填“能”或“不能”)说明Na2CO3溶液的碱性强于NaHCO3溶液,理由是_____________ 。
实验二:Na2CO3和NaHCO3与澄清石灰水反应的比较
查阅资料:可以用pH表示溶液酸碱性的强弱。常温下,pH<7,溶液为酸性;pH=7,溶液为中性;pH>7,溶液为碱性。pH越小,c(OH-)越小,溶液碱性越弱。
(3)上述实验中,向澄清石灰水中滴加Na2CO3溶液,OH-未参与该反应的实验证据是_____________ 。
(4)滴加NaHCO3溶液的pH变化与滴加Na2CO3溶液的有明显差异,结合离子方程式说明原因:_____________ 。
实验三:Na2CO3和NaHCO3混合物(不考虑其他杂质)中NaHCO3质量分数的测定
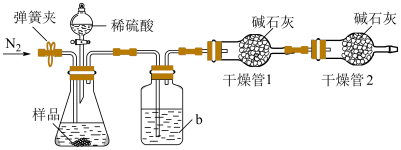
实验装置如图所示。称取19.0g待测样品于锥形瓶中,反应前先打开弹簧夹,通入一段时间的N2,然后关闭弹簧夹,接上总质量为200.0g的干燥管1,再接上干燥管2,打开分液漏斗的活塞,滴加稀硫酸进行反应。待锥形瓶中不再有气泡产生,关闭分液漏斗的活塞,打开弹簧夹,再通入一段时间的N2,最后取下干燥管1,称得其质量为208.8g。
(5)①洗气瓶中盛放的液体是_________________ (填名称)。
②第一次通入N2的目的是_________________ 。第二次通入N2的目的是_________________ 。如果没有进行第一次通N2的操作,测量的结果将会_________________ (填“偏大”“偏小”或“不变”)。
③计算出混合物中NaHCO3的质量分数为_________________ %(保留1位小数)。
实验一:Na2CO3和NaHCO3溶解性与碱性的比较
| 序号 | 实验操作 | 实验现象 | |
| ① | 在两支试管中分别加入1gNa2CO3、NaHCO3,再加入5mL水,充分振荡;用温度计测量两试管中溶液温度的变化 | Na2CO3 | NaHCO3 |
| 温度由17.6℃变为23.2℃;放置到室温时,试管内无固体 | 温度由17.6℃变为17.2℃;放置到室温时,试管内有少量固体残留 | ||
| ② | 室温时,分别向①所得溶液中滴入2滴酚酞溶液 | 溶液变红 | 溶液变微红 |
(1)室温下,Na2CO3的溶解度大于NaHCO3的实验证据是
(2)该实验
实验二:Na2CO3和NaHCO3与澄清石灰水反应的比较
查阅资料:可以用pH表示溶液酸碱性的强弱。常温下,pH<7,溶液为酸性;pH=7,溶液为中性;pH>7,溶液为碱性。pH越小,c(OH-)越小,溶液碱性越弱。
| 实验操作 | 实验数据 |
测量如下实验过程的pH变化 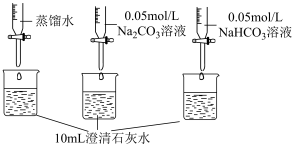 | 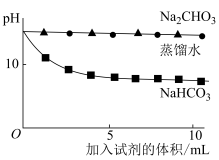 |
(3)上述实验中,向澄清石灰水中滴加Na2CO3溶液,OH-未参与该反应的实验证据是
(4)滴加NaHCO3溶液的pH变化与滴加Na2CO3溶液的有明显差异,结合离子方程式说明原因:
实验三:Na2CO3和NaHCO3混合物(不考虑其他杂质)中NaHCO3质量分数的测定

实验装置如图所示。称取19.0g待测样品于锥形瓶中,反应前先打开弹簧夹,通入一段时间的N2,然后关闭弹簧夹,接上总质量为200.0g的干燥管1,再接上干燥管2,打开分液漏斗的活塞,滴加稀硫酸进行反应。待锥形瓶中不再有气泡产生,关闭分液漏斗的活塞,打开弹簧夹,再通入一段时间的N2,最后取下干燥管1,称得其质量为208.8g。
(5)①洗气瓶中盛放的液体是
②第一次通入N2的目的是
③计算出混合物中NaHCO3的质量分数为
您最近半年使用:0次
解题方法
4 . 课外兴趣小组的同学探究 和
和 性质,并测定混合物中
性质,并测定混合物中 的含量。
的含量。
【实验一】
(1)室温下, 的溶解度大于
的溶解度大于 的实验证据是
的实验证据是___________ 。
(2)该实验___________ (填能或不能)说明 溶液的碱性强于
溶液的碱性强于 溶液,理由是
溶液,理由是___________ 。
【实验二】资料:pH越小,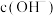 越小,溶液碱性越弱。
越小,溶液碱性越弱。
(3)实验二中,向澄清石灰水滴加 溶液,
溶液, 未参与该反应的实验证据是
未参与该反应的实验证据是___________ 。
(4)实验二中,滴加 溶液的pH变化与滴加
溶液的pH变化与滴加 溶液的有明显差异,结合离子方程式说明原因
溶液的有明显差异,结合离子方程式说明原因___________ 。
(5)为测定 和
和 混合物中
混合物中 的质量分数,同学们进行了以下实验:
的质量分数,同学们进行了以下实验:
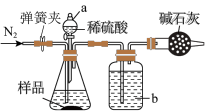
上图所示装置进行测定。称取一定质量的待测样品于锥形瓶中,反应前先打开弹簧夹,通入一段时间的 ,然后关闭弹簧夹,接上总质量为mg的干燥管,再打开分液漏斗的活塞,滴加稀硫酸进行反应。待锥形瓶中不再有气泡产生,关闭分液漏斗a的活塞,打开弹簧夹,再通入一段时间的
,然后关闭弹簧夹,接上总质量为mg的干燥管,再打开分液漏斗的活塞,滴加稀硫酸进行反应。待锥形瓶中不再有气泡产生,关闭分液漏斗a的活塞,打开弹簧夹,再通入一段时间的 ,然后取下干燥管称得其质量为ng。
,然后取下干燥管称得其质量为ng。
①洗气瓶b中盛放的液体是___________ (写名称)。
②第一次通入 的目的是
的目的是___________ 。第二次通入 的目的是
的目的是___________ 。如果没有进行第一次通 操作,测量的结果将会
操作,测量的结果将会___________ (填“偏大”“偏小”或“不变”)。
③实验装置中存在一不合理之处,会导致测定结果出现误差。如何改进?___________ 。
 和
和 性质,并测定混合物中
性质,并测定混合物中 的含量。
的含量。【实验一】
| 序号 | 操作 |  |  |
| ① | 在两支试管中分别加入 、 、 ,再加入5mL水,充分振荡;将两支温度计分别插入试管中 ,再加入5mL水,充分振荡;将两支温度计分别插入试管中 | 温度由17.6℃变为23.2℃;放置到室温时,试管内无固体 | 温度由17.6℃变为17.2℃;放置到室温时,试管内有少量固体残留 |
| ② | 室温时,分别向①所得溶液中滴入2滴溶液 | 溶液变红 | 溶液微红 |
 的溶解度大于
的溶解度大于 的实验证据是
的实验证据是(2)该实验
 溶液的碱性强于
溶液的碱性强于 溶液,理由是
溶液,理由是【实验二】资料:pH越小,
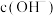 越小,溶液碱性越弱。
越小,溶液碱性越弱。| 实验操作 | 实验数据 |
测量下述实验过程的pH变化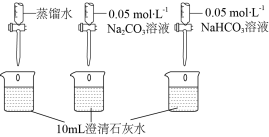 | 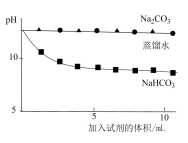 |
 溶液,
溶液, 未参与该反应的实验证据是
未参与该反应的实验证据是(4)实验二中,滴加
 溶液的pH变化与滴加
溶液的pH变化与滴加 溶液的有明显差异,结合离子方程式说明原因
溶液的有明显差异,结合离子方程式说明原因(5)为测定
 和
和 混合物中
混合物中 的质量分数,同学们进行了以下实验:
的质量分数,同学们进行了以下实验: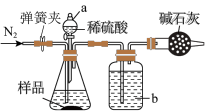
上图所示装置进行测定。称取一定质量的待测样品于锥形瓶中,反应前先打开弹簧夹,通入一段时间的
 ,然后关闭弹簧夹,接上总质量为mg的干燥管,再打开分液漏斗的活塞,滴加稀硫酸进行反应。待锥形瓶中不再有气泡产生,关闭分液漏斗a的活塞,打开弹簧夹,再通入一段时间的
,然后关闭弹簧夹,接上总质量为mg的干燥管,再打开分液漏斗的活塞,滴加稀硫酸进行反应。待锥形瓶中不再有气泡产生,关闭分液漏斗a的活塞,打开弹簧夹,再通入一段时间的 ,然后取下干燥管称得其质量为ng。
,然后取下干燥管称得其质量为ng。①洗气瓶b中盛放的液体是
②第一次通入
 的目的是
的目的是 的目的是
的目的是 操作,测量的结果将会
操作,测量的结果将会③实验装置中存在一不合理之处,会导致测定结果出现误差。如何改进?
您最近半年使用:0次
5 . 碳酸钠和碳酸氢钠是生活中比较常见的两种物质。某学校的课外化学学习兴趣小组对两者性质进行探究,并测定碳酸钠和碳酸氢钠混合物中各成分的含量。
实验I:
(1)取两支试管分别加入各约1g的碳酸钠和碳酸氢钠固体,再分别加入几滴水振荡试管,用手触摸试管底部,温度较高的是_______ (填化学式,下同)。
(2)继续向两支试管中分别加入10mL水,充分振荡,最先溶解完全的是_______ ;再分别加入几滴酚酞试液,溶液变红,但颜色较浅的是_______ 。
实验II:碳酸钠和碳酸氢钠的热稳定性比较探究
(3)按图1组装好仪器(A为大试管,B为小试管)后,接下来的操作是_______ ,再往试管中添加药品,则试管A中盛放的药品是_______ ,澄清石灰水变浑浊的是_______ (填“a”或“b”)。
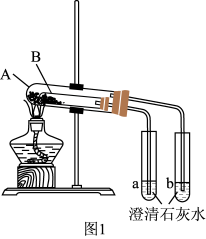
实验III:混合物中碳酸钠含量的测定
(4)为确定碳酸钠和碳酸氢钠混合物样品的组成,甲化学探究小组设计实验1:利用如图2所示的装置进行实验。
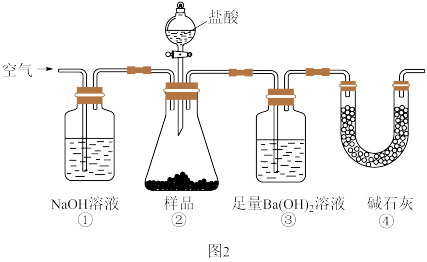
下列说法错误的是_______(填字母,单选)。
(5)乙化学探究小组设计实验2:取ag样品加热、冷却、称重,重复以上操作至样品固体质量不再变化,称量其质量为bg。样品中 质量分数为
质量分数为_______ ×100%(用a、b表示)。
(6)丙化学探究小组设计实验3:步骤ⅰ。称取一定量的混合物样品;步骤ⅱ。向其中逐滴滴入0.1000mol/L稀盐酸,记录生成的气体体积和滴入盐酸体积,如图3所示。
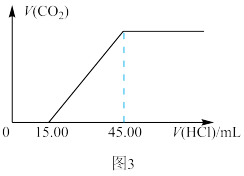
计算:①生成的 在标况下的体积为
在标况下的体积为_______ mL;
②该混合物中 的质量分数
的质量分数_______ %(保留两位小数)。
实验I:
(1)取两支试管分别加入各约1g的碳酸钠和碳酸氢钠固体,再分别加入几滴水振荡试管,用手触摸试管底部,温度较高的是
(2)继续向两支试管中分别加入10mL水,充分振荡,最先溶解完全的是
实验II:碳酸钠和碳酸氢钠的热稳定性比较探究
(3)按图1组装好仪器(A为大试管,B为小试管)后,接下来的操作是

实验III:混合物中碳酸钠含量的测定
(4)为确定碳酸钠和碳酸氢钠混合物样品的组成,甲化学探究小组设计实验1:利用如图2所示的装置进行实验。

下列说法错误的是_______(填字母,单选)。
A.滴入盐酸前,应先将装置中含有 的空气排尽 的空气排尽 |
B.装置①、④的作用是防止空气中的 进入装置③中 进入装置③中 |
C.在装置②、③间需添加盛有饱和 溶液的洗气瓶,以除去挥发的HCl气体 溶液的洗气瓶,以除去挥发的HCl气体 |
D.反应结束时,应继续通入空气将装置②中的 转移到装置③中 转移到装置③中 |
 质量分数为
质量分数为(6)丙化学探究小组设计实验3:步骤ⅰ。称取一定量的混合物样品;步骤ⅱ。向其中逐滴滴入0.1000mol/L稀盐酸,记录生成的气体体积和滴入盐酸体积,如图3所示。

计算:①生成的
 在标况下的体积为
在标况下的体积为②该混合物中
 的质量分数
的质量分数
您最近半年使用:0次
2022高三·全国·专题练习
名校
6 . 为了测定NaCl、Na2CO3•10H2O和NaHCO3的混合物中各组分的含量,某同学设计如图实验:取一定质量的混合物,通过测量反应前后②和③装置质量的变化,测定该混合物中各组分的质量分数。下列说法错误的是
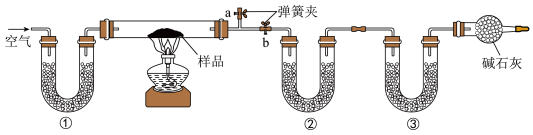

| A.①、②、③中可以依次盛装碱石灰、无水CaCl2、碱石灰 |
| B.若将①装置换成盛放NaOH溶液的洗气瓶,则测得的NaCl含量偏小 |
| C.硬质玻璃管加热前,应关闭b,打开a,缓缓通入空气,直至a处出来的空气不再使澄清石灰水变浑浊为止 |
| D.实验过程中先停止通入空气,再停止加热 |
您最近半年使用:0次
名校
7 . Na2CO3和NaHCO3是生活中比较常见的两种物质。某学校的课外化学学习兴趣小组 对两者性质进行探究,并测定碳酸钠和碳酸氢钠混合物中各成分的含量。
实验I :
(1)取两支试管分别加入各约1 g的碳酸钠和碳酸氢钠固体,再分别加入几滴水振荡 试管,用手触摸试管底部,温度较高的是_______ (填化学式,下同)。
(2)继续向两支试管中分别加入10 mL水,充分振荡,最先溶解完全的是_______ ;再分别加入几滴酚猷试液,溶液变红,但颜色较浅的是_______ 。
实验II:碳酸钠和碳酸氢钠的热稳定性比较探究
(3)按图1组装好仪器(A为大试管,B为小试管)后, 接下来的操作是_______ ,试管A中盛放的药品是_______ ,澄清石灰水变混浊的是_______ (填“a”或“b”),写出澄清石灰水变混浊的离子反应方程式_______ ,当实验结束时应当先 _______ (填操作)。
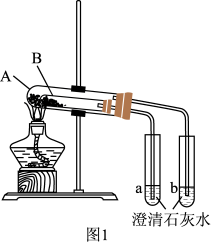
实验III:混合物中碳酸钠含量的测定
(4)按图2组装好仪器,检查装置气密性良好,称取3.00 g碳酸钠和碳酸氢钠的混合物,充分加热反应至恒重,称量剩余固体质量为2.38 g,则该混合物中碳酸钠的质量分数为_______ 。有同学提出:也可以利用澄清石灰水中生成的沉淀质量计算碳酸钠的含量,但是计算发现测量值明显偏大,可能的原因是_______ 。

实验I :
(1)取两支试管分别加入各约1 g的碳酸钠和碳酸氢钠固体,再分别加入几滴水振荡 试管,用手触摸试管底部,温度较高的是
(2)继续向两支试管中分别加入10 mL水,充分振荡,最先溶解完全的是
实验II:碳酸钠和碳酸氢钠的热稳定性比较探究
(3)按图1组装好仪器(A为大试管,B为小试管)后, 接下来的操作是

实验III:混合物中碳酸钠含量的测定
(4)按图2组装好仪器,检查装置气密性良好,称取3.00 g碳酸钠和碳酸氢钠的混合物,充分加热反应至恒重,称量剩余固体质量为2.38 g,则该混合物中碳酸钠的质量分数为

您最近半年使用:0次
解题方法
8 . 某同学在实验室对钠的化合物相关样品进行定性、定量研究:
(1)实验1:某纯碱样品只含NaCl杂质,现测定样品中 的含量。称取样品ag,采用如图实验装置进行实验:
的含量。称取样品ag,采用如图实验装置进行实验:

①写出Y形管中稀硫酸与样品发生反应的离子方程式:___________ 。
②试剂X最佳选择是___________ (填标号)。
A.饱和 溶液 B.饱和
溶液 B.饱和 溶液 C.饱和NaCl溶液
溶液 C.饱和NaCl溶液
③读数时,若水准管的液面高于量气管的液面,则样品中 的含量
的含量___________ (填“偏高”、“偏低”或“不影响”)。
④实验结束时,所测得气体体积为V mL。设实验时的气体摩尔体积为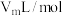 ,则样品中
,则样品中 的质量分数为
的质量分数为___________ 。
(2)实验Ⅱ:碳酸钠和碳酸氢钠稳定性探究。

①上图实验中试剂A和试剂B分别是___________ 、___________ 。
②试管中受热处发生反应的化学方程式:___________ 。
(3)实验Ⅲ:若加热 和
和 的混合物,剩余固体成分会因二者物质的量不同而发生变化。当
的混合物,剩余固体成分会因二者物质的量不同而发生变化。当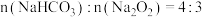 混合后,加热使其充分反应,试管内剩余固体为
混合后,加热使其充分反应,试管内剩余固体为 和NaOH,两者物质的量之比是
和NaOH,两者物质的量之比是___________ 。
(1)实验1:某纯碱样品只含NaCl杂质,现测定样品中
 的含量。称取样品ag,采用如图实验装置进行实验:
的含量。称取样品ag,采用如图实验装置进行实验:
①写出Y形管中稀硫酸与样品发生反应的离子方程式:
②试剂X最佳选择是
A.饱和
 溶液 B.饱和
溶液 B.饱和 溶液 C.饱和NaCl溶液
溶液 C.饱和NaCl溶液③读数时,若水准管的液面高于量气管的液面,则样品中
 的含量
的含量④实验结束时,所测得气体体积为V mL。设实验时的气体摩尔体积为
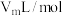 ,则样品中
,则样品中 的质量分数为
的质量分数为(2)实验Ⅱ:碳酸钠和碳酸氢钠稳定性探究。

①上图实验中试剂A和试剂B分别是
②试管中受热处发生反应的化学方程式:
(3)实验Ⅲ:若加热
 和
和 的混合物,剩余固体成分会因二者物质的量不同而发生变化。当
的混合物,剩余固体成分会因二者物质的量不同而发生变化。当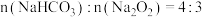 混合后,加热使其充分反应,试管内剩余固体为
混合后,加热使其充分反应,试管内剩余固体为 和NaOH,两者物质的量之比是
和NaOH,两者物质的量之比是
您最近半年使用:0次
解题方法
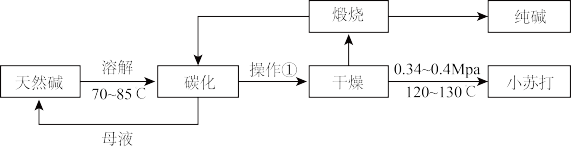
9 . Na2CO3和NaHCO3是重要的无机化工产品,广泛应用于食品、化工、医药等领域。如图是利用天然碱(主要成分为Na2CO3、NaHCO3和少量NaCl)制备Na2CO3和NaHCO3的工艺流程。
完成下列填空:
(1)操作①为___ 。
(2)碳化装置中反应的离子方程式___ 。
(3)解释选择0.34~0.4MPa干燥的原因___ 。
(4)对比索尔维制碱法,说明利用天然碱制碱的优势___ 。
(5)为了测定产品中小苏打中NaHCO3的含量进行以下实验。
实验步骤:
步骤一:称2.000g小苏打样品,配制小苏打溶液250mL。
步骤二:取20.00mL小苏打溶液置于锥形瓶中,用0.1000mol·L-1盐酸滴定,溶液pH随盐酸体积变化如图所示。

完成下列填空:
①取20.00mL小苏打溶液需要使用的定量仪器名称____ 。
②根据滴定曲线分析,若采用传统滴定法,应选择的指示剂是___ ,此时滴定终点的现象为___ 。
③计算该样品中NaHCO3的质量分数为____ 。

完成下列填空:
(1)操作①为
(2)碳化装置中反应的离子方程式
(3)解释选择0.34~0.4MPa干燥的原因
(4)对比索尔维制碱法,说明利用天然碱制碱的优势
(5)为了测定产品中小苏打中NaHCO3的含量进行以下实验。
实验步骤:
步骤一:称2.000g小苏打样品,配制小苏打溶液250mL。
步骤二:取20.00mL小苏打溶液置于锥形瓶中,用0.1000mol·L-1盐酸滴定,溶液pH随盐酸体积变化如图所示。

完成下列填空:
①取20.00mL小苏打溶液需要使用的定量仪器名称
②根据滴定曲线分析,若采用传统滴定法,应选择的指示剂是
③计算该样品中NaHCO3的质量分数为
您最近半年使用:0次
名校
10 . 某纯碱样品只含NaCl杂质,为测定样品中 的含量进行如下实验。
的含量进行如下实验。
实验Ⅰ:甲小组称取样品5.00g,采用如下实验装置进行实验。实验结束时,分离③中所得固体,称其质量为7.88g。

(1)装置①的作用是___________ 。
(2)装置②中反应的离子方程式为___________ 。
(3)下列说法不正确的是___________(填标号)。
(4)样品中 的质量分数为
的质量分数为____ 。
实验Ⅱ:乙小组称取样品ag,采用如图实验装置进行实验。
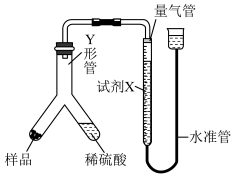
(5)试剂X应选择____ (填标号)。
A.饱和 溶液 B.饱和
溶液 B.饱和 溶液 C.饱和
溶液 C.饱和 溶液
溶液
(6)下列哪些因素会造成样品中 的含量偏低
的含量偏低___ (填标号)。
A.将稀硫酸替换为盐酸
B.读数时未冷却至室温
C.读数时水准管的液面高于量气管的液面
(7)实验结束时,所得气体体积为V mL。实验时的气体摩尔体积为 ,则样品
,则样品 的质量分数为
的质量分数为______ 。
 的含量进行如下实验。
的含量进行如下实验。实验Ⅰ:甲小组称取样品5.00g,采用如下实验装置进行实验。实验结束时,分离③中所得固体,称其质量为7.88g。

(1)装置①的作用是
(2)装置②中反应的离子方程式为
(3)下列说法不正确的是___________(填标号)。
| A.先通入空气一段时间,再滴加盐酸 |
| B.装置②、③间应增加除去HCl杂质的装置 |
| C.装置④的作用是吸收尾气,防止空气污染 |
| D.停止滴加盐酸后,还需继续通入空气一段时间 |
 的质量分数为
的质量分数为实验Ⅱ:乙小组称取样品ag,采用如图实验装置进行实验。

(5)试剂X应选择
A.饱和
 溶液 B.饱和
溶液 B.饱和 溶液 C.饱和
溶液 C.饱和 溶液
溶液(6)下列哪些因素会造成样品中
 的含量偏低
的含量偏低A.将稀硫酸替换为盐酸
B.读数时未冷却至室温
C.读数时水准管的液面高于量气管的液面
(7)实验结束时,所得气体体积为V mL。实验时的气体摩尔体积为
 ,则样品
,则样品 的质量分数为
的质量分数为
您最近半年使用:0次



