名校
1 . Na2CO3和NaHCO3是生活中比较常见的两种物质。某学校的课外化学学习兴趣小组 对两者性质进行探究,并测定碳酸钠和碳酸氢钠混合物中各成分的含量。
实验I :
(1)取两支试管分别加入各约1 g的碳酸钠和碳酸氢钠固体,再分别加入几滴水振荡 试管,用手触摸试管底部,温度较高的是_______ (填化学式,下同)。
(2)继续向两支试管中分别加入10 mL水,充分振荡,最先溶解完全的是_______ ;再分别加入几滴酚猷试液,溶液变红,但颜色较浅的是_______ 。
实验II:碳酸钠和碳酸氢钠的热稳定性比较探究
(3)按图1组装好仪器(A为大试管,B为小试管)后, 接下来的操作是_______ ,试管A中盛放的药品是_______ ,澄清石灰水变混浊的是_______ (填“a”或“b”),写出澄清石灰水变混浊的离子反应方程式_______ ,当实验结束时应当先 _______ (填操作)。
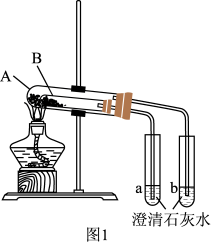
实验III:混合物中碳酸钠含量的测定
(4)按图2组装好仪器,检查装置气密性良好,称取3.00 g碳酸钠和碳酸氢钠的混合物,充分加热反应至恒重,称量剩余固体质量为2.38 g,则该混合物中碳酸钠的质量分数为_______ 。有同学提出:也可以利用澄清石灰水中生成的沉淀质量计算碳酸钠的含量,但是计算发现测量值明显偏大,可能的原因是_______ 。

实验I :
(1)取两支试管分别加入各约1 g的碳酸钠和碳酸氢钠固体,再分别加入几滴水振荡 试管,用手触摸试管底部,温度较高的是
(2)继续向两支试管中分别加入10 mL水,充分振荡,最先溶解完全的是
实验II:碳酸钠和碳酸氢钠的热稳定性比较探究
(3)按图1组装好仪器(A为大试管,B为小试管)后, 接下来的操作是

实验III:混合物中碳酸钠含量的测定
(4)按图2组装好仪器,检查装置气密性良好,称取3.00 g碳酸钠和碳酸氢钠的混合物,充分加热反应至恒重,称量剩余固体质量为2.38 g,则该混合物中碳酸钠的质量分数为

您最近一年使用:0次
名校
2 . 某实验小组同学为了鉴别碳酸钠和碳酸氢钠,进行了如下实验。

(1)实验Ⅰ—Ⅲ中能鉴别碳酸钠和碳酸氢钠的是_______ (填序号)。
(2)若将实验Ⅲ改为分别向A、B的溶液中逐滴滴加稀盐酸,其中A溶液开始无气泡产生,一段时间后产生气泡,则A为_______ (填物质名称),反应过程的离子方程式为_______ 、_______ 。
(3)若有碳酸钠和碳酸氢钠固体混合物6.48 g,为除去碳酸钠固体中的碳酸氢钠杂质,可对混合物进行加热,发生反应的化学方程式为_______ ,若将混合物加热至质量不再变化时,剩余固体质量为5.24 g,则原混合固体中碳酸钠的质量分数为_______ %(保留小数点后2位)。

(1)实验Ⅰ—Ⅲ中能鉴别碳酸钠和碳酸氢钠的是
(2)若将实验Ⅲ改为分别向A、B的溶液中逐滴滴加稀盐酸,其中A溶液开始无气泡产生,一段时间后产生气泡,则A为
(3)若有碳酸钠和碳酸氢钠固体混合物6.48 g,为除去碳酸钠固体中的碳酸氢钠杂质,可对混合物进行加热,发生反应的化学方程式为
您最近一年使用:0次
名校
解题方法
3 . (Ⅰ)某小组同学依据性质差异,采用比较的方法设计实验鉴别Na2CO3和NaHCO3。
(1)实验Ⅰ中,分别向两支试管中滴加几滴水,A中温度计示数略有降低,B中温度计示数升高。说明固体b与水作用的过程中_______ (填“放出”或“吸收”)热量,可判断固体b为Na2CO3。
(2)实验Ⅱ中,向试管C和D中分别加入5mL水,充分振荡,试管C中固体有剩余,试管D中固体完全溶解。分别向两支试管中滴加2滴酚酞,_______ 试管中红色较浅。
(3)实验Ⅲ中,分别向溶液e和溶液f中逐滴加入稀盐酸,F中开始滴加就可以观察到气泡;E中开始无气泡产生,一段时间后产生气泡。结合离子方程式解释E中开始无气泡产生的原因_______ 。
(Ⅱ)铝是地壳中含量最多的金属元素,其单质和化合物广泛应用于日常生活中。回答下列问题:
(4)可以用电镀法在钢制品上电镀铝,为测定镀层厚度,用NaOH溶液溶解钢制品表面的铝镀层,当反应消耗2mol NaOH时,所得气体的物质的量为_______ mol。
(5)如图是从铝土矿(主要成分为Al2O3,还含有少量SiO2、Fe2O3等杂质)中提取Al2O3并生产AlN的工艺流程:

①配料中属于两性氧化物的是_______
②“溶解”时,SiO2与NaOH溶液反应生成的硅酸钠与溶液中偏铝酸钠发生反应:2Na2SiO3+2NaAlO2+2H2O= Na2Al2Si2O8↓+4NaOH ,“赤泥”的主要成分为Na2Al2Si2O8和_______ (写出化学式)。
③ “酸化”时,通入过量CO2与之反应,生成滤液的主要成分是_______ (写化学式)。
实验I | 实验Ⅱ | 实验Ⅲ |
 |  |  |
(2)实验Ⅱ中,向试管C和D中分别加入5mL水,充分振荡,试管C中固体有剩余,试管D中固体完全溶解。分别向两支试管中滴加2滴酚酞,
(3)实验Ⅲ中,分别向溶液e和溶液f中逐滴加入稀盐酸,F中开始滴加就可以观察到气泡;E中开始无气泡产生,一段时间后产生气泡。结合离子方程式解释E中开始无气泡产生的原因
(Ⅱ)铝是地壳中含量最多的金属元素,其单质和化合物广泛应用于日常生活中。回答下列问题:
(4)可以用电镀法在钢制品上电镀铝,为测定镀层厚度,用NaOH溶液溶解钢制品表面的铝镀层,当反应消耗2mol NaOH时,所得气体的物质的量为
(5)如图是从铝土矿(主要成分为Al2O3,还含有少量SiO2、Fe2O3等杂质)中提取Al2O3并生产AlN的工艺流程:

①配料中属于两性氧化物的是
②“溶解”时,SiO2与NaOH溶液反应生成的硅酸钠与溶液中偏铝酸钠发生反应:2Na2SiO3+2NaAlO2+2H2O= Na2Al2Si2O8↓+4NaOH ,“赤泥”的主要成分为Na2Al2Si2O8和
③ “酸化”时,通入过量CO2与之反应,生成滤液的主要成分是
您最近一年使用:0次
名校
解题方法
4 . Ⅰ.Na2CO3和NaHCO3是厨房中常见的两种盐,可用化学性质的差异进行鉴别。回答下列问题:
(1)热稳定性差异。乙组设计如图装置进行实验(加热及夹持装置省略)。

将分别装有Na2CO3和NaHCO3的试管同时放入甘油浴加热(甘油沸点为290℃)。该实验用饱和碳酸钠溶液检验反应的产物,b试管中的实验现象为:___________ ,试管b中发生反应的化学方程式为___________ 。
(2)取一定质量的Na2CO3和NaHCO3混合物灼烧至恒重,冷却至室温,共收集到4.4g气体。加热后剩余的固体物质与足量盐酸反应,共收集到8.8g气体。请分别求出原固体混合物中Na2CO3和NaHCO3的质量分别为___________ g、___________ g。
(3)有同学提出:取一定质量的Na2CO3和NaHCO3混合物灼烧至恒重,将产生的气体通入足量Ba(OH)2溶液中,通过生成的沉淀质量计算碳酸钠的含量,发现测量值明显偏大,可能的原因是___________ 。
Ⅱ.我国化学家侯德榜发明的“联合制碱法”为世界制碱工业做出了巨大贡献,下图为联合制碱法的主要过程(部分物质已略去)。

已知:i.NH3极易溶于水并生成碱,与酸反应生成盐,如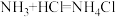 。
。
ii.有关物质的溶解度(20℃)
(4)沉淀池中主要沉淀物___________ (化学式),发生反应的化学方程式为___________ 。
(1)热稳定性差异。乙组设计如图装置进行实验(加热及夹持装置省略)。

将分别装有Na2CO3和NaHCO3的试管同时放入甘油浴加热(甘油沸点为290℃)。该实验用饱和碳酸钠溶液检验反应的产物,b试管中的实验现象为:
(2)取一定质量的Na2CO3和NaHCO3混合物灼烧至恒重,冷却至室温,共收集到4.4g气体。加热后剩余的固体物质与足量盐酸反应,共收集到8.8g气体。请分别求出原固体混合物中Na2CO3和NaHCO3的质量分别为
(3)有同学提出:取一定质量的Na2CO3和NaHCO3混合物灼烧至恒重,将产生的气体通入足量Ba(OH)2溶液中,通过生成的沉淀质量计算碳酸钠的含量,发现测量值明显偏大,可能的原因是
Ⅱ.我国化学家侯德榜发明的“联合制碱法”为世界制碱工业做出了巨大贡献,下图为联合制碱法的主要过程(部分物质已略去)。

已知:i.NH3极易溶于水并生成碱,与酸反应生成盐,如
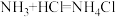 。
。ii.有关物质的溶解度(20℃)
| 物质 | NaCl |  |  |  |
| 溶解度/g | 36.0 | 21.7 | 9.6 | 37.2 |
(4)沉淀池中主要沉淀物
您最近一年使用:0次
2023-12-26更新
|
52次组卷
|
2卷引用:四川省遂宁中学校2023-2024学年高一上学期期中(半期)考试化学试题
名校
解题方法
5 . 下列关于NaHCO3和Na2CO3的说法不正确的是
| A.将澄清石灰水分别加入NaHCO3与Na2CO3的溶液中,两者都会产生沉淀 |
| B.可以通过将两种固体溶于水,根据吸放热现象来区分两溶液,吸热的为碳酸钠 |
| C.往两个浓溶液中滴加酚酞溶液,溶液均变红 |
| D.取a克Na2CO3和NaHCO3混合物与足量盐酸充分反应,加热,蒸干,灼烧,得b克固体,可计算得到混合物中Na2CO3的含量 |
您最近一年使用:0次
2021-11-13更新
|
161次组卷
|
2卷引用:四川省凉山州宁南中学2021-2022学年高一上学期第二次月考化学试题



