1 . 碳酸钠和碳酸氢钠是生活中比较常见的两种物质。某学校的课外化学学习兴趣小组对两者性质进行探究,并测定碳酸钠和碳酸氢钠混合物中各成分的含量。
实验I:
(1)取两支试管分别加入各约1g的碳酸钠和碳酸氢钠固体,再分别加入几滴水振荡试管,用手触摸试管底部,温度较高的是_______ (填化学式,下同)。
(2)继续向两支试管中分别加入10mL水,充分振荡,最先溶解完全的是_______ ;再分别加入几滴酚酞试液,溶液变红,但颜色较浅的是_______ 。
实验II:碳酸钠和碳酸氢钠的热稳定性比较探究
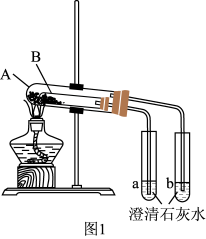
(3)按图1组装好仪器(A为大试管,B为小试管)后,接下来的操作是_______ ,再往试管中添加药品,则试管A中盛放的药品是_______ ,澄清石灰水变浑浊的是_______ (填“a”或“b”)。
实验III:混合物中碳酸钠含量的测定
(4)为确定碳酸钠和碳酸氢钠混合物样品的组成,甲化学探究小组设计实验1:利用如图2所示的装置进行实验。
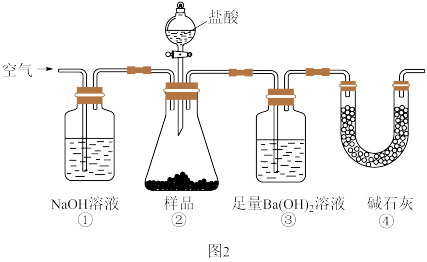
下列说法错误的是_______(填字母,单选)。
(5)乙化学探究小组设计实验2:取ag样品加热、冷却、称重,重复以上操作至样品固体质量不再变化,称量其质量为bg。样品中 质量分数为
质量分数为_______ ×100%(用a、b表示)。
(6)丙化学探究小组设计实验3:步骤ⅰ。称取一定量的混合物样品;步骤ⅱ。向其中逐滴滴入0.1000mol/L稀盐酸,记录生成的气体体积和滴入盐酸体积,如图3所示。
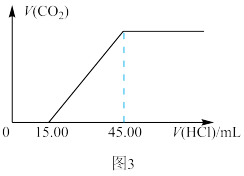
计算:①生成的 在标况下的体积为
在标况下的体积为_______ mL;
②该混合物中 的质量分数
的质量分数_______ %(保留两位小数)。
实验I:
(1)取两支试管分别加入各约1g的碳酸钠和碳酸氢钠固体,再分别加入几滴水振荡试管,用手触摸试管底部,温度较高的是
(2)继续向两支试管中分别加入10mL水,充分振荡,最先溶解完全的是
实验II:碳酸钠和碳酸氢钠的热稳定性比较探究
(3)按图1组装好仪器(A为大试管,B为小试管)后,接下来的操作是

实验III:混合物中碳酸钠含量的测定
(4)为确定碳酸钠和碳酸氢钠混合物样品的组成,甲化学探究小组设计实验1:利用如图2所示的装置进行实验。

下列说法错误的是_______(填字母,单选)。
A.滴入盐酸前,应先将装置中含有 的空气排尽 的空气排尽 |
B.装置①、④的作用是防止空气中的 进入装置③中 进入装置③中 |
C.在装置②、③间需添加盛有饱和 溶液的洗气瓶,以除去挥发的HCl气体 溶液的洗气瓶,以除去挥发的HCl气体 |
D.反应结束时,应继续通入空气将装置②中的 转移到装置③中 转移到装置③中 |
 质量分数为
质量分数为(6)丙化学探究小组设计实验3:步骤ⅰ。称取一定量的混合物样品;步骤ⅱ。向其中逐滴滴入0.1000mol/L稀盐酸,记录生成的气体体积和滴入盐酸体积,如图3所示。

计算:①生成的
 在标况下的体积为
在标况下的体积为②该混合物中
 的质量分数
的质量分数
您最近一年使用:0次
名校
2 . 大苏打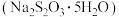 、苏打、小苏打被称为“苏氏三兄弟”。它们在生活、生产中有广泛应用。
、苏打、小苏打被称为“苏氏三兄弟”。它们在生活、生产中有广泛应用。
(1)工业上,将 和
和 以
以 的物质的量之比配成溶液。再通入
的物质的量之比配成溶液。再通入 可制取
可制取 ,同时放出
,同时放出 ,写出该反应的化学方程
,写出该反应的化学方程___________ 。 溶液在空气中久置,会生成浅黄色物质,经测定该物质具有与过氧化钠相似的结构,该物质的电子式为
溶液在空气中久置,会生成浅黄色物质,经测定该物质具有与过氧化钠相似的结构,该物质的电子式为___________ 。
(2) 标准溶液常用于滴定碘的含量,若滴定的溶液呈酸性,测定结果会偏高。用离子方程式表示其原因
标准溶液常用于滴定碘的含量,若滴定的溶液呈酸性,测定结果会偏高。用离子方程式表示其原因___________ 。
(3)下列关于苏打和小苏打的说法正确的是___________ (选填字母序号)。
A.纯碱是一种重要的化工原料,在玻璃、肥皂、造纸等工业中都有重要的应用
B.苏打和小苏打的相互转化属于可逆反应
C.苏打(含氯化钠杂质)可用滴定法测苏打的质量分数,使用石蕊溶液做指示剂更准确
D.牙膏中加入小苏打可以让小苏打颗粒直接摩擦牙齿,帮助清洁牙垢
(4)向 的氢氧化钠溶液中通入一定量的二氧化碳,充分反应后再向溶液中逐滴滴入
的氢氧化钠溶液中通入一定量的二氧化碳,充分反应后再向溶液中逐滴滴入 的稀盐酸,产生气体体积(标况)如图所示。
的稀盐酸,产生气体体积(标况)如图所示。

请回答下列问题
①通入二氧化碳后形成溶液的溶质成分是___________ (填写化学式)
②滴入 稀盐酸过程中,溶液导电性
稀盐酸过程中,溶液导电性___________ (填“增强”或“减弱”),试解释其原因___________ 。
③原 氢氧化钠溶液的浓度为
氢氧化钠溶液的浓度为___________ 。
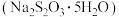 、苏打、小苏打被称为“苏氏三兄弟”。它们在生活、生产中有广泛应用。
、苏打、小苏打被称为“苏氏三兄弟”。它们在生活、生产中有广泛应用。(1)工业上,将
 和
和 以
以 的物质的量之比配成溶液。再通入
的物质的量之比配成溶液。再通入 可制取
可制取 ,同时放出
,同时放出 ,写出该反应的化学方程
,写出该反应的化学方程 溶液在空气中久置,会生成浅黄色物质,经测定该物质具有与过氧化钠相似的结构,该物质的电子式为
溶液在空气中久置,会生成浅黄色物质,经测定该物质具有与过氧化钠相似的结构,该物质的电子式为(2)
 标准溶液常用于滴定碘的含量,若滴定的溶液呈酸性,测定结果会偏高。用离子方程式表示其原因
标准溶液常用于滴定碘的含量,若滴定的溶液呈酸性,测定结果会偏高。用离子方程式表示其原因(3)下列关于苏打和小苏打的说法正确的是
A.纯碱是一种重要的化工原料,在玻璃、肥皂、造纸等工业中都有重要的应用
B.苏打和小苏打的相互转化属于可逆反应
C.苏打(含氯化钠杂质)可用滴定法测苏打的质量分数,使用石蕊溶液做指示剂更准确
D.牙膏中加入小苏打可以让小苏打颗粒直接摩擦牙齿,帮助清洁牙垢
(4)向
 的氢氧化钠溶液中通入一定量的二氧化碳,充分反应后再向溶液中逐滴滴入
的氢氧化钠溶液中通入一定量的二氧化碳,充分反应后再向溶液中逐滴滴入 的稀盐酸,产生气体体积(标况)如图所示。
的稀盐酸,产生气体体积(标况)如图所示。
请回答下列问题
①通入二氧化碳后形成溶液的溶质成分是
②滴入
 稀盐酸过程中,溶液导电性
稀盐酸过程中,溶液导电性③原
 氢氧化钠溶液的浓度为
氢氧化钠溶液的浓度为
您最近一年使用:0次
2021-02-09更新
|
1015次组卷
|
7卷引用:河南省信阳市2021届高三上学期第二次教学质量检测化学试题
河南省信阳市2021届高三上学期第二次教学质量检测化学试题(已下线)专题06 钠及其化合物(限时精练)-2022届高考化学一轮复习热点题型归纳与变式训练(已下线)第07讲 钠及其重要化合物(精练)-2022年高考化学一轮复习讲练测河北省武安市第一中学2021-2022学年高三上学期第五次调研考试化学试题(已下线)第07讲 钠及其重要化合物(练)-2023年高考化学一轮复习讲练测(全国通用)新疆维吾尔自治区伊犁哈萨克自治州新源县第二中学2021-2022学年上学期高三第一次月考化学试题(已下线)第1讲 钠及其重要化合物
名校
3 . 化工专家侯德榜发明的侯氏制碱法为我国纯碱工业和国民经济发展做出了重要贡献,某化学兴趣小组在实验室中模拟并改进侯氏制碱法制备 ,进一步处理得到产品
,进一步处理得到产品 和
和 ,实验流程如图:
,实验流程如图:

(1)生成 的总反应的化学方程式为
的总反应的化学方程式为___________ 。
(2)从下图A~E中选择合适的仪器制备 ,正确的连接顺序是
,正确的连接顺序是___________ (按气流方向,用小写字母表示),B中使用雾化装置的优点是___________ 。
A. B.
B.  C.
C.  D.
D.  E.
E. 
(3)反应完成后,将B中U形管内的混合物处理得到固体 和滤液:
和滤液:
灼烧 发生化学反应为:
发生化学反应为:___________ 。若灼烧前后固体质量减少1.24g,则生成的 的质量为
的质量为___________ g。
(4)工业纯碱中可能混有少量NaCl,同学们对工业纯碱样品展开探究。
探究一:确定纯碱样品中是否含有NaCl
有同学认为该实验方案有错误,正确方案应选用___________ (填字母)代替稀盐酸。
a. 溶液 b.稀硝酸 c.
溶液 b.稀硝酸 c. 溶液
溶液
探究二:测定纯碱样品中 的质量分数
的质量分数
【方案1】称取mg样品溶解,加入过量 溶液,搅拌至反应完全。过滤、洗涤、干燥,称量沉淀的质量为ng,则样品中
溶液,搅拌至反应完全。过滤、洗涤、干燥,称量沉淀的质量为ng,则样品中 的质量分数为
的质量分数为___________ 。
【方案2】如图所示,取样品于锥形瓶中,加入足量稀盐酸。反应结束后,根据干燥管增重计算 的质量分数。若结果大于100%,可能的原因是
的质量分数。若结果大于100%,可能的原因是___________ 。

 ,进一步处理得到产品
,进一步处理得到产品 和
和 ,实验流程如图:
,实验流程如图:
(1)生成
 的总反应的化学方程式为
的总反应的化学方程式为(2)从下图A~E中选择合适的仪器制备
 ,正确的连接顺序是
,正确的连接顺序是A.
 B.
B.  C.
C.  D.
D.  E.
E. 
(3)反应完成后,将B中U形管内的混合物处理得到固体
 和滤液:
和滤液:灼烧
 发生化学反应为:
发生化学反应为: 的质量为
的质量为(4)工业纯碱中可能混有少量NaCl,同学们对工业纯碱样品展开探究。
探究一:确定纯碱样品中是否含有NaCl
| 实验操作 | 现象 | 结论 |
| 取样品加水溶解,加入过量稀盐酸至反应完全 | 有气泡产生 | 样品中有NaCl |
向上述溶液中继续滴加适量 溶液 溶液 | 有白色沉淀产生 |
a.
 溶液 b.稀硝酸 c.
溶液 b.稀硝酸 c. 溶液
溶液探究二:测定纯碱样品中
 的质量分数
的质量分数【方案1】称取mg样品溶解,加入过量
 溶液,搅拌至反应完全。过滤、洗涤、干燥,称量沉淀的质量为ng,则样品中
溶液,搅拌至反应完全。过滤、洗涤、干燥,称量沉淀的质量为ng,则样品中 的质量分数为
的质量分数为【方案2】如图所示,取样品于锥形瓶中,加入足量稀盐酸。反应结束后,根据干燥管增重计算
 的质量分数。若结果大于100%,可能的原因是
的质量分数。若结果大于100%,可能的原因是
您最近一年使用:0次
名校
解题方法
4 . 现有一份Na2CO3和NaHCO3固体混合物,某化学兴趣小组设计如图所示实验装置(夹持仪器省略),测定固体混合物中NaHCO3的质量分数。实验步骤如下:

①组装好实验装置,并_______;
②加药品,称取mg样品放入硬质玻璃管中;称量装有碱石灰的U形管D的质量为m1g;。
③打开活塞K1、K2,关闭K3,缓缓鼓入空气数分钟;
④关闭活塞K1、K2,打开K3,点燃酒精灯加热至不再产生气体;
⑤打开活塞K1,缓缓鼓入空气数分钟后拆下装置,称量U形管D的质量为m2g。
请回答下列问题:
(1)补充实验步骤①的操作为_______ 。
(2)装置E中实验仪器的名称为_______ 。
(3)装置B中发生反应的化学方程式为_______ 。
(4)实验步骤⑤中“缓缓鼓入空气数分钟”的目的是_______ 。
(5)若缺少实验步骤③会导致测定结果_______ (填“偏大”“偏小”或“无影响”)。
(6)能用来鉴别Na2CO3和NaHCO3两种白色固体的实验操作是_______ 。

A. 将Na2CO3和NaHCO3配制成同浓度的溶液,用pH试纸测定pH值并做比较
B. 两支试管中均盛有3mL等浓度的稀盐酸,将少量等质量的Na2CO3、NaHCO3粉末同时倒入试管中,比较反应快慢(如图)。
C. 分别在这两种物质的溶液中,加入少量Ca(OH)2溶液
(7)下列实验方案中,不能测定Na2CO3和NaHCO3混合物中Na2CO3质量分数的是_______。

①组装好实验装置,并_______;
②加药品,称取mg样品放入硬质玻璃管中;称量装有碱石灰的U形管D的质量为m1g;。
③打开活塞K1、K2,关闭K3,缓缓鼓入空气数分钟;
④关闭活塞K1、K2,打开K3,点燃酒精灯加热至不再产生气体;
⑤打开活塞K1,缓缓鼓入空气数分钟后拆下装置,称量U形管D的质量为m2g。
请回答下列问题:
(1)补充实验步骤①的操作为
(2)装置E中实验仪器的名称为
(3)装置B中发生反应的化学方程式为
(4)实验步骤⑤中“缓缓鼓入空气数分钟”的目的是
(5)若缺少实验步骤③会导致测定结果
(6)能用来鉴别Na2CO3和NaHCO3两种白色固体的实验操作是

A. 将Na2CO3和NaHCO3配制成同浓度的溶液,用pH试纸测定pH值并做比较
B. 两支试管中均盛有3mL等浓度的稀盐酸,将少量等质量的Na2CO3、NaHCO3粉末同时倒入试管中,比较反应快慢(如图)。
C. 分别在这两种物质的溶液中,加入少量Ca(OH)2溶液
(7)下列实验方案中,不能测定Na2CO3和NaHCO3混合物中Na2CO3质量分数的是_______。
| A.取a g混合物充分加热,减重b g |
| B.取a g混合物与足量稀盐酸充分反应,加热、蒸干、灼烧,得b g固体 |
| C.取a g混合物与足量稀硫酸充分反应,逸出气体用碱石灰吸收,增重b g |
| D.取a g混合物与足量Ba(OH)2溶液充分反应,过滤、洗涤、烘干,得b g固体 |
您最近一年使用:0次
名校
5 . 下列实验操作中,正确的是
| A.钠要保存在煤油中,实验时剩余的钠要放到废液缸中 |
| B.等物质的量的①Na、②Na2O、③Na2O2、④NaOH投入到等体积且足量的水中,得到四种溶液溶质的质量分数相等 |
| C.取agNa2CO3和NaHCO3的固体混合物充分加热,质量减少bg,可测定出Na2CO3的质量分数 |
| D.Na2CO3是白色粉末,NaHCO3是细小的白色晶体,分别向Na2CO3和NaHCO3的固体中加入少量水,均伴有放热现象 |
您最近一年使用:0次
名校
6 . 钠和钠的化合物有许多重要的用途,碳酸钠可用于从海水提取溴,涉及的反应如下:3Br2+6Na2CO3+3H2O=5NaBr+NaBrO3+6NaHCO3。
(1)用双线桥法标出电子转移的方向和数目_______ 。
(2)该反应的离子方程式为_______ 。
(3)该反应中氧化剂与还原剂的物质的量之比是_______ 。
(4)钠着火时应采取的灭火措施是_______ ,不能用水灭火,原因是_______ (涉及反应的离子方程式)。
(5)用洁净的铂丝蘸取Na2CO3溶液置于酒精灯火焰上灼烧,火焰呈_______ 色。
(6)等质量的Na2CO3和NaHCO3分别与足量的盐酸反应,在相同条件下产生CO2的体积V(Na2CO3)_______ V(NaHCO3)(填“大于”,“小于”或“等于”)。
(7)若加热10.00g的碳酸钠和碳酸氢钠的混合物,使碳酸氢钠完全分解,混合物质量减少了2.48g,则原混合物中碳酸钠的质量分数为_______ 。
(1)用双线桥法标出电子转移的方向和数目
(2)该反应的离子方程式为
(3)该反应中氧化剂与还原剂的物质的量之比是
(4)钠着火时应采取的灭火措施是
(5)用洁净的铂丝蘸取Na2CO3溶液置于酒精灯火焰上灼烧,火焰呈
(6)等质量的Na2CO3和NaHCO3分别与足量的盐酸反应,在相同条件下产生CO2的体积V(Na2CO3)
(7)若加热10.00g的碳酸钠和碳酸氢钠的混合物,使碳酸氢钠完全分解,混合物质量减少了2.48g,则原混合物中碳酸钠的质量分数为
您最近一年使用:0次
7 . 我国化学家侯德榜发明的“联合制碱法”为世界制碱工业做出了巨大贡献。联合制碱法的工艺流程简化如下:

I.资料1:反应I中的化学方程式为:NaCl+NH3+CO2+H2O=NH4Cl+NaHCO3↓
资料2:20℃时,溶解度小于0.0lg的物质属于难溶物;20℃时BaSO4溶解度为 g。
g。
资料3:表1有关物质的溶解度(20℃)
(1)操作I的名称为_______ ,反应II的化学方程式为_______ 。
(2)相同温度下,用pH试纸测量同等浓度的Na2CO3与NaHCO3溶液pH,_______ 溶液碱性强。
(3)离子反应: ,BaSO4难溶生成沉淀,符合复分解反应发生的条件;反应I中NaHCO3不是难溶物,也生成了沉淀,理由是
,BaSO4难溶生成沉淀,符合复分解反应发生的条件;反应I中NaHCO3不是难溶物,也生成了沉淀,理由是_______ 。
II.泡腾片是一种医药片剂,适用于儿童、老年人以及吞服药丸困难的患者。泡腾片放入水中,在崩解剂的作用下,即刻产生大量气泡(二氧化碳),使片剂迅速崩解形成水溶液,崩解剂主要由NaHCO3固体与柠檬酸固体组成。
(4)下列说法正确的是_______ (填字母)。
A.NaHCO3固体与柠檬酸固体不反应
B.柠檬酸在水中电离产生H+与NaHCO3反应
C.Na2CO3比NaHCO3稳定,受热不易分解
(5)某NaHCO3样品中含NaCl杂质,取质量为a g的样品,加入足量的稀盐酸,充分反应后,加热、蒸干、灼烧,得到b g固体物质,则此样品中NaHCO3的质量分数是_______ 。

I.资料1:反应I中的化学方程式为:NaCl+NH3+CO2+H2O=NH4Cl+NaHCO3↓
资料2:20℃时,溶解度小于0.0lg的物质属于难溶物;20℃时BaSO4溶解度为
 g。
g。资料3:表1有关物质的溶解度(20℃)
| 物质 | NaCl | NH4HCO3 | NaHCO3 | NH4Cl |
| 溶解度/g | 36.0 | 21.7 | 9.6 | 37.2 |
(1)操作I的名称为
(2)相同温度下,用pH试纸测量同等浓度的Na2CO3与NaHCO3溶液pH,
(3)离子反应:
 ,BaSO4难溶生成沉淀,符合复分解反应发生的条件;反应I中NaHCO3不是难溶物,也生成了沉淀,理由是
,BaSO4难溶生成沉淀,符合复分解反应发生的条件;反应I中NaHCO3不是难溶物,也生成了沉淀,理由是II.泡腾片是一种医药片剂,适用于儿童、老年人以及吞服药丸困难的患者。泡腾片放入水中,在崩解剂的作用下,即刻产生大量气泡(二氧化碳),使片剂迅速崩解形成水溶液,崩解剂主要由NaHCO3固体与柠檬酸固体组成。
(4)下列说法正确的是
A.NaHCO3固体与柠檬酸固体不反应
B.柠檬酸在水中电离产生H+与NaHCO3反应
C.Na2CO3比NaHCO3稳定,受热不易分解
(5)某NaHCO3样品中含NaCl杂质,取质量为a g的样品,加入足量的稀盐酸,充分反应后,加热、蒸干、灼烧,得到b g固体物质,则此样品中NaHCO3的质量分数是
您最近一年使用:0次
名校
解题方法
8 . 下列关于Na2CO3和NaHCO3的叙述中,错误 的是
| A.Na2CO3是白色粉末,NaHCO3是细小的白色晶体 |
| B.Na2CO3和NaHCO3的溶液均显碱性,可用作食用碱或工业用碱 |
| C.向饱和Na2CO3溶液中通入CO2气体,溶液不会出现混浊现象 |
| D.取a g Na2CO3和NaHCO3的固体混合物充分加热,质量减少b g,可测定出Na2CO3的质量分数 |
您最近一年使用:0次
2022-10-09更新
|
495次组卷
|
4卷引用:河南省周口恒大中学2022-2023学年高一上学期11月期中考试化学试题
名校
9 . 下列说法正确的是
① 投入到紫色石蕊试液中,溶液先变蓝,后褪色;
投入到紫色石蕊试液中,溶液先变蓝,后褪色;
②足量 和质量相等的
和质量相等的 在常温和加热条件下反应,转移的电子数相等;
在常温和加热条件下反应,转移的电子数相等;
③质量相等的 与
与 分别与足量的相同浓度盐酸完全反应时,产生
分别与足量的相同浓度盐酸完全反应时,产生 的物质的量相等;
的物质的量相等;
④取 和
和 混合物与足量稀硫酸充分反应,逸出气体用碱石灰吸收,增重
混合物与足量稀硫酸充分反应,逸出气体用碱石灰吸收,增重 ,能测定混合物中
,能测定混合物中 质量分数;
质量分数;
⑤鉴别 与
与 溶液,可用
溶液,可用 溶液;
溶液;
⑥除去 粉末中混有的
粉末中混有的 ,可配制成溶液通入过量的
,可配制成溶液通入过量的 ,再低温结晶。
,再低温结晶。
①
 投入到紫色石蕊试液中,溶液先变蓝,后褪色;
投入到紫色石蕊试液中,溶液先变蓝,后褪色;②足量
 和质量相等的
和质量相等的 在常温和加热条件下反应,转移的电子数相等;
在常温和加热条件下反应,转移的电子数相等;③质量相等的
 与
与 分别与足量的相同浓度盐酸完全反应时,产生
分别与足量的相同浓度盐酸完全反应时,产生 的物质的量相等;
的物质的量相等;④取
 和
和 混合物与足量稀硫酸充分反应,逸出气体用碱石灰吸收,增重
混合物与足量稀硫酸充分反应,逸出气体用碱石灰吸收,增重 ,能测定混合物中
,能测定混合物中 质量分数;
质量分数;⑤鉴别
 与
与 溶液,可用
溶液,可用 溶液;
溶液;⑥除去
 粉末中混有的
粉末中混有的 ,可配制成溶液通入过量的
,可配制成溶液通入过量的 ,再低温结晶。
,再低温结晶。| A.②③④ | B.①②⑥ | C.②④⑤ | D.③④⑥ |
您最近一年使用:0次
2023-02-16更新
|
896次组卷
|
2卷引用:河南省遂平县第一高级中学2023-2024学年高一上学期第一次月考化学试题
名校
10 . 为确定碳酸钠和碳酸氢钠混合样品中碳酸钠的质量分数,可通过加热分解得到的CO2质量进行计算,某同学设计的实验装置示意图如下:

该同学设计的实验装置存在缺陷,有关该实验装置及实验过程中,下列因素可能使碳酸氢钠的质量分数偏高的是

该同学设计的实验装置存在缺陷,有关该实验装置及实验过程中,下列因素可能使碳酸氢钠的质量分数偏高的是
| A.样品分解不完全 |
| B.装置B、C之间缺少CO2的干燥装置 |
| C.产生CO2气体的速率太快,没有被碱石灰完全吸收 |
| D.反应完全后停止加热,通入过量的N2 |
您最近一年使用:0次
2022-03-23更新
|
268次组卷
|
4卷引用:河南省南阳市第一中学校2021-2022学年高一上学期第六次月考化学试题



