名校
1 . 钠的一系列化合物在生活与生产中有非常重要的作用,某学习小组开展了相关研究活动:
(1)甲同学欲配制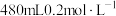 的
的 溶液,需要使用的玻璃仪器有
溶液,需要使用的玻璃仪器有____________ 、烧杯和胶头滴管;下列操作会使所配溶液浓度偏小的是______ 。
a.用托盘天平称量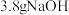 固体进行配制溶液
固体进行配制溶液
b.定容时俯视刻度线
c.未待溶解的 浓溶液冷却即转移至相应容器进行后继操作
浓溶液冷却即转移至相应容器进行后继操作
d.定容摇匀后发现液面低于刻度线,再次加入蒸馏水至刻度线
(2)乙同学欲比较 固体和
固体和 固体的热稳定性,设计实验装置如下图:
固体的热稳定性,设计实验装置如下图:
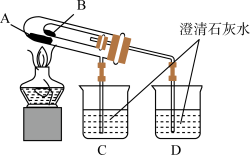
① 烧杯中的现象是
烧杯中的现象是____________
② 处应放置的药品是
处应放置的药品是____________
③热稳定性:
______  (大于、小于)
(大于、小于)
(3)丙同学为探究 的强氧化性,某设计了下图实验装置。
的强氧化性,某设计了下图实验装置。
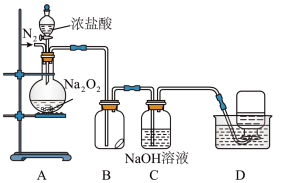
实验步骤及现象如下:
Ⅰ.检查装置气密性后,装入药品并连接仪器。
Ⅱ.缓慢通入一定量的 后,封闭
后,封闭 气体通路,将装置
气体通路,将装置 连接好(导管末端未伸入集气瓶中),再向圆底烧瓶中缓慢滴加浓盐酸,
连接好(导管末端未伸入集气瓶中),再向圆底烧瓶中缓慢滴加浓盐酸, 中剧烈反应,有黄绿色气体产生。
中剧烈反应,有黄绿色气体产生。
Ⅱ.待产生连续气泡后,将装置 中的导管末端伸入集气瓶中,收集到无色气体。
中的导管末端伸入集气瓶中,收集到无色气体。
①. 中气体能使带火星的木条复燃,丙同学分析该气体不可能由
中气体能使带火星的木条复燃,丙同学分析该气体不可能由 还原
还原 所得,从氧化还原角度说明理由:
所得,从氧化还原角度说明理由:______ 。
②.资料显示, 也能与干燥
也能与干燥 反应产生
反应产生 ,写出反应的化学方程式
,写出反应的化学方程式______
(1)甲同学欲配制
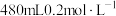 的
的 溶液,需要使用的玻璃仪器有
溶液,需要使用的玻璃仪器有a.用托盘天平称量
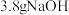 固体进行配制溶液
固体进行配制溶液b.定容时俯视刻度线
c.未待溶解的
 浓溶液冷却即转移至相应容器进行后继操作
浓溶液冷却即转移至相应容器进行后继操作d.定容摇匀后发现液面低于刻度线,再次加入蒸馏水至刻度线
(2)乙同学欲比较
 固体和
固体和 固体的热稳定性,设计实验装置如下图:
固体的热稳定性,设计实验装置如下图:
①
 烧杯中的现象是
烧杯中的现象是②
 处应放置的药品是
处应放置的药品是③热稳定性:

 (大于、小于)
(大于、小于)(3)丙同学为探究
 的强氧化性,某设计了下图实验装置。
的强氧化性,某设计了下图实验装置。
实验步骤及现象如下:
Ⅰ.检查装置气密性后,装入药品并连接仪器。
Ⅱ.缓慢通入一定量的
 后,封闭
后,封闭 气体通路,将装置
气体通路,将装置 连接好(导管末端未伸入集气瓶中),再向圆底烧瓶中缓慢滴加浓盐酸,
连接好(导管末端未伸入集气瓶中),再向圆底烧瓶中缓慢滴加浓盐酸, 中剧烈反应,有黄绿色气体产生。
中剧烈反应,有黄绿色气体产生。Ⅱ.待产生连续气泡后,将装置
 中的导管末端伸入集气瓶中,收集到无色气体。
中的导管末端伸入集气瓶中,收集到无色气体。①.
 中气体能使带火星的木条复燃,丙同学分析该气体不可能由
中气体能使带火星的木条复燃,丙同学分析该气体不可能由 还原
还原 所得,从氧化还原角度说明理由:
所得,从氧化还原角度说明理由:②.资料显示,
 也能与干燥
也能与干燥 反应产生
反应产生 ,写出反应的化学方程式
,写出反应的化学方程式
您最近半年使用:0次
名校
解题方法
2 . 某汽车安全气囊的产气药剂主要含有NaN3、Fe2O3、KClO4、NaHCO3等物质。当汽车发生碰撞时,NaN3迅速分解产生N2和Na,同时放出大量的热。N2使气囊迅速膨胀,从而起到保护作用。
(1)KClO4中氯元素的化合价是___________ ,具有___________ (填“还原性”或“氧化性”)。
(2)Fe2O3可处理产生的Na,反应为6Na + Fe2O3 = 3Na2O + 2Fe,反应中Na做___________ (填“还原剂”或“氧化剂”)。
(3)NaHCO3是冷却剂,吸收产气过程中释放的热量而分解,其分解的化学方程式是___________ 。若不用Fe2O3处理产生的Na,Na可与NaHCO3分解产生的水反应,写出Na与水反应的离子方程式___________ 。
(4)按如图所示装置实验,可得到“Na2CO3的热稳定性比NaHCO3强”的结论,证据是___________ 。

(5)下列关于Na2CO3和NaHCO3的说法中,正确的是___________ (填字母)。
a.Na2CO3和NaHCO3的溶液均显碱性
b.相同温度下,NaHCO3的溶解度大于Na2CO3
c.向等质量的Na2CO3和NaHCO3固体中分别滴加足量的盐酸,相同条件下产生CO2的体积也相同
(1)KClO4中氯元素的化合价是
(2)Fe2O3可处理产生的Na,反应为6Na + Fe2O3 = 3Na2O + 2Fe,反应中Na做
(3)NaHCO3是冷却剂,吸收产气过程中释放的热量而分解,其分解的化学方程式是
(4)按如图所示装置实验,可得到“Na2CO3的热稳定性比NaHCO3强”的结论,证据是

(5)下列关于Na2CO3和NaHCO3的说法中,正确的是
a.Na2CO3和NaHCO3的溶液均显碱性
b.相同温度下,NaHCO3的溶解度大于Na2CO3
c.向等质量的Na2CO3和NaHCO3固体中分别滴加足量的盐酸,相同条件下产生CO2的体积也相同
您最近半年使用:0次
名校
解题方法
3 . 下列有关物质的性质与用途说法不正确的是
| A.碳酸钠的水溶液显碱性,可用作食用碱 |
| B.碳酸氢钠受热易分解,可以用作焙制糕点的膨松剂 |
| C.过氧化钠具有强还原性,可用于潜水艇的供氧剂 |
| D.ClO2具有强氧化性,可用于自来水杀菌消毒 |
您最近半年使用:0次
名校
解题方法
4 . 回答下列问题
(1)呼吸面具中的供氧剂与二氧化碳反应的化学方程式_______ ,该反应与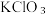 分解反应相比较,产生等分子数的气体,转移电子数目之比为
分解反应相比较,产生等分子数的气体,转移电子数目之比为_______ 。
(2) 溶于水,书写电离方程式
溶于水,书写电离方程式_______ ;检验该溶液中是否含有  ,所需试剂
,所需试剂_______ (填化学式),离子方程式_______ ;除去该溶液中的 杂质,涉及的离子方程式
杂质,涉及的离子方程式_______ ;检验 溶液中是否含有
溶液中是否含有 ,实验操作名称为
,实验操作名称为_______ 。
(3)分别取含等质量溶质的氢氧化钠溶液各 100mL,再分别通入一定量的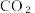 ,随后分别各取 20mL 溶液,向其中逐滴滴入稀盐酸,在标准状况下产生(CO2的体积(y轴)与所加入盐酸的体积(x轴)的关系如图(分A、B 两种情况):
,随后分别各取 20mL 溶液,向其中逐滴滴入稀盐酸,在标准状况下产生(CO2的体积(y轴)与所加入盐酸的体积(x轴)的关系如图(分A、B 两种情况):
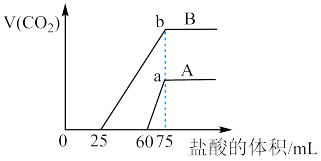
①在A情况下,加入盐酸0-60mL过程中,发生反应的离子方程式依次为_______ 、_______ 。
②图中a、b两点所示的溶液(加入盐酸均为75mL时)溶质分别为_______ 、_______ (生成的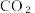 全部逸出),所含溶质的质量大小关系
全部逸出),所含溶质的质量大小关系_______
A. 相等 B. b点质量大 C. a 点质量大
(4) (O为-l价)性质与
(O为-l价)性质与 类似,既具有氧化性,也具有还原性。某小组同学分别选用酸性
类似,既具有氧化性,也具有还原性。某小组同学分别选用酸性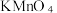 溶液、酸化的KI溶液与
溶液、酸化的KI溶液与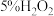 溶液反应验证其性质。(已知:淀粉遇
溶液反应验证其性质。(已知:淀粉遇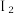 变蓝)
变蓝)

实验①利用了酸性高锰酸钾的_______ 性质,该实验中,证明 溶液与
溶液与 反应的现象除了溶液颜色变浅或褪色外,还有
反应的现象除了溶液颜色变浅或褪色外,还有_______ 。
实验②是为了验证 的
的_______ 性质,在反应后的溶液中加入淀粉溶液,可观察到溶液变蓝,写出该反应的离子方程式_______ 。
(1)呼吸面具中的供氧剂与二氧化碳反应的化学方程式
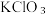 分解反应相比较,产生等分子数的气体,转移电子数目之比为
分解反应相比较,产生等分子数的气体,转移电子数目之比为(2)
 溶于水,书写电离方程式
溶于水,书写电离方程式 ,所需试剂
,所需试剂 杂质,涉及的离子方程式
杂质,涉及的离子方程式 溶液中是否含有
溶液中是否含有 ,实验操作名称为
,实验操作名称为(3)分别取含等质量溶质的氢氧化钠溶液各 100mL,再分别通入一定量的
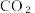 ,随后分别各取 20mL 溶液,向其中逐滴滴入稀盐酸,在标准状况下产生(CO2的体积(y轴)与所加入盐酸的体积(x轴)的关系如图(分A、B 两种情况):
,随后分别各取 20mL 溶液,向其中逐滴滴入稀盐酸,在标准状况下产生(CO2的体积(y轴)与所加入盐酸的体积(x轴)的关系如图(分A、B 两种情况):
①在A情况下,加入盐酸0-60mL过程中,发生反应的离子方程式依次为
②图中a、b两点所示的溶液(加入盐酸均为75mL时)溶质分别为
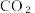 全部逸出),所含溶质的质量大小关系
全部逸出),所含溶质的质量大小关系A. 相等 B. b点质量大 C. a 点质量大
(4)
 (O为-l价)性质与
(O为-l价)性质与 类似,既具有氧化性,也具有还原性。某小组同学分别选用酸性
类似,既具有氧化性,也具有还原性。某小组同学分别选用酸性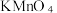 溶液、酸化的KI溶液与
溶液、酸化的KI溶液与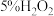 溶液反应验证其性质。(已知:淀粉遇
溶液反应验证其性质。(已知:淀粉遇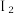 变蓝)
变蓝)
实验①利用了酸性高锰酸钾的
 溶液与
溶液与 反应的现象除了溶液颜色变浅或褪色外,还有
反应的现象除了溶液颜色变浅或褪色外,还有实验②是为了验证
 的
的
您最近半年使用:0次
5 . 钠是一种活泼金属,其化合物在生产生活中具有广泛应用.
(1)下列有关钠及其化合物的说法正确的是___________.
(2)将一小块钠迅速投入到热坩埚中,发生反应的化学方程式为___________ .
(3)向酸性 溶液中加入
溶液中加入 粉末,观察到溶液紫色褪去,说明
粉末,观察到溶液紫色褪去,说明 具有一定的
具有一定的___________ (填“氧化性”、“还原性”或“漂白性”).
(4)下列试剂可以鉴别 溶液和
溶液和 溶液的是
溶液的是___________ .
A. 溶液 B.
溶液 B. 溶液 C.稀盐酸
溶液 C.稀盐酸
(5)在标准状况下,将 的
的 通入到
通入到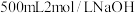 溶液中.
溶液中.
其中 的质量为
的质量为___________ 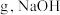 的物质的量为
的物质的量为___________  ,反应的离子方程式为
,反应的离子方程式为___________ .
(1)下列有关钠及其化合物的说法正确的是___________.
| A.钠元素在自然界中都以化合物的形式存在 | B.在实验室中少量钠保存在煤油中 |
C. 常用来治疗胃酸过多 常用来治疗胃酸过多 | D.热稳定性: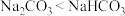 |
(3)向酸性
 溶液中加入
溶液中加入 粉末,观察到溶液紫色褪去,说明
粉末,观察到溶液紫色褪去,说明 具有一定的
具有一定的(4)下列试剂可以鉴别
 溶液和
溶液和 溶液的是
溶液的是A.
 溶液 B.
溶液 B. 溶液 C.稀盐酸
溶液 C.稀盐酸(5)在标准状况下,将
 的
的 通入到
通入到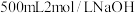 溶液中.
溶液中.其中
 的质量为
的质量为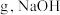 的物质的量为
的物质的量为 ,反应的离子方程式为
,反应的离子方程式为
您最近半年使用:0次
名校
6 . 钠是一种活泼金属,其化合物在生产生活中具有广泛应用。
(1)下列有关钠及其化合物的说法正确的是___________。
(2)下列试剂可以鉴别NaHCO3溶液和Na2CO3溶液的是___________。
(3)Na2O2因能与CO2反应可作潜水艇的供氧剂,涉及的反应方程式为___________ 。
(4)向酸性KMnO4溶液中加入Na2O2粉末,观察到溶液褪色,发生如下反应:___________
___________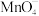 +___________Na2O2+___________=___________Mn2++___________Na++___________+___________
+___________Na2O2+___________=___________Mn2++___________Na++___________+___________
补全方程式并配平,该反应说明Na2O2粉末具有___________ (填“氧化性”“还原性”或“漂白性”)。
(5)将过氧化钠粉末投入到氯化亚铁溶液中,有关现象说法正确的是___________。
(6)向100mLNaOH溶液中通入一定量CO2,充分反应后,得到Na2CO3和NaHCO3的混合溶液。向上述所得溶液中,逐滴滴加2mol·L-1的盐酸,所得气体的体积与所加盐酸体积的关系如图所示。

①OA段发生反应的离子方程式为___________ 。
②混合溶液中Na2CO3和NaHCO3的物质的量之比为___________ 。
③原NaOH溶液的物质的量浓度为___________ mol/L。
(1)下列有关钠及其化合物的说法正确的是___________。
| A.少量钠保存在酒精中 | B.Na2O2是白色固体,性质不稳定 |
C.热稳定性: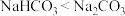 | D. 常用来治疗胃酸过多 常用来治疗胃酸过多 |
| A.Ba(OH)2 | B.NaOH溶液 | C.CaCl2溶液 | D.稀盐酸 |
(4)向酸性KMnO4溶液中加入Na2O2粉末,观察到溶液褪色,发生如下反应:
___________
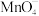 +___________Na2O2+___________=___________Mn2++___________Na++___________+___________
+___________Na2O2+___________=___________Mn2++___________Na++___________+___________补全方程式并配平,该反应说明Na2O2粉末具有
(5)将过氧化钠粉末投入到氯化亚铁溶液中,有关现象说法正确的是___________。
| A.生成红褐色沉淀 | B.没有气体产生 | C.生成白色沉淀 | D.有无色气体产生 |

①OA段发生反应的离子方程式为
②混合溶液中Na2CO3和NaHCO3的物质的量之比为
③原NaOH溶液的物质的量浓度为
您最近半年使用:0次
7 . 下列叙述前后没有因果关系的是
| A.氯气具有强氧化性,氯水可以漂白有色布条 |
| B.Al和Al2O3均能与酸、碱反应,不宜用来蒸煮或长时间存放酸性或碱性食物 |
| C.硬铝密度小、强度高、耐腐蚀,是制造飞机和宇宙飞船的理想材料 |
| D.碳酸钠和碳酸氢钠的溶液均显碱性,可用作食用碱或工业用碱 |
您最近半年使用:0次
2022-01-19更新
|
306次组卷
|
2卷引用:辽宁省五校2021-2022学年高一上学期期末联考化学试题
解题方法
8 . 某兴趣小组获得两包制作“跳跳糖”的添加剂,一包是柠檬酸晶体,另一包是标注为钠盐的白色粉末。将少量柠檬酸和这种白色粉末溶于水,混合后产生了能使澄清石灰水变浑浊的气体。于是对白色粉末的化学成分进行了以下探究:
【提出猜想】
猜想1.碳酸钠;猜想2.碳酸氢钠;猜想3.碳酸钠和碳酸氢钠。
【查阅资料】
碳酸钠溶液、碳酸氢钠溶液均呈碱性 。
【实验探究】
(1)小明、小磊分别对有关猜想设计实验方案并进行实验:
【交流反思】
(2)大家一致认为小明和小磊的结论不准确。
I.小明实验结论不准确的原因 是___________ 。
Ⅱ.小磊的实验方案不能 排除白色粉末中是否含有___________ 。
(3)下列关于Na2CO3和NaHCO3的说法中,正确的是___________ (填字母)。
A.Na2CO3和NaHCO3的溶液均显碱性
B.相同温度下,NaHCO3的溶解度大于Na2CO3
C.向等质量的Na2CO3和NaHCO3固体中分别滴加足量的盐酸,相同条件下产生CO2的体积也相同
(4)比较Na2CO3和NaHCO3的稳定性:Na2CO3的稳定性___________ (“强”或“弱”)于NaHCO3的稳定性。
【提出猜想】
猜想1.碳酸钠;猜想2.碳酸氢钠;猜想3.碳酸钠和碳酸氢钠。
【查阅资料】
碳酸钠溶液、碳酸氢钠溶液均呈
【实验探究】
(1)小明、小磊分别对有关猜想设计实验方案并进行实验:
| 学生 | 实验操作 | 实验现象 | 实验结论 |
| 小明 | 将白色粉末溶于水后用pH试纸测定其酸碱度 | pH | 溶液呈碱性,猜想1成立 |
| 小磊 | 用如图所示的装置进行实验: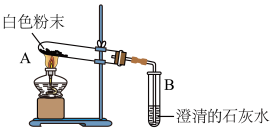 | 试管A中有水珠产生,试管B中液体变浑浊。 | 猜想2成立,试管A中反应的化学方程式为 |
【交流反思】
(2)大家一致认为小明和小磊的结论不准确。
I.小明实验结论不准确的
Ⅱ.小磊的实验方案
(3)下列关于Na2CO3和NaHCO3的说法中,正确的是
A.Na2CO3和NaHCO3的溶液均显碱性
B.相同温度下,NaHCO3的溶解度大于Na2CO3
C.向等质量的Na2CO3和NaHCO3固体中分别滴加足量的盐酸,相同条件下产生CO2的体积也相同
(4)比较Na2CO3和NaHCO3的稳定性:Na2CO3的稳定性
您最近半年使用:0次
19-20高一·全国·期末
解题方法
9 . 下列实验操作、现象和结论不正确的是
| 选项 | 实验操作 | 现象 | 结论 |
| A | 分别加热Na2CO3和NaHCO3固体 | 试管内壁均有水珠 | 两种物质均受热分解 |
| B | 向硅酸钠溶液中通入CO2 | 生成白色沉淀 | 酸性:碳酸强于硅酸 |
| C | 向含I-的无色溶液中滴加少量新制氯水,再滴加淀粉溶液 | 加入淀粉后溶液变成蓝色 | 氧化性:Cl2>I2 |
| D | 向FeSO4溶液中先滴入KSCN溶液,再滴加H2O2溶液 | 加入H2O2后溶液变成血红色 | Fe2+有还原性 |
| A.A | B.B | C.C | D.D |
您最近半年使用:0次
名校
解题方法
10 . Na2CO3和NaHCO3是两种常见的钠盐。
(1)某小组研究Na2CO3和NaHCO3的性质,实验如下。
①室温下,Na2CO3的溶解度大于NaHCO3的实验证据是________________________ 。
②根据两试管中的温度变化情况,可得出的结论是_______________ 。
③该实验不能说明Na2CO3溶液的碱性强于NaHCO3溶液,理由是_____________ 。
(2)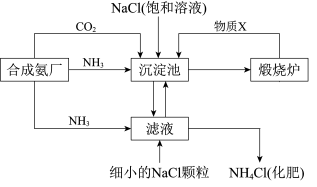
资料:
i.沉淀池中的反应为NaCl+CO2+NH3+H2O = NaHCO3↓+NH4Cl
ii.溶解度
①煅烧炉中反应的化学方程式是______________ ,物质X是_______ (填化学式)。
②下列说法正确的是________ (填字母)。
A.沉淀池中有NaHCO3析出,因为一定条件下NaHCO3的溶解度最小
B.滤液中主要含有NaCl、Na2CO3和NH4Cl
C.设计循环的目的是提高原料的利用率
③工业可用纯碱代替烧碱生产某些化工产品,如用饱和纯碱溶液与Cl2反应可制得一种在生产生活中常用于漂白、消毒的物质,同时有NaHCO3生成,该反应的化学方程式是____________________________________________ 。
(1)某小组研究Na2CO3和NaHCO3的性质,实验如下。
| 序号 | 操作 | Na2CO3 | NaHCO3 |
| I | 在两支试管中加入1g Na2CO3或1g NaHCO3,再加入5mL水,振荡;将温度计分别插入其中。 | 温度由17.6℃变为23.2℃,放置到室温时,试管内无固体 | 温度由17.6℃变为17.2℃,放置到室温时,试管内有少量固体残留 |
| Ⅱ | 室温时,分别向I所得溶液中滴入2滴酚酞溶液 | 溶液变红 | 溶液微红 |
②根据两试管中的温度变化情况,可得出的结论是
③该实验不能说明Na2CO3溶液的碱性强于NaHCO3溶液,理由是
(2)

资料:
i.沉淀池中的反应为NaCl+CO2+NH3+H2O = NaHCO3↓+NH4Cl
ii.溶解度
| 物质 | NaCl | NH4HCO3 | NaHCO3 | NH4Cl |
| 20℃溶解度/g | 36.0 | 21.7 | 9.6 | 37.2 |
②下列说法正确的是
A.沉淀池中有NaHCO3析出,因为一定条件下NaHCO3的溶解度最小
B.滤液中主要含有NaCl、Na2CO3和NH4Cl
C.设计循环的目的是提高原料的利用率
③工业可用纯碱代替烧碱生产某些化工产品,如用饱和纯碱溶液与Cl2反应可制得一种在生产生活中常用于漂白、消毒的物质,同时有NaHCO3生成,该反应的化学方程式是
您最近半年使用:0次



