名校
解题方法
1 . Ⅰ.现代工业常以氯化钠为原料制备纯碱,部分工艺流程如图:已知 在低温下溶解度较小。
在低温下溶解度较小。
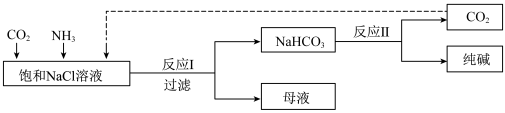
(1)一定温度下,往一定量饱和NaCl溶液中先通入___________ 达到饱和后,再不断通入另一种气体,一段时间后,出现沉淀,过滤得到 晶体。
晶体。
(2)得到的 晶体中可能含有少量NaCl、
晶体中可能含有少量NaCl、 等杂质,检验该晶体中是否含有氯离子杂质的操作方法是
等杂质,检验该晶体中是否含有氯离子杂质的操作方法是___________ 。
(3) 和
和 是两种常见的钠盐,
是两种常见的钠盐, 和
和 溶于水溶液均显
溶于水溶液均显___________ (填“酸性”、“中性”或“碱性”)。写出向饱和碳酸钠溶液中通入 的离子方程式
的离子方程式___________ 。
Ⅱ.工业纯碱中常含有少量NaCl,某校化学课外活动小组设计如图所示装置,测定工业纯碱中 的含量。
的含量。
(4)检验装置B气密性的方法是:塞紧带长颈漏斗的三孔橡胶塞,夹紧两侧弹簧夹后,从漏斗注入一定量的水,使漏斗内的水面高于瓶内的水面,停止加水后,若___________ ,说明装置不漏气。
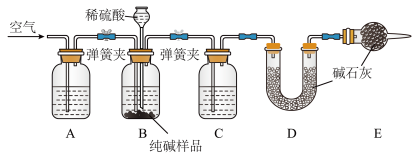
(5)装置A中的试剂为___________ ,装置C中的试剂为___________ 。
(6)实验前称取28.80g样品,实验后测得D装置增重8.80g,则样品中 的质量分数为
的质量分数为___________ (保留小数点后一位):若缺少E装置,会使测定结果___________ (填“偏高”或“偏低”)。
 在低温下溶解度较小。
在低温下溶解度较小。
(1)一定温度下,往一定量饱和NaCl溶液中先通入
 晶体。
晶体。(2)得到的
 晶体中可能含有少量NaCl、
晶体中可能含有少量NaCl、 等杂质,检验该晶体中是否含有氯离子杂质的操作方法是
等杂质,检验该晶体中是否含有氯离子杂质的操作方法是(3)
 和
和 是两种常见的钠盐,
是两种常见的钠盐, 和
和 溶于水溶液均显
溶于水溶液均显 的离子方程式
的离子方程式Ⅱ.工业纯碱中常含有少量NaCl,某校化学课外活动小组设计如图所示装置,测定工业纯碱中
 的含量。
的含量。(4)检验装置B气密性的方法是:塞紧带长颈漏斗的三孔橡胶塞,夹紧两侧弹簧夹后,从漏斗注入一定量的水,使漏斗内的水面高于瓶内的水面,停止加水后,若

(5)装置A中的试剂为
(6)实验前称取28.80g样品,实验后测得D装置增重8.80g,则样品中
 的质量分数为
的质量分数为
您最近一年使用:0次
2023-12-03更新
|
77次组卷
|
2卷引用:陕西省西安市碑林区教育局2023-2024学年高一上学期期中教育质量监测化学试题
2 . 碳酸钠和碳酸氢钠是生活中比较常见的两种物质。某学校的课外化学学习兴趣小组对两者性质进行探究,并测定碳酸钠和碳酸氢钠混合物中各成分的含量。
实验I:
(1)取两支试管分别加入各约1g的碳酸钠和碳酸氢钠固体,再分别加入几滴水振荡试管,用手触摸试管底部,温度较高的是_______ (填化学式,下同)。
(2)继续向两支试管中分别加入10mL水,充分振荡,最先溶解完全的是_______ ;再分别加入几滴酚酞试液,溶液变红,但颜色较浅的是_______ 。
实验II:碳酸钠和碳酸氢钠的热稳定性比较探究
(3)按图1组装好仪器(A为大试管,B为小试管)后,接下来的操作是_______ ,再往试管中添加药品,则试管A中盛放的药品是_______ ,澄清石灰水变浑浊的是_______ (填“a”或“b”)。
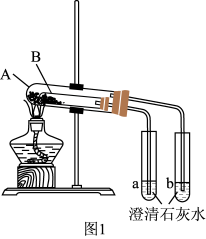
实验III:混合物中碳酸钠含量的测定
(4)为确定碳酸钠和碳酸氢钠混合物样品的组成,甲化学探究小组设计实验1:利用如图2所示的装置进行实验。
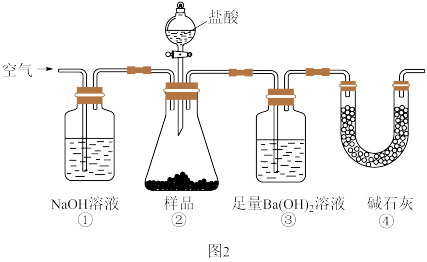
下列说法错误的是_______(填字母,单选)。
(5)乙化学探究小组设计实验2:取ag样品加热、冷却、称重,重复以上操作至样品固体质量不再变化,称量其质量为bg。样品中 质量分数为
质量分数为_______ ×100%(用a、b表示)。
(6)丙化学探究小组设计实验3:步骤ⅰ。称取一定量的混合物样品;步骤ⅱ。向其中逐滴滴入0.1000mol/L稀盐酸,记录生成的气体体积和滴入盐酸体积,如图3所示。
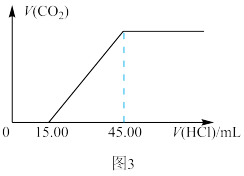
计算:①生成的 在标况下的体积为
在标况下的体积为_______ mL;
②该混合物中 的质量分数
的质量分数_______ %(保留两位小数)。
实验I:
(1)取两支试管分别加入各约1g的碳酸钠和碳酸氢钠固体,再分别加入几滴水振荡试管,用手触摸试管底部,温度较高的是
(2)继续向两支试管中分别加入10mL水,充分振荡,最先溶解完全的是
实验II:碳酸钠和碳酸氢钠的热稳定性比较探究
(3)按图1组装好仪器(A为大试管,B为小试管)后,接下来的操作是

实验III:混合物中碳酸钠含量的测定
(4)为确定碳酸钠和碳酸氢钠混合物样品的组成,甲化学探究小组设计实验1:利用如图2所示的装置进行实验。

下列说法错误的是_______(填字母,单选)。
A.滴入盐酸前,应先将装置中含有 的空气排尽 的空气排尽 |
B.装置①、④的作用是防止空气中的 进入装置③中 进入装置③中 |
C.在装置②、③间需添加盛有饱和 溶液的洗气瓶,以除去挥发的HCl气体 溶液的洗气瓶,以除去挥发的HCl气体 |
D.反应结束时,应继续通入空气将装置②中的 转移到装置③中 转移到装置③中 |
 质量分数为
质量分数为(6)丙化学探究小组设计实验3:步骤ⅰ。称取一定量的混合物样品;步骤ⅱ。向其中逐滴滴入0.1000mol/L稀盐酸,记录生成的气体体积和滴入盐酸体积,如图3所示。

计算:①生成的
 在标况下的体积为
在标况下的体积为②该混合物中
 的质量分数
的质量分数
您最近一年使用:0次
名校
3 . 某纯碱样品只含NaCl杂质,为测定样品中 的含量进行如下实验。
的含量进行如下实验。
实验Ⅰ:甲小组称取样品5.00g,采用如下实验装置进行实验。实验结束时,分离③中所得固体,称其质量为7.88g。

(1)装置①的作用是___________ 。
(2)装置②中反应的离子方程式为___________ 。
(3)下列说法不正确的是___________(填标号)。
(4)样品中 的质量分数为
的质量分数为____ 。
实验Ⅱ:乙小组称取样品ag,采用如图实验装置进行实验。
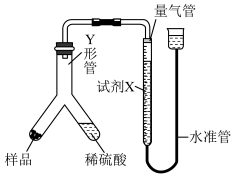
(5)试剂X应选择____ (填标号)。
A.饱和 溶液 B.饱和
溶液 B.饱和 溶液 C.饱和
溶液 C.饱和 溶液
溶液
(6)下列哪些因素会造成样品中 的含量偏低
的含量偏低___ (填标号)。
A.将稀硫酸替换为盐酸
B.读数时未冷却至室温
C.读数时水准管的液面高于量气管的液面
(7)实验结束时,所得气体体积为V mL。实验时的气体摩尔体积为 ,则样品
,则样品 的质量分数为
的质量分数为______ 。
 的含量进行如下实验。
的含量进行如下实验。实验Ⅰ:甲小组称取样品5.00g,采用如下实验装置进行实验。实验结束时,分离③中所得固体,称其质量为7.88g。

(1)装置①的作用是
(2)装置②中反应的离子方程式为
(3)下列说法不正确的是___________(填标号)。
| A.先通入空气一段时间,再滴加盐酸 |
| B.装置②、③间应增加除去HCl杂质的装置 |
| C.装置④的作用是吸收尾气,防止空气污染 |
| D.停止滴加盐酸后,还需继续通入空气一段时间 |
 的质量分数为
的质量分数为实验Ⅱ:乙小组称取样品ag,采用如图实验装置进行实验。

(5)试剂X应选择
A.饱和
 溶液 B.饱和
溶液 B.饱和 溶液 C.饱和
溶液 C.饱和 溶液
溶液(6)下列哪些因素会造成样品中
 的含量偏低
的含量偏低A.将稀硫酸替换为盐酸
B.读数时未冷却至室温
C.读数时水准管的液面高于量气管的液面
(7)实验结束时,所得气体体积为V mL。实验时的气体摩尔体积为
 ,则样品
,则样品 的质量分数为
的质量分数为
您最近一年使用:0次
名校
4 . 下列说法正确的是
① 投入到紫色石蕊试液中,溶液先变蓝,后褪色;
投入到紫色石蕊试液中,溶液先变蓝,后褪色;
②足量 和质量相等的
和质量相等的 在常温和加热条件下反应,转移的电子数相等;
在常温和加热条件下反应,转移的电子数相等;
③质量相等的 与
与 分别与足量的盐酸完全反应时,产生
分别与足量的盐酸完全反应时,产生 的质量相等;
的质量相等;
④取 与
与 的混合物与足量稀硫酸充分反应,逸出气体用碱石灰吸收,增重
的混合物与足量稀硫酸充分反应,逸出气体用碱石灰吸收,增重 ,能测定混合物中
,能测定混合物中 的质量分数;
的质量分数;
⑤鉴别 与
与 溶液,可用
溶液,可用 溶液;
溶液;
⑥除去 粉末中混有的
粉末中混有的 ,可配制成溶液通入过量的
,可配制成溶液通入过量的 ,再低温结晶。
,再低温结晶。
①
 投入到紫色石蕊试液中,溶液先变蓝,后褪色;
投入到紫色石蕊试液中,溶液先变蓝,后褪色;②足量
 和质量相等的
和质量相等的 在常温和加热条件下反应,转移的电子数相等;
在常温和加热条件下反应,转移的电子数相等;③质量相等的
 与
与 分别与足量的盐酸完全反应时,产生
分别与足量的盐酸完全反应时,产生 的质量相等;
的质量相等;④取
 与
与 的混合物与足量稀硫酸充分反应,逸出气体用碱石灰吸收,增重
的混合物与足量稀硫酸充分反应,逸出气体用碱石灰吸收,增重 ,能测定混合物中
,能测定混合物中 的质量分数;
的质量分数;⑤鉴别
 与
与 溶液,可用
溶液,可用 溶液;
溶液;⑥除去
 粉末中混有的
粉末中混有的 ,可配制成溶液通入过量的
,可配制成溶液通入过量的 ,再低温结晶。
,再低温结晶。| A.②③④ | B.①②⑥ | C.②④⑤ | D.③④⑥ |
您最近一年使用:0次
名校
5 . 某同学为研究 、
、 进行了如下实验:
进行了如下实验:
【实验一】配制 的
的 实验操作:
实验操作:
①将称量好的 固体放入小烧杯中,加适量蒸馏水溶解。为加速溶解可用玻璃棒搅拌。
固体放入小烧杯中,加适量蒸馏水溶解。为加速溶解可用玻璃棒搅拌。
②将①所得溶液冷却到室温后,小心转入___________(填仪器名称)中。
③用少量蒸馏水洗涤烧杯和玻璃棒2~3次,洗涤液都转入上述容器并摇匀。
④继续加蒸馏水至液面距刻度线1~2cm处,改用___________(填仪器名称),小心滴加蒸馏水至溶液凹液面最低点与刻度线相切。
⑤将容量瓶瓶塞塞紧,充分摇匀。
请回答下列问题:
(1)在以上实验操作的横线处填写正确答案___________ 、___________ 。
(2)计算需要无水 固体的质量
固体的质量___________ g;若无操作③会造成所配溶液浓度___________ (填“偏大”或“偏小”或“无影响”)。
(3)若用以上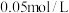 的
的 溶液配制
溶液配制 溶液。需要
溶液。需要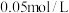 的
的 溶液
溶液___________ mL。
【实验二】
(4)室温下, 的溶解度大于
的溶解度大于 的实验证据是
的实验证据是___________ 。
(5)该实验___________ (填能或不能)说明 溶液的碱性强于
溶液的碱性强于 溶液,理由是
溶液,理由是___________ 。
【实验三】资料:pH越小, 越小,溶液碱性越弱。
越小,溶液碱性越弱。
(6)实验二中,向澄清石灰水滴加 溶液,
溶液, 未参与该反应的实验证据是
未参与该反应的实验证据是___________ 。
(7)实验二中,滴加 溶液的pH变化与滴加
溶液的pH变化与滴加 溶液的有明显差异,结合离子方程式说明原因
溶液的有明显差异,结合离子方程式说明原因___________ 。
(8)为测定 和
和 混合物中
混合物中 的质量分数,同学们取a g混合物充分加热,称量固体质量减少b g,则混合物中
的质量分数,同学们取a g混合物充分加热,称量固体质量减少b g,则混合物中 的质量分数是
的质量分数是___________ (用含a、b的代数式表示)。
 、
、 进行了如下实验:
进行了如下实验:【实验一】配制
 的
的 实验操作:
实验操作:①将称量好的
 固体放入小烧杯中,加适量蒸馏水溶解。为加速溶解可用玻璃棒搅拌。
固体放入小烧杯中,加适量蒸馏水溶解。为加速溶解可用玻璃棒搅拌。②将①所得溶液冷却到室温后,小心转入___________(填仪器名称)中。
③用少量蒸馏水洗涤烧杯和玻璃棒2~3次,洗涤液都转入上述容器并摇匀。
④继续加蒸馏水至液面距刻度线1~2cm处,改用___________(填仪器名称),小心滴加蒸馏水至溶液凹液面最低点与刻度线相切。
⑤将容量瓶瓶塞塞紧,充分摇匀。
请回答下列问题:
(1)在以上实验操作的横线处填写正确答案
(2)计算需要无水
 固体的质量
固体的质量(3)若用以上
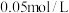 的
的 溶液配制
溶液配制 溶液。需要
溶液。需要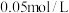 的
的 溶液
溶液【实验二】
| 序号 | 操作 |  |  |
| ① | 在两支试管中分别加入 、 、 ,再加入 ,再加入 水充分振荡;将两支温度计分别插入试管中 水充分振荡;将两支温度计分别插入试管中 | 温度由17.6℃变为23.2℃;放置到室温时,试管内无固体 | 温度由17.6℃变为17.2℃;放置到室温时,试管内有少量固体残留 |
| ② | 室温时,分别向①所得溶液中滴入2滴酚酞溶液 | 溶液变红 | 溶液微红 |
(4)室温下,
 的溶解度大于
的溶解度大于 的实验证据是
的实验证据是(5)该实验
 溶液的碱性强于
溶液的碱性强于 溶液,理由是
溶液,理由是【实验三】资料:pH越小,
 越小,溶液碱性越弱。
越小,溶液碱性越弱。| 实验操作 | 实验数据 |
测量下述实验过程的pH变化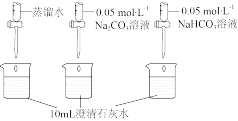 | 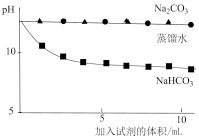 |
(6)实验二中,向澄清石灰水滴加
 溶液,
溶液, 未参与该反应的实验证据是
未参与该反应的实验证据是(7)实验二中,滴加
 溶液的pH变化与滴加
溶液的pH变化与滴加 溶液的有明显差异,结合离子方程式说明原因
溶液的有明显差异,结合离子方程式说明原因(8)为测定
 和
和 混合物中
混合物中 的质量分数,同学们取a g混合物充分加热,称量固体质量减少b g,则混合物中
的质量分数,同学们取a g混合物充分加热,称量固体质量减少b g,则混合物中 的质量分数是
的质量分数是
您最近一年使用:0次
2023-12-19更新
|
36次组卷
|
2卷引用:福建省厦门大学附属科技中学2023-2024学年高一上学期11月期中考试化学试题
名校
6 . 烧碱、纯碱、小苏打等都是重要的化工原料。
(1)取Na2CO3和NaHCO3两种固体各2g,分别放入两个小烧杯中加10mL蒸馏水,振荡,测量温度变化;其中盛放NaHCO3的烧杯中溶液温度_______ (填“升高或降低”)。
(2)探究两者热稳定性的“套管实验”的实验装置如图所示:
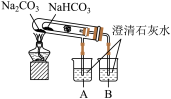
①写出实验过程中试管中发生反应的化学方程式:___________ 。
②证明热稳定性的实验装置中,能否将NaHCO3、Na2CO3的位置互换?_____ (填“能”或“不能”)。
(3)利用如图装置可以证明二氧化碳与烧碱溶液发生了反应。
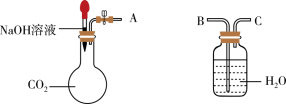
①若将A与B连接,打开止水夹,将胶头滴管中的液体挤入烧瓶,此时的实验现象是_______ ,开始反应时的离子方程式是________ 。
②若其他操作不变,将A与C连接,可观察到的现象是_______ 。
(4)某校化学课外小组根据图Ⅰ、Ⅱ所示实验鉴别碳酸钠和碳酸氢钠两种白色固体,能够达到实验目的的是___________ (填装置序号);采用图Ⅲ可测定碳酸钠样品中混有的碳酸氢钠的质量分数,若加热 5.00g 样品,使碳酸氢钠完全分解,混合物的质量减少了0.31g,则样品中碳酸氢钠的质量分数为_______ 。

(1)取Na2CO3和NaHCO3两种固体各2g,分别放入两个小烧杯中加10mL蒸馏水,振荡,测量温度变化;其中盛放NaHCO3的烧杯中溶液温度
(2)探究两者热稳定性的“套管实验”的实验装置如图所示:

①写出实验过程中试管中发生反应的化学方程式:
②证明热稳定性的实验装置中,能否将NaHCO3、Na2CO3的位置互换?
(3)利用如图装置可以证明二氧化碳与烧碱溶液发生了反应。

①若将A与B连接,打开止水夹,将胶头滴管中的液体挤入烧瓶,此时的实验现象是
②若其他操作不变,将A与C连接,可观察到的现象是
(4)某校化学课外小组根据图Ⅰ、Ⅱ所示实验鉴别碳酸钠和碳酸氢钠两种白色固体,能够达到实验目的的是

您最近一年使用:0次
名校
7 . 某实验小组同学为了鉴别碳酸钠和碳酸氢钠,进行了如下实验。

(1)实验Ⅰ—Ⅲ中能鉴别碳酸钠和碳酸氢钠的是_______ (填序号)。
(2)若将实验Ⅲ改为分别向A、B的溶液中逐滴滴加稀盐酸,其中A溶液开始无气泡产生,一段时间后产生气泡,则A为_______ (填物质名称),反应过程的离子方程式为_______ 、_______ 。
(3)若有碳酸钠和碳酸氢钠固体混合物6.48 g,为除去碳酸钠固体中的碳酸氢钠杂质,可对混合物进行加热,发生反应的化学方程式为_______ ,若将混合物加热至质量不再变化时,剩余固体质量为5.24 g,则原混合固体中碳酸钠的质量分数为_______ %(保留小数点后2位)。

(1)实验Ⅰ—Ⅲ中能鉴别碳酸钠和碳酸氢钠的是
(2)若将实验Ⅲ改为分别向A、B的溶液中逐滴滴加稀盐酸,其中A溶液开始无气泡产生,一段时间后产生气泡,则A为
(3)若有碳酸钠和碳酸氢钠固体混合物6.48 g,为除去碳酸钠固体中的碳酸氢钠杂质,可对混合物进行加热,发生反应的化学方程式为
您最近一年使用:0次
解题方法
8 . I.为比较Na2CO3和NaHCO3的热稳定性,某同学设计了如下实验装置。实验时,先检查装置的气密性,再取少量Na2CO3粉末加在大试管的底部,另取少量NaHCO3粉末加在小试管底部。预热后在大试管底部加热。
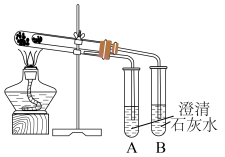
回答下列问题:
(1)小试管中放置___________ 药品(填化学名称)。
(2)开始加热一段时间后,试管___________ (填“A”或“B”)中会出现浑浊现象。实验现象证明,加热条件下,Na2CO3比NaHCO3更___________ (填“稳定”或“不稳定”)。
II.为确定碳酸钠和碳酸氢钠混合样品中碳酸钠的质量分数,可通过加热分解得到的CO2质量进行计算,某同学设计的实验装置示意图如下,请回答:
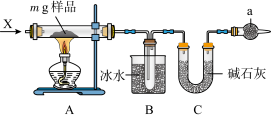
(3)仪器a的名称是___________ 。
(4)装置B中冰水的作用是___________ 。
(5)该同学设计的实验装置存在缺陷,有关该实验装置及实验过程中,下列因素可能使碳酸钠的质量分数偏高的是___________。

回答下列问题:
(1)小试管中放置
(2)开始加热一段时间后,试管
II.为确定碳酸钠和碳酸氢钠混合样品中碳酸钠的质量分数,可通过加热分解得到的CO2质量进行计算,某同学设计的实验装置示意图如下,请回答:

(3)仪器a的名称是
(4)装置B中冰水的作用是
(5)该同学设计的实验装置存在缺陷,有关该实验装置及实验过程中,下列因素可能使碳酸钠的质量分数偏高的是___________。
| A.样品分解不完全 |
| B.装置B、C之间缺少CO2的干燥装置 |
| C.产生CO2气体的速率太快,没有被碱石灰完全吸收 |
| D.反应完全后停止加热,通入过量的空气 |
您最近一年使用:0次
9 . 下列说法正确的是
①Na2O2投入到紫色石蕊试液中,溶液先变蓝,后褪色;
②质量相等的NaHCO3与Na2CO3分别与相同浓度盐酸完全反应时,产生CO2的物质的量相等;
③取a g Na2CO3和NaHCO3混合物与足量稀硫酸充分反应,逸出气体用碱石灰吸收,增重b g,能测定Na2CO3和NaHCO3混合物中Na2CO3质量分数;
④区别NaHCO3与Na2CO3溶液,可用Ca(OH)2溶液;
⑤NaHCO3固体可以做干粉灭火剂,金属钠起火可以用它来灭火;
⑥等浓度的NaHCO3和Na2CO3,分别与等浓度的盐酸反应,NaHCO3溶液的速率快。
①Na2O2投入到紫色石蕊试液中,溶液先变蓝,后褪色;
②质量相等的NaHCO3与Na2CO3分别与相同浓度盐酸完全反应时,产生CO2的物质的量相等;
③取a g Na2CO3和NaHCO3混合物与足量稀硫酸充分反应,逸出气体用碱石灰吸收,增重b g,能测定Na2CO3和NaHCO3混合物中Na2CO3质量分数;
④区别NaHCO3与Na2CO3溶液,可用Ca(OH)2溶液;
⑤NaHCO3固体可以做干粉灭火剂,金属钠起火可以用它来灭火;
⑥等浓度的NaHCO3和Na2CO3,分别与等浓度的盐酸反应,NaHCO3溶液的速率快。
| A.①⑥ | B.②⑤ | C.②④ | D.③④ |
您最近一年使用:0次
名校
10 . 我国化学家侯德榜发明的“联合制碱法”为世界制碱工业做出了巨大贡献。下图为联合制碱法的主要过程(部分物质已略去)。

资料:ⅰ.沉淀池中的反应为
ⅱ.溶解度
(1)煅烧炉中反应的化学方程式是___________ ,物质X是___________ (填化学式)。
(2)下列说法正确的是___________ (填字母)。
A.沉淀池中有 析出,因为一定条件下
析出,因为一定条件下 的溶解度最小
的溶解度最小
B.滤液中主要含有NaCl、 和
和
C.设计循环的目的是提高原料的利用率
(3)工业可用纯碱代替烧碱生产某些化工产品,如用饱和纯碱溶液与 反应可制得一种在生产生活中常用于漂白、消毒的物质,同时有
反应可制得一种在生产生活中常用于漂白、消毒的物质,同时有 生成,该反应的化学方程式是
生成,该反应的化学方程式是___________ 。
(4)某纯碱样品中含杂质NaCl,取质量为a g的样品,加入足量的稀盐酸,充分反应后,加热、蒸干、灼烧,得到b g固体物质,则此样品中 的质量分数为
的质量分数为___________ 。
(5)检验纯碱样品中是否含杂质NaCl的方法为___________ 。

资料:ⅰ.沉淀池中的反应为

ⅱ.溶解度
| 物质 | NaCl |  |  |  |
| 20℃溶解度/g | 36.0 | 21.7 | 9.6 | 37.2 |
(1)煅烧炉中反应的化学方程式是
(2)下列说法正确的是
A.沉淀池中有
 析出,因为一定条件下
析出,因为一定条件下 的溶解度最小
的溶解度最小B.滤液中主要含有NaCl、
 和
和
C.设计循环的目的是提高原料的利用率
(3)工业可用纯碱代替烧碱生产某些化工产品,如用饱和纯碱溶液与
 反应可制得一种在生产生活中常用于漂白、消毒的物质,同时有
反应可制得一种在生产生活中常用于漂白、消毒的物质,同时有 生成,该反应的化学方程式是
生成,该反应的化学方程式是(4)某纯碱样品中含杂质NaCl,取质量为a g的样品,加入足量的稀盐酸,充分反应后,加热、蒸干、灼烧,得到b g固体物质,则此样品中
 的质量分数为
的质量分数为(5)检验纯碱样品中是否含杂质NaCl的方法为
您最近一年使用:0次



