名校
1 . 高铁酸钾(K2FeO4)是一种新型绿色、高效的水处理剂,对病毒的去除率可达99.95%。某兴趣小组设计如下实验制备K2FeO4并探究其性质。
已知:①K2FeO4为紫色固体,微溶于KOH溶液;
② 具有强氧化性,在酸性或中性溶液中能快速产生O2,在碱性溶液中较稳定。
具有强氧化性,在酸性或中性溶液中能快速产生O2,在碱性溶液中较稳定。
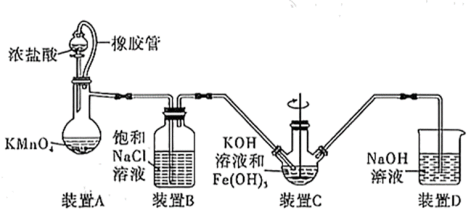
(1)制备K2FeO4(夹持装置略)
①如图所示,A为氯气发生装置,装置A中盛放KMnO4的仪器名称是_______ 。
②装置B的作用是_______ 。
③装置C中的KOH溶液需过量,目的是________ 。
④C中得到紫色固体和溶液。则C中Cl2与Fe(OH)3发生反应生成K2FeO4的离子方程式为______
(2)探究K2FeO4的性质甲同学取装置C中紫色溶液,加入稀硫酸,产生黄绿色气体,经检验气体中含有Cl2。该现象______ (填“能”或“不能”)证明“酸性条件下 氧化性强于Cl2”,并说明理由:
氧化性强于Cl2”,并说明理由:______ 。
(3)测定K2FeO4的产率若在制备装置C中加入Fe(OH)3的质量为10.7g,充分反应后经过滤、洗涤、干燥得K2FeO4固体9.9g,则K2FeO4的产率为________ 。
已知:①K2FeO4为紫色固体,微溶于KOH溶液;
②
 具有强氧化性,在酸性或中性溶液中能快速产生O2,在碱性溶液中较稳定。
具有强氧化性,在酸性或中性溶液中能快速产生O2,在碱性溶液中较稳定。
(1)制备K2FeO4(夹持装置略)
①如图所示,A为氯气发生装置,装置A中盛放KMnO4的仪器名称是
②装置B的作用是
③装置C中的KOH溶液需过量,目的是
④C中得到紫色固体和溶液。则C中Cl2与Fe(OH)3发生反应生成K2FeO4的离子方程式为
(2)探究K2FeO4的性质甲同学取装置C中紫色溶液,加入稀硫酸,产生黄绿色气体,经检验气体中含有Cl2。该现象
 氧化性强于Cl2”,并说明理由:
氧化性强于Cl2”,并说明理由:(3)测定K2FeO4的产率若在制备装置C中加入Fe(OH)3的质量为10.7g,充分反应后经过滤、洗涤、干燥得K2FeO4固体9.9g,则K2FeO4的产率为
您最近一年使用:0次
2021-09-28更新
|
638次组卷
|
4卷引用:山东省济宁市邹城市孟子湖中学2021-2022学年高三下学期开学考试化学试题
山东省济宁市邹城市孟子湖中学2021-2022学年高三下学期开学考试化学试题江苏省海安市南莫中学2022届高三上学期第一次月考备考金卷B卷化学试题内蒙古海拉尔第二中学2021-2022学年高三上学期第一次阶段考化学试题(已下线)押新高考卷16题 化学实验综合题-备战2022年高考化学临考题号押题(新高考通版)
名校
2 . 某品牌糖衣片补血剂,除去糖衣后显淡蓝绿色,主要成分是硫酸亚铁,不含其他铁的化合物。某研究性学习小组为测定该补血剂中硫酸亚铁的含量进行了如图甲的探究。
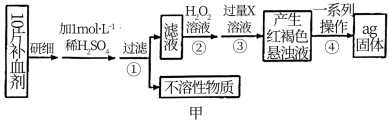
请回答下列问题。
Ⅰ.实验时用10 浓硫酸配制100 mL 1
浓硫酸配制100 mL 1 
 溶液。
溶液。
(1)需用量筒量取_______ mL上述浓硫酸进行配制。
(2)所需的实验仪器有①胶头滴管、②烧杯、③量筒、④玻璃棒,配制稀硫酸时,还缺少的玻璃仪器是_______ ,该仪器所具备的功能是_______ (填字母)。
A.配制一定体积准确浓度的溶液
B.长期贮存溶液
C.常用来代替量筒量取一定体积的液体
D.用来溶解固体溶质
(3)在图乙配制过程示意图中,错误的有_______ (填序号)。
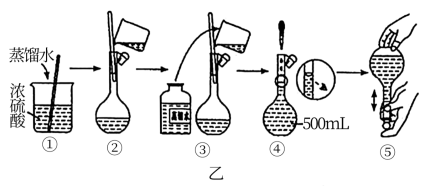
(4)下列操作导致所配制的稀硫酸的物质的量浓度偏低的是_______ (填字母)。
A.用量筒量取浓硫酸时俯视凹液面
B.将浓硫酸稀释后未冷却至室温便将溶液转移至容量瓶定容
C.容量瓶用蒸馏水洗后未干燥
D.定容时仰视液面
E.未洗涤烧杯和玻璃棒
F.转移到容量瓶的过程中,有少量的溶液溅出
G.用量筒量取浓硫酸倒入小烧杯后,用蒸馏水洗涤量筒并将洗涤液转移至小烧杯中
H.用不干燥的量筒量取浓硫酸
(5)步骤③中产生的红褐色物质是_______ (填化学式)。
(6)从红褐色的悬浊液得到固体,需经过的一系列操作为a._______ ,b.洗涤,c.灼烧,d.冷却。
(7)若称得固体的质量为ag,则每片补血剂中含硫酸亚铁的质量为_______ g。

请回答下列问题。
Ⅰ.实验时用10
 浓硫酸配制100 mL 1
浓硫酸配制100 mL 1 
 溶液。
溶液。(1)需用量筒量取
(2)所需的实验仪器有①胶头滴管、②烧杯、③量筒、④玻璃棒,配制稀硫酸时,还缺少的玻璃仪器是
A.配制一定体积准确浓度的溶液
B.长期贮存溶液
C.常用来代替量筒量取一定体积的液体
D.用来溶解固体溶质
(3)在图乙配制过程示意图中,错误的有

(4)下列操作导致所配制的稀硫酸的物质的量浓度偏低的是
A.用量筒量取浓硫酸时俯视凹液面
B.将浓硫酸稀释后未冷却至室温便将溶液转移至容量瓶定容
C.容量瓶用蒸馏水洗后未干燥
D.定容时仰视液面
E.未洗涤烧杯和玻璃棒
F.转移到容量瓶的过程中,有少量的溶液溅出
G.用量筒量取浓硫酸倒入小烧杯后,用蒸馏水洗涤量筒并将洗涤液转移至小烧杯中
H.用不干燥的量筒量取浓硫酸
(5)步骤③中产生的红褐色物质是
(6)从红褐色的悬浊液得到固体,需经过的一系列操作为a.
(7)若称得固体的质量为ag,则每片补血剂中含硫酸亚铁的质量为
您最近一年使用:0次
2021-09-22更新
|
205次组卷
|
2卷引用:山东省德州市第一中学2023-2024学年高三上学期开学考试化学试题
解题方法
3 . 下列离子方程式表达正确的是
| A.氢氧化铁溶于氢碘酸:Fe(OH)3+3H+=Fe3++3H2O |
B.小苏打溶液呈碱性的原因: +H2O⇌H3O++ +H2O⇌H3O++ |
| C.溴化亚铁溶液中通入足量氯气:2Fe2++4Br-+3Cl2=2Fe3++2Br2+6Cl- |
D.向硫酸铝铵[NH4Al(SO4)2]溶液中滴加少量Ba(OH)2溶液: +Al3++2 +Al3++2 +2Ba2++5OH-= +2Ba2++5OH-= +2BaSO4↓+NH3·H2O+2H2O +2BaSO4↓+NH3·H2O+2H2O |
您最近一年使用:0次
2020-08-27更新
|
164次组卷
|
3卷引用:山东省济宁市实验中学2022届高三上学期开学考试化学试题
名校
解题方法
4 . 铁屑溶于过量稀硫酸,过滤后向滤液中加入过量氨水,有白色沉淀生成,过滤,在空气中加热沉淀至质量不再发生变化为止,得到红棕色残渣,上述沉淀和残渣分别是( )
| A.Fe(OH)3 Fe2O3 | B.Fe(OH)2 Fe2O3 |
| C.Fe(OH)2 Fe(OH)3 | D.Fe(OH)2 FeO |
您最近一年使用:0次
2018-09-09更新
|
367次组卷
|
3卷引用:山东省淄博市淄川中学2019届高三上学期开学考试化学试题
山东省淄博市淄川中学2019届高三上学期开学考试化学试题(已下线)专题3.2 铁及其化合物 -巅峰冲刺山东省2020年高考化学一轮考点扫描《2020年新高考政策解读与配套资源》重庆市云阳江口中学校2021届高三上学期第三次月考化学试题



