名校
1 . 下列过程能达到实验目的的是
选项 | 实验目的 | 实验过程 |
A | 检验某铁的氧化物含有二价铁 | 将该氧化物溶于浓盐酸,滴入KMnO4溶液紫色褪去 |
B | 检验乙醇中含有水 | 向乙醇中加入一小粒钠,产生无色气体 |
C | 除去氯气中的氯化氢气体 | 将氯气先通过饱和食盐水再通过浓硫酸 |
D | 制备Fe(OH)3胶体 | 将NaOH溶液滴加到饱和FeCl3溶液中 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2023-10-10更新
|
303次组卷
|
4卷引用:中国人民大学附属中学2023-2024学年高三上学期10月月考化学试题
名校
2 . 根据下列实验操作和现象所得结论正确的是
| 选项 | 实验操作 | 现象 | 结论 |
| A | 将 Cl₂通入品红溶液 | 溶液红色褪去 | Cl₂具有漂白性 |
| B | 向某溶液中滴加几滴氯水,再滴加KSCN溶液 | 溶液变红 | 原溶液中有Fe2+ |
| C | 向Ca(ClO)2溶液中通入SO2气体 | 有沉淀生成 | 酸性:H2SO3>HClO |
| D | 向Al(OH)3沉淀中分别滴加足量盐酸或NaOH溶液 | 沉淀均溶解 | Al(OH)3是两性氢氧化物,Al 表现一定的非金属性 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2023-12-14更新
|
445次组卷
|
2卷引用:北京市朝阳区2023-2024学年高三上学期期中考试化学试题
名校
3 . 下列关于物质保存的解释,反应方程式不正确 的是
A.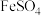 溶液中放入铁粉: 溶液中放入铁粉: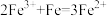 |
B.浓硝酸保存于棕色试剂瓶: |
C.氮肥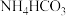 保存于阴凉处: 保存于阴凉处: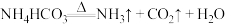 |
D.金属钠保存于煤油中: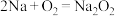  |
您最近一年使用:0次
2022-03-25更新
|
616次组卷
|
6卷引用:北京市丰台区2022届高三一模化学试题
北京市丰台区2022届高三一模化学试题北京市房山区2023届高三一模考试化学试题(已下线)专题04 离子反应(已下线)必刷卷02-2022年高考化学考前信息必刷卷(河北专用)安徽省示范高中培优联盟2021-2022学年高一下学期春季联赛考试化学试题福建省德华市第一中学2024届高三下学期5月适应性练习化学试题
4 . 人体内铁元素以 和
和 的形式存在,
的形式存在, 易被吸收,所以给贫血者补充铁元素时,应补充亚铁盐。“速力菲”(主要成分:琥珀酸亚铁,呈暗黄色)是市场上一种常见的补铁药物。该药品
易被吸收,所以给贫血者补充铁元素时,应补充亚铁盐。“速力菲”(主要成分:琥珀酸亚铁,呈暗黄色)是市场上一种常见的补铁药物。该药品不溶于水但能溶于胃酸 。某同学为了检测“速力菲”药片中 的存在,设计并进行了如下实验:
的存在,设计并进行了如下实验:

(1)试剂1可选择_______ 。
(2)加入试剂2为了验证 是否被氧化,试剂2选择
是否被氧化,试剂2选择_______ 。
(3)一般在服用“速力菲”时,同时服用维生素C,将不易吸收的 转化为
转化为 ,说明维生素C具有
,说明维生素C具有_______ 性。
(4)加入新制氯水,溶液中发生反应的离子方程式是_______ 。
(5)不仅溶液中 易被氧化成
易被氧化成 ,溶液中白色絮状沉淀
,溶液中白色絮状沉淀 更易被氧化,请写出
更易被氧化,请写出 在空气中被
在空气中被 氧化的化学方程式是
氧化的化学方程式是_______ ,沉淀转化过程的现象是_______ 。
 和
和 的形式存在,
的形式存在, 易被吸收,所以给贫血者补充铁元素时,应补充亚铁盐。“速力菲”(主要成分:琥珀酸亚铁,呈暗黄色)是市场上一种常见的补铁药物。该药品
易被吸收,所以给贫血者补充铁元素时,应补充亚铁盐。“速力菲”(主要成分:琥珀酸亚铁,呈暗黄色)是市场上一种常见的补铁药物。该药品 的存在,设计并进行了如下实验:
的存在,设计并进行了如下实验:
(1)试剂1可选择
(2)加入试剂2为了验证
 是否被氧化,试剂2选择
是否被氧化,试剂2选择(3)一般在服用“速力菲”时,同时服用维生素C,将不易吸收的
 转化为
转化为 ,说明维生素C具有
,说明维生素C具有(4)加入新制氯水,溶液中发生反应的离子方程式是
(5)不仅溶液中
 易被氧化成
易被氧化成 ,溶液中白色絮状沉淀
,溶液中白色絮状沉淀 更易被氧化,请写出
更易被氧化,请写出 在空气中被
在空气中被 氧化的化学方程式是
氧化的化学方程式是
您最近一年使用:0次
2023-01-07更新
|
283次组卷
|
4卷引用:北京市石景山区2022-2023学年高一上学期期末考试化学试题
北京市石景山区2022-2023学年高一上学期期末考试化学试题第2课时 铁盐和亚铁盐(已下线)【精品卷】3.1.2 铁的重要化合物课堂例题-人教版2023-2024学年必修第一册天津市武清区黄花店中学2023-2024学年高一上学期第二次形成性练习化学试题
名校
5 . 甲、乙两同学用下图所示装置进行实验,探究硝酸与铁反应的产物。

文献记载:
Ⅰ.在浓硝酸和活泼金属反应过程中,随着硝酸浓度降低,其生成的产物有+4、+2、-3价等氮的化合物。
Ⅱ.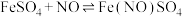 (棕色)
(棕色)
Ⅲ. 和NO都能被
和NO都能被 氧化吸收。
氧化吸收。
甲的实验操作和现象记录如下:
请回答下列问题:
(1)滴入浓硝酸加热前没有明显现象的原因是_______ 。
(2)检验是否生成-3价氮的化合物,应进行的实验操作是_______ 。
(3)甲取少量B中溶液,加热,实验现象是棕色溶液变浅,无色气体逸出,且在空气中变为红棕色。请用解释产生该现象的原因:_______ 。甲依据该现象得出的结论是A中有NO生成。
(4)乙认为甲得出A中有NO生成的证据不足。为获取充足的证据,乙仍采用该装置和操作进行对照实验,乙作出的改变是_______ ,证明有NO生成的实验现象是_______ 。
(5)证明A溶液中是否含有 和
和 ,选择的药品是(填序号)
,选择的药品是(填序号)_______ 。
a.铁粉 b.溴水 c.铁氰化钾溶液 d.硫氰化钾溶液

文献记载:
Ⅰ.在浓硝酸和活泼金属反应过程中,随着硝酸浓度降低,其生成的产物有+4、+2、-3价等氮的化合物。
Ⅱ.
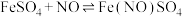 (棕色)
(棕色)Ⅲ.
 和NO都能被
和NO都能被 氧化吸收。
氧化吸收。甲的实验操作和现象记录如下:
| 实验操作 | 实验现象 |
打开弹簧夹,通入一段时间 ,关闭弹簧夹。 ,关闭弹簧夹。 | |
| 打开分液漏斗活塞,将浓硝酸缓慢滴入烧瓶中,关闭活塞。 | 无明显现象。 |
| 加热烧瓶,反应开始后停止加热。 | ①A中有红棕色气体产生,一段时间后,气体颜色逐渐变浅;B中溶液变棕色;C中溶液紫色变浅。 ②反应停止后,A中无固体剩余。 |
(1)滴入浓硝酸加热前没有明显现象的原因是
(2)检验是否生成-3价氮的化合物,应进行的实验操作是
(3)甲取少量B中溶液,加热,实验现象是棕色溶液变浅,无色气体逸出,且在空气中变为红棕色。请用解释产生该现象的原因:
(4)乙认为甲得出A中有NO生成的证据不足。为获取充足的证据,乙仍采用该装置和操作进行对照实验,乙作出的改变是
(5)证明A溶液中是否含有
 和
和 ,选择的药品是(填序号)
,选择的药品是(填序号)a.铁粉 b.溴水 c.铁氰化钾溶液 d.硫氰化钾溶液
您最近一年使用:0次
名校
6 . 下列各组离子在给定条件下能大量共存的是
A.含有大量ClO‒的溶液:K+、H+、Cl‒、SO |
B.澄清透明的溶液中:Cu2+、Na+、SO 、NO 、NO |
C.遇铝能产生H2的溶液:NH 、K+、Cl‒、CO 、K+、Cl‒、CO |
D.使紫色石蕊溶液呈红色的溶液:Mg2+、Fe2+、SO 、NO 、NO |
您最近一年使用:0次
2024-04-27更新
|
257次组卷
|
2卷引用:北师大附属实验中学2023-2024学年度第二学期期中试卷
7 . 下列“实验结论”与“实验操作及现象”相符的一组是
| 选项 | 实验操作及现象 | 实验结论 |
| A | 向某溶液中加入浓NaOH溶液,加热,产生能使湿润的红色石蕊试纸变蓝的气体 | 原溶液中一定含有 |
| B | 向某溶液中滴加AgNO3溶液,产生白色沉淀 | 原溶液中一定含有Cl- |
| C | 向某溶液中滴加酸性KMnO4溶液,紫色褪去 | 原溶液中一定含Fe2+ |
| D | 向某溶液中加入盐酸产生无色气体,该气体能使澄清石灰水变浑浊 | 原溶液中一定有 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2022-01-14更新
|
358次组卷
|
2卷引用:北京市海淀区2021-2022学年高一上学期期末参考样题化学试题
名校
解题方法
8 . 下列“实验结论”与“实验操作及现象”不相符 的一组是
| 选项 | 实验操作及现象 | 实验结论 |
| A | 向某溶液中加入足量稀盐酸,无明显现象;再加入BaCl2溶液,有白色沉淀产生 | 原溶液中一定含有 |
| B | 某溶液中滴加KSCN溶液,无明显现象;再滴加氯水,溶液呈红色 | 原溶液一定含Fe2+ |
| C | 向某溶液中加入AgNO3溶液,有白色沉淀生成 | 该溶液中一定含有Cl- |
| D | 向某溶液中加入浓NaOH溶液,加热,产生能使湿润的红色石蕊试纸变蓝的气体 | 该溶液中一定含有 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2021-01-24更新
|
697次组卷
|
5卷引用:北京市丰台区2020-2021学年高一上学期期末考试化学试题
名校
解题方法
9 . 常温下,下列各组离子能大量共存的是
A. 的溶液中: 的溶液中: 、 、 、 、 、 、 |
B.无色溶液中: 、 、 、 、 、 、 |
C.加入酚酞显红色的溶液中: 、 、 、 、 、 、 |
D.加入石蕊变蓝的溶液中: 、 、 、 、 、 、 |
您最近一年使用:0次
2023-03-18更新
|
351次组卷
|
4卷引用:北京育才学校2022-2023学年高一下学期3月月考化学试题
名校
解题方法
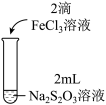
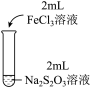
10 . 某实验小组对Na2S2O3分别与FeCl3、Fe2(SO4)3的反应进行实验探究。
实验药品:0.1mol/LNa2S2O3溶液(pH=7);0.1mol/LFeCl3溶液(pH=1);0.05mol/LFe2(SO4)3溶液(pH=1)。
实验过程
资料:ⅰ.Na2S2O3在酸性条件下不稳定,发生自身氧化还原反应;
ⅱ.Fe3++ ⇌Fe(S2O3)+(暗紫色),Fe2+遇
⇌Fe(S2O3)+(暗紫色),Fe2+遇 无明显现象
无明显现象
(1)配制FeCl3溶液时,需要用盐酸酸化,结合离子方程式解释原因:_______ 。
(2)对实验Ⅰ中现象产生的原因探究如下:
①证明有Fe2+生成:取实验Ⅰ中褪色后溶液,加入1~2滴K3[Fe(CN)6]溶液,观察到_______ 。
②实验I中紫色褪去时 被氧化成
被氧化成 ,相关反应的离子方程式是
,相关反应的离子方程式是_______ 。
③实验I和Ⅱ对比,Ⅰ中出现淡黄色浑浊,而Ⅱ中不出现淡黄色浑浊的原因是_______ 。
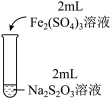
(3)为探究实验Ⅱ和Ⅲ中紫色褪去快慢不同的原因,设计实验如下:
①试剂X是_______ 。
②由实验Ⅳ和实验Ⅴ得出的结论是_______ 。
实验药品:0.1mol/LNa2S2O3溶液(pH=7);0.1mol/LFeCl3溶液(pH=1);0.05mol/LFe2(SO4)3溶液(pH=1)。
实验过程
| 实验编号 | Ⅰ | Ⅱ | Ⅲ |
| 实验操作 |
|
|
|
| 实验现象 | 溶液呈紫色, 静置后紫色迅速褪去, 久置后出现淡黄色浑浊 | 溶液呈紫色, 静置后紫色褪去, 久置后不出现淡黄色浑浊 | 溶液呈紫色, 静置后紫色缓慢褪去, 久置后不出现淡黄色浑浊 |
ⅱ.Fe3++
 ⇌Fe(S2O3)+(暗紫色),Fe2+遇
⇌Fe(S2O3)+(暗紫色),Fe2+遇 无明显现象
无明显现象(1)配制FeCl3溶液时,需要用盐酸酸化,结合离子方程式解释原因:
(2)对实验Ⅰ中现象产生的原因探究如下:
①证明有Fe2+生成:取实验Ⅰ中褪色后溶液,加入1~2滴K3[Fe(CN)6]溶液,观察到
②实验I中紫色褪去时
 被氧化成
被氧化成 ,相关反应的离子方程式是
,相关反应的离子方程式是③实验I和Ⅱ对比,Ⅰ中出现淡黄色浑浊,而Ⅱ中不出现淡黄色浑浊的原因是
(3)为探究实验Ⅱ和Ⅲ中紫色褪去快慢不同的原因,设计实验如下:
| 实验编号 | Ⅳ | Ⅴ |
| 实验操作 | 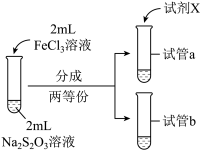 |  |
| 实验现象 | 紫色褪去时间a>b | 紫色褪去时间c<d |
②由实验Ⅳ和实验Ⅴ得出的结论是
您最近一年使用:0次
2021-01-20更新
|
1043次组卷
|
7卷引用:北京市东城区2021届高三上学期期末教学统一检测化学试题
北京市东城区2021届高三上学期期末教学统一检测化学试题北京市清华大学附属中学2022-2023学年高二上学期期末化学试题北京理工大学附属中学2023-2024学年高三上学期10月月考化学试题(已下线)大题04 无机定量与探究实验-【考前抓大题】备战2021年高考化学(全国通用)(已下线)解密07 非金属及其化合物(分层训练)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(浙江专版)(已下线)解密07 非金属及其化合物(分层训练)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练辽宁省葫芦岛市2021届高考第一次模拟考试化学试题