名校
1 . 将少量 气体通入
气体通入 和
和 的混合溶液中,溶液颜色由棕黄色变成浅绿色,同时有白色沉淀产生。针对上述变化,下列分析正确的是
的混合溶液中,溶液颜色由棕黄色变成浅绿色,同时有白色沉淀产生。针对上述变化,下列分析正确的是
 气体通入
气体通入 和
和 的混合溶液中,溶液颜色由棕黄色变成浅绿色,同时有白色沉淀产生。针对上述变化,下列分析正确的是
的混合溶液中,溶液颜色由棕黄色变成浅绿色,同时有白色沉淀产生。针对上述变化,下列分析正确的是A.该过程表明 有漂白性 有漂白性 | B.白色沉淀为 |
C.该实验表明 具有还原性 具有还原性 | D.反应后溶液酸性增强 |
您最近一年使用:0次
2020-10-07更新
|
1693次组卷
|
9卷引用:周末培优1 硫、氮及其化合物的相互转化-2021-2022学年高一化学课后培优练(人教版2019必修第二册)
(已下线)周末培优1 硫、氮及其化合物的相互转化-2021-2022学年高一化学课后培优练(人教版2019必修第二册)高一必修第一册(苏教2019版)专题4 C 高考挑战区江西省丰城市第九中学(日新班)2021-2022学年高一下学期期末检测化学试题(已下线)专题01 硫及其化合物的性质及转化(专题过关)-2022-2023学年高一化学下学期期中期末考点大串讲(人教版2019必修第二册)第五章 化工生产中的重要非金属元素(B卷·能力提升练)-【单元测试】2022-2023学年高一化学分层训练AB卷(人教版2019必修第二册)(已下线)第五章 化工生产中的重要非金属元素【单元测试B卷】云南省开远市第一中学校2023-2024学年高一下学期3月月考化学试题(已下线)清单01 硫及其化合物的性质(考点清单)(讲+练)-2023-2024学年高一化学下学期期末考点大串讲(人教版2019必修第二册)(已下线)猜想01 硫及其化合物的性质与转化(考题猜想)-2023-2024学年高一化学下学期期末考点大串讲(人教版2019必修第二册)
2011·山东潍坊·一模
名校
解题方法
2 . 向FeCl3、CuCl2的混合溶液中加入铁粉,充分反应后仍有固体存在,则下列判断不正确 的是:(已知氧化性:Fe3+>Cu2+)( )
| A.溶液中一定含有Cu2+ |
| B.加入KSCN溶液一定不变红色 |
| C.溶液中一定含有Fe2+ |
| D.剩余固体中一定含铜 |
您最近一年使用:0次
2020-04-03更新
|
1695次组卷
|
77卷引用:2019-2020学年高一上学期期末复习《新题速递·化学》12月(考点12-15)
2019-2020学年高一上学期期末复习《新题速递·化学》12月(考点12-15)(已下线)2011-2012学年山东临清三中第一学期高一月考化 学 试 卷(已下线)2011-2012学年辽宁省开原高中高一第三次月考化学试卷(已下线)2011-2012学年广东省揭阳一中高一上学期期末考试化学试卷(已下线)2011-2012学年吉林省长春市十一高中高一上学期期末考试化学试卷(已下线)2012-2013学年吉林省实验中学高一上学期期末考试化学试卷(已下线)2015河北保定某重点中学同步作业(必修1苏教版)3.2.2铜铁及其化合物2014-2015广东省汕头市金山中学高一上学期10月月考化学试卷2014-2015吉林省松原市扶余县一中高一上学期期中化学试卷14-15内蒙古北方重工业集团三中高一上学期期末化学试卷2014-2015浙江省杭州市西湖中学高一12月月考化学试卷2015-2016学年山西省太原五中高一上12月月考化学试卷2015-2016学年陕西省西安一中高一上12月月考化学试卷2015-2016学年黑龙江省哈尔滨六中高一上期末化学试卷2015-2016学年吉林省实验中学高一上期末(理)化学试卷2015-2016学年山东省济南一中高一上学期期末化学试卷2015-2016学年甘肃省永昌一中高一上学期期末化学试卷2016-2017学年四川省双流中学高一12月月考化学卷2016-2017学年云南省曲靖市第一中学高一上学期期末考试化学试卷2016-2017学年河北省石家庄市第一中学高一上学期期末考试化学试卷北京市第四中学2016-2017学年高一上学期期末考试化学试题浙江省镇海中学创新班2016-2017学年高一上学期阶段性检测化学试卷吉林省舒兰市第一高级中学校2017-2018学年高一上学期质量监测化学试题广西南宁市第二中学2017-2018学年高一上学期期末考试化学试题江西省景德镇市第一中学2017-2018学年高一上学期期末考试化学试题北京四中2017-2018学年高一上学期期末考试化学试题安徽省滁州市定远县育才学校2017-2018学年高一(普通班)下学期第一次月考化学试题黑龙江省双鸭山市第一中学2017-2018学年高一3月开学考试化学试题【全国百强校】湖北省孝感市高级中学2018-2019学年高一上学期期中考试化学试题【全国百强校】河南省洛阳市第一中学2018-2019学年高一上学期12月月考化学试题陕西省渭南中学2018-2019学年高一上学期第三次月考化学试题【全国百强校】西藏自治区拉萨中学2018-2019学年高一上学期期末考试化学试题【全国百强校】福建省三明市第一中学2018-2019学年高一上学期第二次月考化学试题【全国百强校】北京市第四中学2018-2019学年高一上学期期末考试化学试题甘肃省武威第一中学2019-2020学年高一上学期期中考试化学试题四川省广元市川师大万达中学2019-2020学年高一上学期11月月考化学试题天津市静海区第一中学2019-2020学年高一上学期12月学业能力调研化学试题江苏省盐城市獐沟中学2019-2020学年高一上学期12月月考化学试题湖南师范大学附属中学2019-2020学年高一上学期第二次大练习化学试题安徽省六安市第一中学2019-2020学年高一下学期疫情防控延期开学期间辅导测试(三)化学试题四川省泸州市泸县第一中学2019-2020学年高一下学期第一次在线月考化学试题湖南省长沙市一中2019-2020学年高一上学期期末考试化学试题北京市北京师范大学附属中学2019-2020学年高一上学期期末考试化学试题甘肃省天水一中2019-2020学年高一上学期第三学段(期末)考试化学试题江西省宜春市宜丰中学2019-2020高一下学期开学考试化学试题甘肃省西北师范大学附属中学2019-2020学年高一上学期期末考试化学试题湖北省恩施州巴东县第一高级中学2019-2020学年高一上学期第三次月考化学试题人教版(2019)高一必修第一册 第三章 铁 金属材料 第一节 铁及其化合物 教材帮吉林省延边朝鲜族自治州2020-2021学年高一上学期期末考试化学试题(已下线)【浙江新东方】在线化学58高一上广东省中山市第一中学丰山学部2019-2020学年高一上学期第三次段化学试题甘肃省天水市第一中学2021-2022学年高一下学期期末考试化学试题(已下线)2011届山东省潍坊三县高三阶段性教学质量检测化学试卷(已下线)2012届福建省罗源县第一中学高三上学期期中考试化学试卷(已下线)2012届福建省福州八县(市)一中高三上学期期中联考化学试卷(已下线)2012届山东省聊城市五校高三上学期期末联考化学试卷(已下线)2014届河南省洛阳市高三上学期期中考试化学试卷(已下线)2014届河南省洛阳市高三上学期期中考试化学试卷B(已下线)2014-2015学年湖南长沙市长郡中学高三上学期第二次月考化学试卷2015届福建省泉州一中高三上学期期中考试化学试卷2015届辽宁省抚顺市二中高三上学期期中考试化学试卷2016届湖南省常德市第一中学高三上学期第三次月考化学试卷2016届山东省乳山市第一中学高三上学期10月月考化学试卷2016届湖南省长沙市明德中学高三上学期第三次月考化学试卷2016届山东省临沂市兰陵县第四中学高三上学期第一次月考化学试卷2017届湖南省石门一中高三上学期9月月考化学试卷山东省淄博市淄川中学2018届高三上学期第一次月考化学试题吉林省抚松五中 、 长白县实验中学、长白山二中、长白山实验中学2018届高三四盟校期中联考化学试题湖南省长沙市明德中学2016届高三上学期第三次月考化学试题【全国百强校】河北省邢台市第一中学2017-2018学年高二下学期第三次月考化学试题内蒙古自治区五原县第一中学2017-2018学年高二期末考试化学试题湖北省安陆市第一高级中学2019届高三上学期8月月考化学试题【全国百强校】湖南省衡阳市第八中学2019届高三上学期第二次月考化学试题宁夏石嘴山市第三中学2020届高三上学期第一次适应性(开学)考试化学试题(已下线)上海市浦东新区2012届高三第三次模拟化学试题福建省福州市第四中学2021届高三10月月考化学试题上海市西南位育中学2022-2023学年高三上学期期末测评化学试题
名校
解题方法
3 . 下列实验现象与氧化还原反应有关的是
| A.SO2通入品红溶液中,溶液褪色,加热后又恢复红色 |
| B.向FeCl3溶液中滴加淀粉KI溶液,溶液变蓝 |
| C.向Fe2(SO4)3溶液中滴加NaOH溶液,生成红褐色沉淀 |
| D.二氧化碳通入石灰水中变浑浊,继续通入又变澄清 |
您最近一年使用:0次
2020-02-11更新
|
205次组卷
|
3卷引用:2019-2020学年高一上学期期末复习《新题速递·化学》12月(考点07-10)
名校
4 . 下列离子方程式正确的是( )
| A.足量盐酸滴在石灰石上:CaCO3+2H+=Ca2++CO2↑+H2O |
| B.铁和稀硫酸反应:2Fe+6H+=2Fe3++3H2↑ |
| C.用FeCl3溶液腐蚀印刷电路板:Fe3++Cu=Fe2++Cu2+ |
| D.氢氧化铜与稀硫酸混合:H++OH-=H2O |
您最近一年使用:0次
2019-12-16更新
|
187次组卷
|
2卷引用:2019-2020学年高一上学期期末复习《新题速递·化学》12月(考点07-10)
解题方法
5 . 已知反应2FeCl2+Cl2=2FeCl3。现有铁粉、氯气、氧化铁和盐酸四种物质,试用三种方法制取FeCl3(用化学方程式表示)。
(1)___________________ 。
(2)__________________ 。
(3)_______________ 。
(1)
(2)
(3)
您最近一年使用:0次
名校
6 . 把一定量的铁粉放入氯化铁溶液中,完全反应后,所得溶液中Fe2+ 和Fe3+的物质的量浓度之比为3:1,则已反应的Fe3+和未反应的Fe3+的物质的量之比为
| A.1:1 | B.2:3 | C.2:1 | D.3:2 |
您最近一年使用:0次
2019-02-06更新
|
921次组卷
|
23卷引用:易错专题21 铁单质的性质-【突破易错·冲刺满分】2021-2022学年高一上学期化学期中期末易错专题(人教版2019)
(已下线)易错专题21 铁单质的性质-【突破易错·冲刺满分】2021-2022学年高一上学期化学期中期末易错专题(人教版2019)天津市静海县第一中学2017-2018学年高一12月学生学业能力调研考试化学试题山东省桓台县2017-2018学年高一上学期期末考试化学试题山东省桓台第二中学2017-2018学年高一上学期期末考试化学试题辽宁省抚顺中学2017-2018学年高一上学期期末考试化学试题黑龙江省牡丹江中学2017-2018学年高一上学期期末考试化学试题【全国百强校】云南省玉溪市第一中学2018-2019学年高一上学期第一次月考化学试题【市级联考】湖北省天门市、潜江市2018-2019学年高一上学期12月月考化学试题【全国百强校】湖北省荆州中学2018-2019学年高一上学期期末考试化学试题河南省许昌市第三高级中学2019-2020学年高一下学期期末考试化学试题人教版(2019)高一必修第一册 第三章 第一节 铁及其化合物鲁科版(2019)高一必修第一册第3章 物质的性质与转化 第1节 铁的多样性(已下线)第三章 铁 金属材料(能力提升)-2020-2021学年高一化学单元测试定心卷(人教版2019必修第一册)(已下线)3.2.3 铁的重要化合物(重点练)-2020-2021学年高一化学上学期十分钟同步课堂专练(人教版)(已下线)3.1.2 铁的重要化合物(重点练)-2020-2021学年高一化学上学期十分钟同步课堂专练(人教版2019必修第一册)安徽省合肥一六八中学2020-2021学年高一上学期期末调研化学试题湖南省常德市芷兰实验中学2020-2021学年高一上学期期末考试化学试题吉林省长春市第二实验中学2020-2021学年高一下学期开学考试化学试题浙江省淳安县汾口中学2020-2021学年高一12月阶段考试化学试题浙江省浙北G2(湖州中学、嘉兴一中)2021-2022学年高一上学期期中联考化学试题新疆喀什地区疏附县2021-2022学年高一上学期1月测试化学试题四川省宜宾市叙州区第一中学校2022-2023学年高一上学期第三次月考试化学试题作业(十八) 铁盐和亚铁盐
名校
7 . 某兴趣小组研究I2与FeCl2溶液的反应。
配制FeCl2溶液:向0.1 mol·L-1FeCl3溶液中加入足量铁粉,充分振荡,备用。
(1)FeCl3溶液与铁粉反应的离子方程式是________ 。
(2)检验FeCl3完全反应的实验方案是____________ 。
(3)设计如下实验,研究I2是否能够氧化FeCl2:
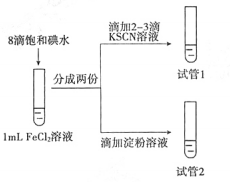
实验现象:试管1溶液变红,试管2溶液呈现较浅的蓝色。
实验结论:I2能够氧化FeCl2。
①有的同学认为上述实验现象不足以得出上述结论,原因是________ 。
②欲证实实验结论,再次设计对比实验。实验方案和相应的现象是________ 。
(4)继续进行实验:
①针对Ⅱ中现象,小组同学提出假设:在一定量KI的存在下,I-+I2 I3-,使CCl4很难萃取黄色溶液中的I2。该小组同学设计实验,证实了I-和I2可以反应。在下图虚框中,将实验方案补充完整(按试题图示方式呈现):
I3-,使CCl4很难萃取黄色溶液中的I2。该小组同学设计实验,证实了I-和I2可以反应。在下图虚框中,将实验方案补充完整(按试题图示方式呈现):____________

②应用化学平衡移动原理,结合离子方程式,解释实验I中溶液红色褪去的原因:_______________________ 。
配制FeCl2溶液:向0.1 mol·L-1FeCl3溶液中加入足量铁粉,充分振荡,备用。
(1)FeCl3溶液与铁粉反应的离子方程式是
(2)检验FeCl3完全反应的实验方案是
(3)设计如下实验,研究I2是否能够氧化FeCl2:

实验现象:试管1溶液变红,试管2溶液呈现较浅的蓝色。
实验结论:I2能够氧化FeCl2。
①有的同学认为上述实验现象不足以得出上述结论,原因是
②欲证实实验结论,再次设计对比实验。实验方案和相应的现象是
(4)继续进行实验:
| 实验 | 实验操作 | 实验现象 |
| I | 向试管1中加入KI固体,充分振荡 | 溶液红色完全褪去,变为黄色。 |
| Ⅱ | 向I中所得的黄色溶液中加入0.5mL CCl4,充分振荡、静置 | 水层仍为黄色,CCl4层几乎无色。 |
①针对Ⅱ中现象,小组同学提出假设:在一定量KI的存在下,I-+I2
 I3-,使CCl4很难萃取黄色溶液中的I2。该小组同学设计实验,证实了I-和I2可以反应。在下图虚框中,将实验方案补充完整(按试题图示方式呈现):
I3-,使CCl4很难萃取黄色溶液中的I2。该小组同学设计实验,证实了I-和I2可以反应。在下图虚框中,将实验方案补充完整(按试题图示方式呈现):
②应用化学平衡移动原理,结合离子方程式,解释实验I中溶液红色褪去的原因:
您最近一年使用:0次
名校
8 . 某小组在验证反应“Fe+2Ag+===Fe2++2Ag”的实验中检测到Fe3+,发现和探究过程如下。向硝酸酸化的0.05 mol/L硝酸银溶液(pH≈2)中加入过量铁粉,搅拌后静置,烧杯底部有黑色固体,溶液呈黄色。
资料:i.Ag+与SCN−生成白色沉淀AgSCN;
ⅱ.3Fe2++2[Fe(CN)6]3−===Fe3[Fe(CN)6]2↓(蓝色)
(1)检验产物:
①取出少量黑色固体,洗涤后,____________ (填操作和现象)。证明黑色固体中含有Ag。
②取上层清液,滴加K3[Fe(CN)6]溶液,产生蓝色沉淀,说明溶液中含有_______ 。
(2)针对“溶液呈黄色”,甲认为溶液中有Fe3+,乙认为铁粉过量时不可能有Fe3+,乙依据的原理是_________ (用离子方程式表示)。针对两种观点继续实验:
①取上层清液,滴加KSCN溶液,溶液变红,证实了甲的猜测。同时发现有白色沉淀产生,且溶液颜色深浅、沉淀量多少与取样时间有关,对比实验记录如下:
②对Fe3+产生的原因作出如下假设:
假设a:可能是铁粉表面有氧化层,能产生Fe3+;
假设b:空气中存在O2,由于____________ (用离子方程式表示),可产生Fe3+;
假设c:酸性溶液中NO3−具有氧化性,可产生Fe3+;
假设d:根据__________ 现象,判断溶液中存在Ag+,可产生Fe3+。
资料:i.Ag+与SCN−生成白色沉淀AgSCN;
ⅱ.3Fe2++2[Fe(CN)6]3−===Fe3[Fe(CN)6]2↓(蓝色)
(1)检验产物:
①取出少量黑色固体,洗涤后,
②取上层清液,滴加K3[Fe(CN)6]溶液,产生蓝色沉淀,说明溶液中含有
(2)针对“溶液呈黄色”,甲认为溶液中有Fe3+,乙认为铁粉过量时不可能有Fe3+,乙依据的原理是
①取上层清液,滴加KSCN溶液,溶液变红,证实了甲的猜测。同时发现有白色沉淀产生,且溶液颜色深浅、沉淀量多少与取样时间有关,对比实验记录如下:
| 序号 | 取样时间/min | 现象 |
| i | 3 | 产生大量白色沉淀;溶液呈红色 |
| ii | 30 | 产生白色沉淀;较3min时量少;溶液红色较3min时加深 |
| ⅲ | 120 | 产生白色沉淀: 较30min时量少;溶液红色较30min时变浅 |
假设a:可能是铁粉表面有氧化层,能产生Fe3+;
假设b:空气中存在O2,由于
假设c:酸性溶液中NO3−具有氧化性,可产生Fe3+;
假设d:根据
您最近一年使用:0次
名校
9 . 将一定量的铜粉加入盛有FeCl3溶液的烧杯中,充分反应,则下列判断中不正确的是
| A.溶液黄色变浅 | B.溶液中一定含Cu2+、Fe2+ |
| C.加入KSCN 溶液,一定不变红色 | D.溶液中c (CuCl2)∶c(FeC12) =1∶2 |
您最近一年使用:0次



