1 . 钠及其化合物的生产、应用,是化工生产与研究的重要组成部分。
(1) 用途广泛,可用于医药、印染、漂白及用作分析试剂等。实验室模拟工业制备
用途广泛,可用于医药、印染、漂白及用作分析试剂等。实验室模拟工业制备 并检验其纯度的实验流程如图所示。回答下列问题:
并检验其纯度的实验流程如图所示。回答下列问题:

①生成 的化学方程式是
的化学方程式是_______ 。
② 样品加水溶解的化学方程式为
样品加水溶解的化学方程式为_______ ,样液中加入 后产生
后产生 ,说明
,说明 与水反应的过程中生成了
与水反应的过程中生成了_______ (填化学式)。
③滤液中加入 溶液产生白色沉淀,说明
溶液产生白色沉淀,说明 样品中含有碳酸钠杂质,生成白色沉淀的离子方程式为
样品中含有碳酸钠杂质,生成白色沉淀的离子方程式为_______ 。
(2)工业上以侯氏制碱法为基础生产焦亚硫酸钠( ,能溶于水)的工艺流程如图:
,能溶于水)的工艺流程如图:
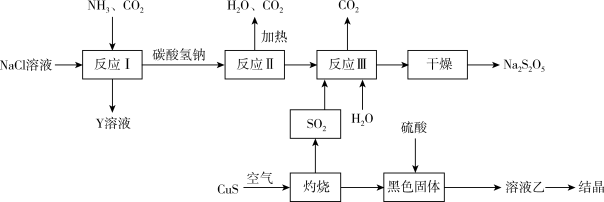
①反应Ⅱ的化学方程式为_______ 。
②关于该流程,下列说法正确的是_______ (填字母)
A.反应Ⅰ属于氧化还原反应 B.该流程中, 可以循环使用
可以循环使用
C.反应Ⅰ中应先通入 ,再通入
,再通入 D.溶液乙通过蒸发浓缩、冷却结晶可得硫酸铜晶体
D.溶液乙通过蒸发浓缩、冷却结晶可得硫酸铜晶体
(3) 在空气中灼烧的化学方程式为
在空气中灼烧的化学方程式为_______ 。
(1)
 用途广泛,可用于医药、印染、漂白及用作分析试剂等。实验室模拟工业制备
用途广泛,可用于医药、印染、漂白及用作分析试剂等。实验室模拟工业制备 并检验其纯度的实验流程如图所示。回答下列问题:
并检验其纯度的实验流程如图所示。回答下列问题:
①生成
 的化学方程式是
的化学方程式是②
 样品加水溶解的化学方程式为
样品加水溶解的化学方程式为 后产生
后产生 ,说明
,说明 与水反应的过程中生成了
与水反应的过程中生成了③滤液中加入
 溶液产生白色沉淀,说明
溶液产生白色沉淀,说明 样品中含有碳酸钠杂质,生成白色沉淀的离子方程式为
样品中含有碳酸钠杂质,生成白色沉淀的离子方程式为(2)工业上以侯氏制碱法为基础生产焦亚硫酸钠(
 ,能溶于水)的工艺流程如图:
,能溶于水)的工艺流程如图:
①反应Ⅱ的化学方程式为
②关于该流程,下列说法正确的是
A.反应Ⅰ属于氧化还原反应 B.该流程中,
 可以循环使用
可以循环使用C.反应Ⅰ中应先通入
 ,再通入
,再通入 D.溶液乙通过蒸发浓缩、冷却结晶可得硫酸铜晶体
D.溶液乙通过蒸发浓缩、冷却结晶可得硫酸铜晶体(3)
 在空气中灼烧的化学方程式为
在空气中灼烧的化学方程式为
您最近半年使用:0次
2023-11-14更新
|
261次组卷
|
2卷引用:江西省赣州市全南中学2023-2024学年高一上学期11月期中考试化学试题
2 . 硫酸铜是一种常见的化工产品,它在纺织、印染、 医药、化工、电镀以及木材和纸张的防腐等方面有极其广泛的用途。实验室制备硫酸铜的步骤如下:
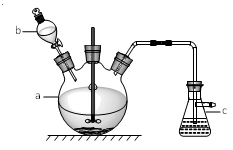
①在仪器a中先加入20 g铜片、60 mL水,再缓缓加入 17 mL浓硫酸;在仪器b中加入39 mL浓硝酸;在仪器c中 加入20%的石灰乳150 mL。
②从仪器b中放出约5 mL浓硝酸,开动搅拌器,然后采用滴加的方式逐渐将浓硝酸加到仪器a中,搅拌器间歇开动。当最后一滴浓硝酸加完以后,完全开动搅拌器,等反应基本停止下来时,开始用电炉加热直至仪器a中的红棕色气体完全消失,立即将导气管从仪器c中取出,再停止加热
③将仪器a中的液体倒出,取出未反应完的铜片,溶液冷却至室温,析出蓝色晶体。
试回答下列问题:
(1)仪器b的名称为_______ ;
(2)写出仪器a中反应的离子方程式:____________________ 。
(3)步骤②中将导气管先从仪器c中取出再停止加热的目的是_______________ 。
(4)为提高尾气吸收,防止空气污染,下列装置___________ (填字母)适合吸收逸出的气体(反应中产生的气体因来不及被石灰乳吸收而逸出)。

(5)根据表中五水硫酸铜和硝酸铜在不同温度下的溶解度,分析步骤③中溶液冷却至室温析出蓝色晶体的主要原因:___________ 。除去硫酸铜晶体中的少量硝酸铜可采用重结晶方法,检验硝酸铜是否被除净的方法:__________________ 。
(6)用滴定法测定蓝色晶体中Cu2+的含量。取a g试样配成 100 mL 溶液,每次取 20. 00 mL,用 c mol • L-1 EDTA (H2Y2-)标准溶液滴定至终点,平均消耗EDTA溶液bmL。 滴定反应为Cu2++ H2Y2-→CuY2-+2H+。计算蓝色晶体中Cu2+质量分数w=____ 。

①在仪器a中先加入20 g铜片、60 mL水,再缓缓加入 17 mL浓硫酸;在仪器b中加入39 mL浓硝酸;在仪器c中 加入20%的石灰乳150 mL。
②从仪器b中放出约5 mL浓硝酸,开动搅拌器,然后采用滴加的方式逐渐将浓硝酸加到仪器a中,搅拌器间歇开动。当最后一滴浓硝酸加完以后,完全开动搅拌器,等反应基本停止下来时,开始用电炉加热直至仪器a中的红棕色气体完全消失,立即将导气管从仪器c中取出,再停止加热
③将仪器a中的液体倒出,取出未反应完的铜片,溶液冷却至室温,析出蓝色晶体。
试回答下列问题:
(1)仪器b的名称为
(2)写出仪器a中反应的离子方程式:
(3)步骤②中将导气管先从仪器c中取出再停止加热的目的是
(4)为提高尾气吸收,防止空气污染,下列装置

(5)根据表中五水硫酸铜和硝酸铜在不同温度下的溶解度,分析步骤③中溶液冷却至室温析出蓝色晶体的主要原因:
T/K | 273 | 293 | 313 | 333 | 353 | 373 | |
溶解度/ (g/100 g) | 五水硫酸铜 | 23.1 | 32.0 | 44.6 | 61.8 | 83.8 | 114.0 |
硝酸铜 | 83.5 | 125.0 | 163.0 | 182.0 | 208.0 | 247.0 | |
您最近半年使用:0次



