20-21高二下·江苏苏州·期末
1 . 推动 的综合利用实现碳中和是党中央作出的重大战略决策。
的综合利用实现碳中和是党中央作出的重大战略决策。
(1)科学家利用电化学装置实现 和
和 两种分子的耦合转化,其原理如图所示:
两种分子的耦合转化,其原理如图所示:
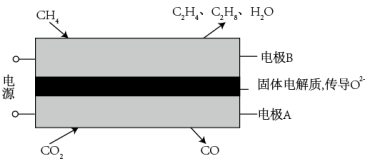
①电极A上的电极反应式为___________ 。
②若生成的乙烯和乙烷的体积比为2∶1,则消耗的 和
和 体积比为
体积比为___________ 。
(2) 一定条件可转化为
一定条件可转化为 ,
,
 。
。
①下列有关该反应的说法正确的是___________ 。
A.升高温度逆反应速率加快,正反应速率减慢
B.反应体系中 浓度不再变化,说明反应达到平衡状态
浓度不再变化,说明反应达到平衡状态
C.恒温恒容下达到平衡后,再通入 ,平衡向正反应方向移动
,平衡向正反应方向移动
D.平衡时,若改变体积增大压强,则 、
、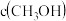 均变大
均变大
②某温度下恒容密闭容器中, 和
和 起始浓度分别为a
起始浓度分别为a 和3a
和3a ,反应达平衡时,
,反应达平衡时, 转化率为b,该温度下反应的平衡常数
转化率为b,该温度下反应的平衡常数
___________ 。
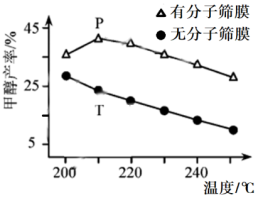
③恒压下,该反应在无分子筛膜时甲醇的平衡产率和有分子筛膜时甲醇的产率随温度的变化如图所示,分子筛膜能选择性分离出 。P点甲醇产率高于T点的原因为
。P点甲醇产率高于T点的原因为___________ 。
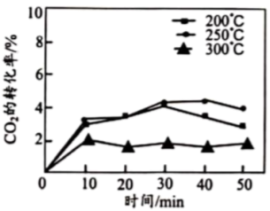
(3) 与丙烯催化合成甲基丙烯酸。催化剂在温度不同时对
与丙烯催化合成甲基丙烯酸。催化剂在温度不同时对 转化率的影响如图所示,300℃时
转化率的影响如图所示,300℃时 转化率低于200℃和250℃的原因可能为
转化率低于200℃和250℃的原因可能为___________ 。
 的综合利用实现碳中和是党中央作出的重大战略决策。
的综合利用实现碳中和是党中央作出的重大战略决策。(1)科学家利用电化学装置实现
 和
和 两种分子的耦合转化,其原理如图所示:
两种分子的耦合转化,其原理如图所示:
①电极A上的电极反应式为
②若生成的乙烯和乙烷的体积比为2∶1,则消耗的
 和
和 体积比为
体积比为(2)
 一定条件可转化为
一定条件可转化为 ,
,
 。
。①下列有关该反应的说法正确的是
A.升高温度逆反应速率加快,正反应速率减慢
B.反应体系中
 浓度不再变化,说明反应达到平衡状态
浓度不再变化,说明反应达到平衡状态C.恒温恒容下达到平衡后,再通入
 ,平衡向正反应方向移动
,平衡向正反应方向移动D.平衡时,若改变体积增大压强,则
 、
、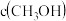 均变大
均变大②某温度下恒容密闭容器中,
 和
和 起始浓度分别为a
起始浓度分别为a 和3a
和3a ,反应达平衡时,
,反应达平衡时, 转化率为b,该温度下反应的平衡常数
转化率为b,该温度下反应的平衡常数
③恒压下,该反应在无分子筛膜时甲醇的平衡产率和有分子筛膜时甲醇的产率随温度的变化如图所示,分子筛膜能选择性分离出
 。P点甲醇产率高于T点的原因为
。P点甲醇产率高于T点的原因为
(3)
 与丙烯催化合成甲基丙烯酸。催化剂在温度不同时对
与丙烯催化合成甲基丙烯酸。催化剂在温度不同时对 转化率的影响如图所示,300℃时
转化率的影响如图所示,300℃时 转化率低于200℃和250℃的原因可能为
转化率低于200℃和250℃的原因可能为
您最近一年使用:0次
2021-06-28更新
|
406次组卷
|
3卷引用:2020年天津卷化学高考真题变式题13-16
名校
解题方法
2 . Ⅰ.铁及铁的氧化物广泛应于生产、生活、航天、科研领域。
(1)铁的氧化物循环分解水制H2
已知:H2O(l)=H2(g)+1/2 O2(g) ΔH1=a kJ•mol-1
6FeO(s)+O2(g)=2Fe3O4(s) ΔH2=b kJ•mol-1
则:3FeO(s)+H2O(l)=H2(g)+Fe3O4(s) ΔH3=_______
(2)Fe2O3与CH4反应可制备“纳米级”金属铁。已知,恒温恒容时,加入Fe2O3与CH4发生反应:3CH4(g)+Fe2O3(s)⇌2Fe(s)+6H2(g)+3CO(g)
①此反应的化学平衡常数表达式为_______
②下列条件能判断该反应达到平衡状态的是_______
a.消耗1molFe2O3的同时,消耗3molCO
b.容器内气体的颜色不再改变
c.容器内压强不再改变
d.v正(CH4)=2v逆(H2)
Ⅱ.用CH4还原NO2的反应为CH4(g)+2NO2(g)⇌N2(g)+CO2(g)+2H2O(g),向两个容积均为2L温度分别为T1、T2的恒温恒容密闭容器中分别加入1mol CH4和2mol NO2,测得各容器中n(NO2)随反应时间t的变化如图所示:
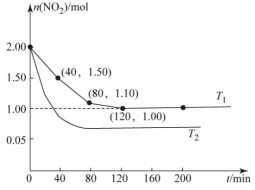
①T1_______ T2(填“>”或“<”)。
②T1时,40~80 min内,用N2的浓度变化表示的平均反应速率为v(N2)=_______
③T1下,200 min时,向容器中再加入CH4、NO2和H2O(g)各l mol,化学平衡_______ 移动(填“正向”“逆向”或“不”)。
Ⅲ.CaSO4微溶于水和酸,可加入氢氧化钠并通入CO2使其转化为CaCO3,然后加酸浸泡除去,反应的离子方程式为CaSO4+CO =CaCO3+SO
=CaCO3+SO ,室温下,该反应的化学平衡常数为
,室温下,该反应的化学平衡常数为_______ (室温下,Ksp(CaCO3)=3×10-9,Ksp(CaSO4)=9×10-6)。
(1)铁的氧化物循环分解水制H2
已知:H2O(l)=H2(g)+1/2 O2(g) ΔH1=a kJ•mol-1
6FeO(s)+O2(g)=2Fe3O4(s) ΔH2=b kJ•mol-1
则:3FeO(s)+H2O(l)=H2(g)+Fe3O4(s) ΔH3=
(2)Fe2O3与CH4反应可制备“纳米级”金属铁。已知,恒温恒容时,加入Fe2O3与CH4发生反应:3CH4(g)+Fe2O3(s)⇌2Fe(s)+6H2(g)+3CO(g)
①此反应的化学平衡常数表达式为
②下列条件能判断该反应达到平衡状态的是
a.消耗1molFe2O3的同时,消耗3molCO
b.容器内气体的颜色不再改变
c.容器内压强不再改变
d.v正(CH4)=2v逆(H2)
Ⅱ.用CH4还原NO2的反应为CH4(g)+2NO2(g)⇌N2(g)+CO2(g)+2H2O(g),向两个容积均为2L温度分别为T1、T2的恒温恒容密闭容器中分别加入1mol CH4和2mol NO2,测得各容器中n(NO2)随反应时间t的变化如图所示:

①T1
②T1时,40~80 min内,用N2的浓度变化表示的平均反应速率为v(N2)=
③T1下,200 min时,向容器中再加入CH4、NO2和H2O(g)各l mol,化学平衡
Ⅲ.CaSO4微溶于水和酸,可加入氢氧化钠并通入CO2使其转化为CaCO3,然后加酸浸泡除去,反应的离子方程式为CaSO4+CO
 =CaCO3+SO
=CaCO3+SO ,室温下,该反应的化学平衡常数为
,室温下,该反应的化学平衡常数为
您最近一年使用:0次
2021-06-27更新
|
1003次组卷
|
8卷引用:四川省广安市2019-2020学年高二下学期期末(零诊)化学试题
四川省广安市2019-2020学年高二下学期期末(零诊)化学试题(已下线)理综化学-2021年秋季高三开学摸底考试卷01(课标全国专用)2021年海南高考化学试题变式题11-19(已下线)备战2022年高考化学精准检测卷【全国卷】08广东省湛江市第二十一中学2021—2022学年高三上学期11月月考化学试题四川省资中县球溪高级中学2022-2023学年高三上学期10月月考化学试题湖北省天门外国语学校2022-2023学年高二上学期12月月考化学试题四川省内江市威远中学校2022-2023学年高二下学期第二次阶段性考试理综化学试题
2021·湖南·高考真题
3 . 铁的配合物离子(用 表示)催化某反应的一种反应机理和相对能量的变化情况如图所示:
表示)催化某反应的一种反应机理和相对能量的变化情况如图所示:
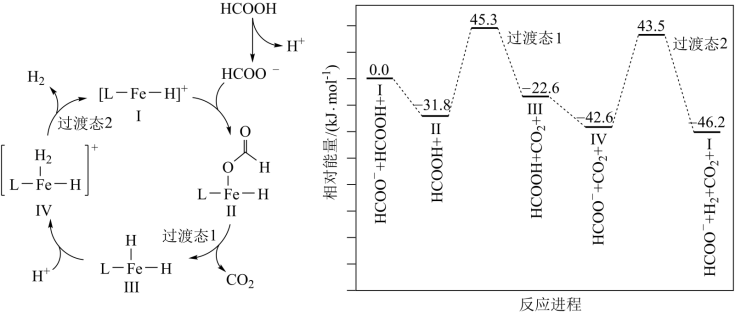
下列说法错误的是
 表示)催化某反应的一种反应机理和相对能量的变化情况如图所示:
表示)催化某反应的一种反应机理和相对能量的变化情况如图所示:
下列说法错误的是
A.该过程的总反应为 |
B. 浓度过大或者过小,均导致反应速率降低 浓度过大或者过小,均导致反应速率降低 |
C.该催化循环中 元素的化合价发生了变化 元素的化合价发生了变化 |
| D.该过程的总反应速率由Ⅱ→Ⅲ步骤决定 |
您最近一年使用:0次
2021-06-09更新
|
9145次组卷
|
39卷引用:2020年山东卷化学高考真题变式题11-15
(已下线)2020年山东卷化学高考真题变式题11-152021年新高考湖南化学高考真题(已下线)考点17 化学反应速率及其影响因素-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点17 化学反应速率及其影响因素-备战2022年高考化学一轮复习考点帮(浙江专用)江苏省如皋中学2021-2022学年高三上学期期初测试化学试题(已下线)课时35 化学反应速率及影响因素-2022年高考化学一轮复习小题多维练(全国通用)安徽省合肥工业大学附属中学2021-2022学年高三上学期第一次阶段考试化学试题辽宁省东北育才学校2021-2022学年高二上学期期中考试化学试题(已下线)专题10 化学反应速率与化学平衡-备战2022年高考化学学霸纠错(全国通用)2021年湖南省高考化学试卷变式题11-19北京市第八中学2021-2022学年高二上学期期中考试化学试题(已下线)解密08 化学反应与能量(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(浙江专用)(已下线)解密08 化学反应与能量(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)(已下线)专题10 化学反应与能量-2022年高考化学二轮复习重点专题常考点突破练(已下线)专题09 反应机理—2022年高考化学二轮复习讲练测(全国版)-练习(已下线)卷10 化学反应机理选择题-【小题小卷】冲刺2022年高考化学小题限时集训(新高考专用)(已下线)秘籍08 反应历程探究与催化原理图象分析-备战2022年高考化学抢分秘籍(全国通用)(已下线)押新高考卷11题 反应机理分析-备战2022年高考化学临考题号押题(新高考通版)(已下线)专题09 化学反应速率、化学平衡-三年(2020-2022)高考真题分项汇编(已下线)考点21 化学反应速率-备战2023年高考化学一轮复习考点帮(全国通用)江苏省海安高级中学2021-2022学年高二上学期阶段测试(二)化学试题(已下线)第15讲 化学反应的热效应 (讲)-2023年高考化学一轮复习讲练测(新教材新高考)(已下线)微专题36 高考“明星”考点—催化剂-备战2023年高考化学一轮复习考点微专题(已下线)易错点21 化学反应速率-备战2023年高考化学考试易错题湖南省衡阳师范学院祁东附属中学2021-2022学年高三上学期12月月考化学试题(已下线)专题12 化学反应机理(讲)-2023年高考化学二轮复习讲练测(新高考专用)(已下线)第七章 化学反应速率与化学平衡 热点强化12 化学反应历程、机理的分析应用(已下线)素养卷02 循环转化过渡态理论图像题-【小题小卷】冲刺2023年高考化学小题限时集训(新高考专用)(已下线)考点21 化学反应速率(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)专题09 化学反应中的热效应与反应机理-2023年高考化学真题题源解密(全国通用)(已下线)专题11 化学反应速率与化学平衡-2023年高考化学真题题源解密(全国通用)(已下线)热点题型训练 催化剂与反应历程(机理)(已下线)考点1 化学反应的热效应(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)山东省泰安市部分学校2023-2024学年高二上学期期末调研化学试题北京大学附属中学2021-2022学年高二下学期期末考试化学试卷(已下线)题型10 反应微观机理分析 速率方程及其应用-2024年高考化学二轮热点题型归纳与变式演练(新高考通用)湖南省常德市第一中学2023-2024学年高三上学期第六次月考化学试题湖南省常德市第一中学2023-2024学年高三上学期第六次月考化学试题山东省威海市乳山市银滩高级中学2023-2024学年高二上学期1月模块考试化学试题
解题方法
4 . 化石燃料燃烧时会产生SO2进入大气形成酸雨,脱除SO2有多种方法。
(1)方法一:焦炭催化还原SO2生成S2,原理为:2C(s)+2SO2(g)⇌S2(g)+2CO2(g)
①恒温恒容条件下,密闭容器中发生上述反应,下列事实不能 说明反应达到平衡状态的是__ (填字母)。
A.SO2的浓度保持不变 B.混合气体的密度不再改变
C.混合气体的总压强不再改变 D.单位时间内消耗1molSO2同时生成1molCO2
②恒容容器中,1mol•L−1SO2与足量的焦炭反应,SO2的转化率随温度的变化如图所示。该反应的ΔH____ 0(填“>”或“<”)

(2)方法二:用H2还原SO2生成S的反应分两步完成,如图甲所示。反应过程中相关物质的物质的量浓度随时间的变化关系如图乙所示。

①写出第一步反应的化学方程式:_______ 。
②0~t1时间段用SO2表示的化学反应速率为_______ mol•L−1•min−1。
(3)方法三:利用原电池原理将SO2转化为H2SO4,其原理如图所示。
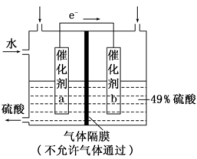
①催化剂b表面O2发生还原反应,其附近酸性___ (填“增强”或“减弱”)。
②催化剂a表面的电极反应式为___ 。
③若得到的硫酸浓度仍为49%,则理论上参加反应的SO2与加入的H2O的质量比为___ 。
(1)方法一:焦炭催化还原SO2生成S2,原理为:2C(s)+2SO2(g)⇌S2(g)+2CO2(g)
①恒温恒容条件下,密闭容器中发生上述反应,下列事实
A.SO2的浓度保持不变 B.混合气体的密度不再改变
C.混合气体的总压强不再改变 D.单位时间内消耗1molSO2同时生成1molCO2
②恒容容器中,1mol•L−1SO2与足量的焦炭反应,SO2的转化率随温度的变化如图所示。该反应的ΔH

(2)方法二:用H2还原SO2生成S的反应分两步完成,如图甲所示。反应过程中相关物质的物质的量浓度随时间的变化关系如图乙所示。

①写出第一步反应的化学方程式:
②0~t1时间段用SO2表示的化学反应速率为
(3)方法三:利用原电池原理将SO2转化为H2SO4,其原理如图所示。

①催化剂b表面O2发生还原反应,其附近酸性
②催化剂a表面的电极反应式为
③若得到的硫酸浓度仍为49%,则理论上参加反应的SO2与加入的H2O的质量比为
您最近一年使用:0次



