2022高二·上海·专题练习
1 . 2SO2(g)+O2(g) =2SO3(g)反应过程的能量变化如图所示。已知1 mol SO2(g)氧化为1 mol SO3(g)的ΔH1=-99 kJ·mol-1。
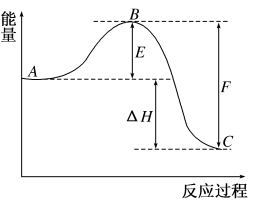
请回答下列问题:
(1)该反应属于_______ 反应(填“放热”或“吸热”)。
(2)图中C表示_______ 。
(3)从化学键的角度分析,F代表什么意义?_______ 。
(4)图中ΔH=_______ kJ·mol-1。
(5)若已知1 mol SO2(g)氧化为1 mol SO3(l)的ΔH2=-Q kJ·mol-1,则ΔH1_______ ΔH2(填“>”“<”或“=”)。

请回答下列问题:
(1)该反应属于
(2)图中C表示
(3)从化学键的角度分析,F代表什么意义?
(4)图中ΔH=
(5)若已知1 mol SO2(g)氧化为1 mol SO3(l)的ΔH2=-Q kJ·mol-1,则ΔH1
您最近一年使用:0次
2022高二·上海·专题练习
2 . 已知:H2(g)+ O2(g)=H2O(g),反应过程中能量变化如图,问:
O2(g)=H2O(g),反应过程中能量变化如图,问:
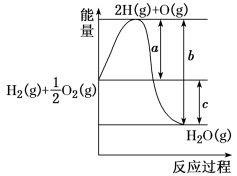
(1)a、b、c分别代表什么意义?
a_______ ;b_______ ;c_______ 。
(2)该反应是放热反应还是吸热反应?_______ 。ΔH_______ 0(填“<”或“>”)
(3)a、b、c的关系式为_______ 。
 O2(g)=H2O(g),反应过程中能量变化如图,问:
O2(g)=H2O(g),反应过程中能量变化如图,问:
(1)a、b、c分别代表什么意义?
a
(2)该反应是放热反应还是吸热反应?
(3)a、b、c的关系式为
您最近一年使用:0次
2022高二·上海·专题练习
解题方法
3 . 在研究化学反应中的能量变化时我们通常做如图所示的实验:在一个小烧杯里,加入约20 g已研磨成粉末的氢氧化钡晶体[Ba(OH)2·8H2O],将小烧杯放在事先已滴有3~4滴水的玻璃片(或三合板)上,然后再加入约10 g NH4Cl晶体,并立即用玻璃棒迅速搅拌。
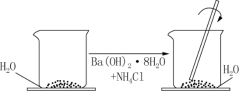
试回答下列问题:
(1)实验中要立即用玻璃棒迅速搅拌的原因是_______ 。
(2)如果实验中没有看到“结冰”现象,可能的原因(至少回答三个原因)_______ 、_______ 、_______ 。
(3)如果没有看到“结冰”现象,我们还可以采取哪些方式来说明该反应吸热?(至少回答两种方案)_______ 、_______ 。

试回答下列问题:
(1)实验中要立即用玻璃棒迅速搅拌的原因是
(2)如果实验中没有看到“结冰”现象,可能的原因(至少回答三个原因)
(3)如果没有看到“结冰”现象,我们还可以采取哪些方式来说明该反应吸热?(至少回答两种方案)
您最近一年使用:0次
4 . 已知反应CH4(g)+2O2(g)=CO2(g)+2H2O(g)为放热反应,则下列说法中正确的是
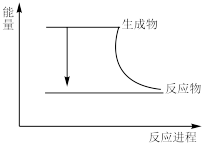

| A.反应过程中的能量变化关系可用图表示 |
| B.甲烷燃烧时化学能转化为热能和光能 |
| C.断开反应物中旧化学键吸收的能量大于形成生成物中化学键放出的能量 |
| D.该反应发生断裂的化学键有离子键和共价键 |
您最近一年使用:0次
5 . 下列变化会放出热量的是
| A.酒精用于降温 | B.冰雪的融化 |
| C.氢分子变成氢原子 | D.镁和盐酸反应 |
您最近一年使用:0次
2022高二·上海·专题练习
6 . 小烧杯放在一块沾有水的玻璃片上,加入氯化铵固体与氢氧化钡晶体[Ba(OH)2·8H2O)],并用玻璃棒搅拌,玻璃片上的水结成了冰。由此可知


| A.该反应中,化学能转变成热能 |
| B.反应物的总能量低于生成物的总能量 |
| C.氯化铵与氢氧化钡的反应为放热反应 |
| D.系统对环境放出热量 |
您最近一年使用:0次
2022高二·上海·专题练习
名校
解题方法
7 . 一定温度下 H2(g) 与 I2(g) 反应生成 HI(g),反应的能量变化如图所示。以下对该反应体系的描述中,正确的是
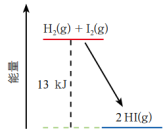

| A.反应物的总能量比生成物的总能量高 13 kJ |
| B.反应物的总能量比生成物的总能量低 13 kJ |
| C.破坏反应物中化学键所需的能量低于形成生成物中化学键释放的能量 |
| D.反应物化学键中储存的总能量比生成物化学键中储存的总能量高 |
您最近一年使用:0次
2022-07-22更新
|
241次组卷
|
6卷引用:1.1.1 系统的内能和反应热-【帮课堂】2022-2023学年高二化学同步精品讲义(沪科版2020选择性必修第一册)
(已下线)1.1.1 系统的内能和反应热-【帮课堂】2022-2023学年高二化学同步精品讲义(沪科版2020选择性必修第一册)上海市位育中学2022-2023学年高二上学期9月阶段性练习化学试题河南省周口市周口恒大中学2023-2024学年高二上学期1月期末化学试题河南省周口恒大中学2023-2024学年高三上学期1月期末化学试题河南省周口恒大中学2023-2024学年高三下学期开学化学试题河南省周口市川汇区周口恒大中学2023-2024学年高二下学期开学化学试题
8 . 已知:
下列关系正确的是
| 化学键 | H—H | Cl—Cl | H—Cl |
| 键能/kJ·mol-1 | Q1 | Q2 | Q3 |
| A.Q1+Q2>Q3 | B.Q1+Q2>2Q3 | C.Q1+Q 2<Q3 | D.Q1+Q2<2Q3 |
您最近一年使用:0次
2022高二·上海·专题练习
解题方法
9 . 切开的金属Na暴露在空气中,其变化过程如图所示:
反应I的反应过程与能量变化的关系如图所示,请回答下列问题:
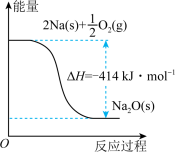
(1)反应I是_______ 反应(填“放热”或“吸热”),判断依_______ 。
(2)1molNa(s)被氧化成 molNa2O(s)的热化学方程式是
molNa2O(s)的热化学方程式是_______ 。
反应I的反应过程与能量变化的关系如图所示,请回答下列问题:

(1)反应I是
(2)1molNa(s)被氧化成
 molNa2O(s)的热化学方程式是
molNa2O(s)的热化学方程式是
您最近一年使用:0次
2022高二·上海·专题练习
解题方法
10 . 下列有关热化学方程式书写及对应表述均正确的是
| A.H2(g)+F2(g)=2HF(g) ΔΗ=-270kJ·mol−1,则相同条件下,2molHF(g)的能量大于1mol氢气和1mol氟单质的能量之和 |
| B.密闭容器中,9.6g硫粉与11.2g铁粉混合加热充分反应,放出19.12kJ热量,则Fe(s)+S(s)=FeS(s) ΔΗ=-95.6kJ·mol−1 |
| C.已知1mol氢气完全燃烧生成液态水所放出的热量为285.5kJ,则水分解的热化学方程式:2H2O(l)=2H2(g)+O2(g) ΔΗ=285.5kJ·mol−1 |
| D.已知:4P(红磷,s)=P4(白磷,s) ΔΗ=17kJ·mol−1,则P(红磷,s)转化为P4(白磷,s)不需要加热就可以实现 |
您最近一年使用:0次



