2018高三下·全国·专题练习
名校
解题方法
1 . 氢气是一种重要的工业原料和清洁能源,可用作合成氨、合成甲醇、合成盐酸的原料,冶金用还原剂等。
(1)已知:CH4(g)+H2O(g)=CO(g)+3H2(g) ΔH=+206.2 kJ·mol−1。
CH4(g)+CO2(g)=2CO(g)+2H2(g) ΔH=+247.4 kJ·mol−1
则反应CH4(g)+2H2O(g)=CO2(g)+4H2(g) ΔH=_______ kJ·mol−1。
(2)工业合成氨的反应原理为N2(g)+3H2(g) 2NH3(g) ΔH=−92.4 kJ·mol−1。
2NH3(g) ΔH=−92.4 kJ·mol−1。
①该反应中的H2制取成本较高,工业生产中往往追求H2的转化率。增大H2的平衡转化率的措施有_______ (填字母代号)。
a.增大压强
b.升高温度
c.增大N2浓度
d.及时移走生成物NH3
e.使用高效催化剂
②升高温度,该可逆反应的平衡常数K__________ (填“增大”“不变”或“减小”)。
③某温度下,把10 mol N2与28 mol H2置于容积为10 L的恒容密闭容器内,10 min时反应达到平衡状态,测得平均速率v(NH3)=0.12 mol·L−1·min−1,H2的平衡转化率为_______ (保留三位有效数字),则该温度下反应的平衡常数K=_______ 。
(3)下图所示装置工作时均与H2有关。
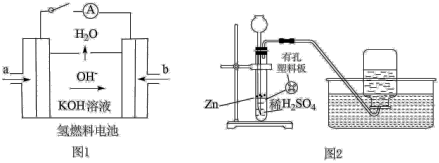
①图l所示装置,通入H2的管口是______ (填字母),正极反应式为___________________ 。
②图2是实验室制备H2的实验装置,在漏斗中加入1 mL CuSO4溶液,可观察到气泡生成速率明显加快,原因是_____________________ ,若反应装置中硫酸过量,则加入CuSO4溶液后,生成的氢气量__________ (填“增大”“不变”或“减小”)。
(1)已知:CH4(g)+H2O(g)=CO(g)+3H2(g) ΔH=+206.2 kJ·mol−1。
CH4(g)+CO2(g)=2CO(g)+2H2(g) ΔH=+247.4 kJ·mol−1
则反应CH4(g)+2H2O(g)=CO2(g)+4H2(g) ΔH=
(2)工业合成氨的反应原理为N2(g)+3H2(g)
 2NH3(g) ΔH=−92.4 kJ·mol−1。
2NH3(g) ΔH=−92.4 kJ·mol−1。①该反应中的H2制取成本较高,工业生产中往往追求H2的转化率。增大H2的平衡转化率的措施有
a.增大压强
b.升高温度
c.增大N2浓度
d.及时移走生成物NH3
e.使用高效催化剂
②升高温度,该可逆反应的平衡常数K
③某温度下,把10 mol N2与28 mol H2置于容积为10 L的恒容密闭容器内,10 min时反应达到平衡状态,测得平均速率v(NH3)=0.12 mol·L−1·min−1,H2的平衡转化率为
(3)下图所示装置工作时均与H2有关。

①图l所示装置,通入H2的管口是
②图2是实验室制备H2的实验装置,在漏斗中加入1 mL CuSO4溶液,可观察到气泡生成速率明显加快,原因是
您最近一年使用:0次
2018-04-20更新
|
105次组卷
|
3卷引用:甘肃省临泽县第一中学2018-2019学年高二下学期期末考试化学试题
甘肃省临泽县第一中学2018-2019学年高二下学期期末考试化学试题甘肃省张掖市临泽一中2018-2019学年高二下学期期末考试化学试题(已下线)2018年3月2018届高三第一次全国大联考(新课标Ⅲ卷)-化学试题



