解题方法
1 . 科学家在寻求将太阳能转化成化学能的办法,其中办法之一就是利用太阳能将 分解成
分解成 ,再将化学能转化为其他能源。右图是有关的能量循环示意图(已知:H-H键的键能为a
,再将化学能转化为其他能源。右图是有关的能量循环示意图(已知:H-H键的键能为a  ,O—O键的键能为b
,O—O键的键能为b  )。下列有关说法正确的是
)。下列有关说法正确的是
 分解成
分解成 ,再将化学能转化为其他能源。右图是有关的能量循环示意图(已知:H-H键的键能为a
,再将化学能转化为其他能源。右图是有关的能量循环示意图(已知:H-H键的键能为a  ,O—O键的键能为b
,O—O键的键能为b  )。下列有关说法正确的是
)。下列有关说法正确的是
A.图中 |
B.断开1mol H—O键所需要的太阳能为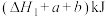 |
C.1mol  燃烧生成液态水的能量变化为 燃烧生成液态水的能量变化为 |
D.水蒸气所具有的能量比液态水多 kJ kJ |
您最近一年使用:0次
解题方法
2 . 研究大气中含硫化合物(主要是SO2和H2S)的转化具有重要意义。
(1)工业上采用高温热分解H2S的方法制取H2,在膜反应器中分离H2,发生的反应为2H2S(g) 2H2(g)+S2(g) △H。
2H2(g)+S2(g) △H。
已知:①H2S(g) H2(g)+S(g) △H1;
H2(g)+S(g) △H1;
②2S(g) S2(g) △H2。
S2(g) △H2。
则△H=______ (用含△H1、△H2的式子表示)。
(2)土壤中的微生物可将大气中的H2S经两步反应氧化成SO ,两步反应的能量变化示意图如图:
,两步反应的能量变化示意图如图: (aq)的热化学方程式为
(aq)的热化学方程式为_______ 。
(3)将H2S和空气的混合气体通入FeCl3、FeCl2、CuCl2的混合溶液中反应回收S,其物质转化如图所示。______ 。
②在温度一定和不补加溶液的条件下,缓慢通入混合气体,并充分搅拌。欲使生成的硫单质中不含CuS,可采取的措施有_______ 。
(4)二氧化硫—空气质子交换膜燃料电池可以利用大气中所含SO2快速启动,其装置示意图如图所示:______ (填“从A到B”或“从B到A”)。
②负极的电极反应为________ 。
(1)工业上采用高温热分解H2S的方法制取H2,在膜反应器中分离H2,发生的反应为2H2S(g)
 2H2(g)+S2(g) △H。
2H2(g)+S2(g) △H。已知:①H2S(g)
 H2(g)+S(g) △H1;
H2(g)+S(g) △H1;②2S(g)
 S2(g) △H2。
S2(g) △H2。则△H=
(2)土壤中的微生物可将大气中的H2S经两步反应氧化成SO
 ,两步反应的能量变化示意图如图:
,两步反应的能量变化示意图如图: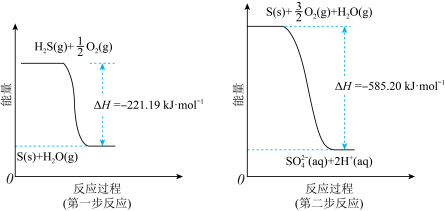
 (aq)的热化学方程式为
(aq)的热化学方程式为(3)将H2S和空气的混合气体通入FeCl3、FeCl2、CuCl2的混合溶液中反应回收S,其物质转化如图所示。
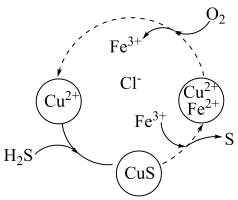
②在温度一定和不补加溶液的条件下,缓慢通入混合气体,并充分搅拌。欲使生成的硫单质中不含CuS,可采取的措施有
(4)二氧化硫—空气质子交换膜燃料电池可以利用大气中所含SO2快速启动,其装置示意图如图所示:
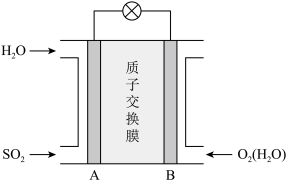
②负极的电极反应为
您最近一年使用:0次
3 . 已知:①
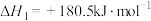
②
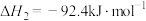
③
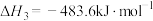
下列说法正确的是

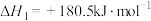
②

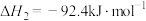
③

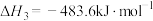
下列说法正确的是
A. 的燃烧热为 的燃烧热为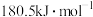 |
B. 的总能量一定大于 的总能量一定大于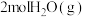 的总能量 的总能量 |
C.一定温度下在恒容密闭容器中充入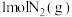 和足量 和足量 充分反应后可放热92.4kJ 充分反应后可放热92.4kJ |
D.氨的催化氧化反应的热方程式为 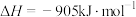 |
您最近一年使用:0次
名校
4 . 太阳能的开发与利用是能源领域的一个重要研究方向,由 制取C的太阳能工艺如图所示,下列有关说法
制取C的太阳能工艺如图所示,下列有关说法错误 的是( 代表阿伏加德罗常数的值)
代表阿伏加德罗常数的值)
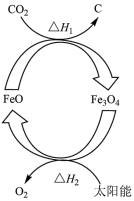
 制取C的太阳能工艺如图所示,下列有关说法
制取C的太阳能工艺如图所示,下列有关说法 代表阿伏加德罗常数的值)
代表阿伏加德罗常数的值)
A.分解 转移的电子数为 转移的电子数为 |
B.根据盖斯定律, |
C. 在该工艺过程中起催化作用 在该工艺过程中起催化作用 |
| D.该工艺将太阳能转化为化学能 |
您最近一年使用:0次
9-10高一下·江西·期中
5 . 已知一定条件下,有下列反应(相同质量的金刚石、石墨完全反应):
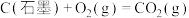
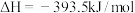
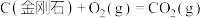
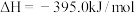
据此判断,下列说法正确的是
| A.由石墨制备金刚石是吸热反应,等质量时,石墨的能量比金刚石的低 |
| B.由石墨制备金刚石是吸热反应,等质量时,石墨的能量比金刚石的高 |
| C.由石墨制备金刚石是放热反应,等质量时,石墨的能量比金刚石的低 |
| D.由石墨制备金刚石是放热反应,等质量时,石墨的能量比金刚石的高 |
您最近一年使用:0次
2023-10-26更新
|
113次组卷
|
34卷引用:2010年甘肃省康县一中高二第二学期期末考试化学试题
(已下线)2010年甘肃省康县一中高二第二学期期末考试化学试题(已下线)2013-2014山西省广灵县第一中学第二学期期末考试高一化学试卷2015-2016学年安徽省阜阳市太和八中高二上学期期末理化学试卷黑龙江省大庆市第十中学2016-2017学年高一下学期期末考试化学试题甘肃省甘谷县第一中学2018-2019学年高二上学期第一次月考子材班化学试题陕西省西安市第八十九中学2022-2023学年高二上学期期末测试化学试题(已下线)09~10年江西四校高一下学期期中联考化学卷(已下线)2011-2012年山西省平遥中学高二上学期期中考试化学(理)试卷(已下线)2011-2012年陕西宁强天津中学高二下学期期中考试化学试卷(已下线)2012年人教版高中化学必修二2.1 化学能与热能练习卷(已下线)2012-2013学年福建省东山县第二中学高二第一次月考化学试卷(已下线)2012-2013学年昆明三中、滇池中学(滇中)高二下期中考试化学卷(已下线)2012-2013学年河北省石家庄市第一中学高一下学期期中考试化学试卷(已下线)2013届河北省石家庄市第二实验中学高二上学期期中考试文科化学试卷(已下线)2014-2015学年北京市第六十六中学高二上第一次质量检测化学试卷2014-2015浙江省杭州市西湖高级中学高一下学期5月月考化学试卷2015-2016学年湖南省岳阳县第一中学高二上学期第一次月考化学试卷2015-2016学年浙江省台州市书生中学高二上学期第一次月考化学试卷2015-2016学年福建省漳州市东山二中高二上第一次月考化学试卷河北省景县中学2017-2018学年高二开学摸底考试化学试题福建省惠安惠南中学2017-2018学年高二10月月考(理)化学试题福建省东山县第二中学2018-2019学年高二上学期第一次(10月)月考化学试题山西省应县第一中学校2018-2019学年高一下学期期中考试化学试题福建省长泰县第一中学2020届高三上学期期中考试化学试题云南省楚雄市楚雄实验中学2018—2019学年高二上学期9月月考化学试题山西省晋中市和诚中学2019-2020学年高一4月月考化学试题安徽省阜阳市2019-2020学年高一下学期开学考化学试题江西省赣州市赣县第三中学2020-2021学年高二上学期9月入学考试化学试题(重点班)天津市静海区大邱庄中学2020-2021学年高二上学期第一次月考化学试题宁夏吴忠市吴忠中学2021-2022学年高二上学期月考化学试题陕西省宜君县高级中学2021-2022学年高二上学期第一次月考化学(理)试题天津市第四十七中学2023-2024学年高二上学期10月月考化学试题天津市第四十七中学2023-2024学年高二上学期第一次月考化学试题云南省保山市腾冲市第八中学2020-2021学年高一下学期期中考试化学试题
6 . 当今世界多国相继规划了碳达峰、碳中和的时间节点,降低空气中二氧化碳含量成为研究热点。因此,研发二氧化碳的利用技术,将二氧化碳转化为能源是缓解环境和能源问题的方案之一、请回答下列问题:
Ⅰ. 耦合乙苯(
耦合乙苯( )脱氢制备苯乙烯(
)脱氢制备苯乙烯( )是综合利用
)是综合利用 的热点研究领域。制备苯乙烯涉及的主要反应如下:
的热点研究领域。制备苯乙烯涉及的主要反应如下:
i、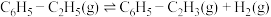

ii、

iii、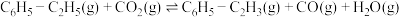
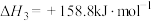
(1)
_____  。当反应达到平衡时,要提高
。当反应达到平衡时,要提高 的平衡产率,可采取的措施为
的平衡产率,可采取的措施为_____ (任写一种)。
(2)在某恒温恒容容器中发生 耦合乙苯(
耦合乙苯( )脱氢制备苯乙烯(
)脱氢制备苯乙烯( )的反应,下列能说明反应达到平衡的是_____(填标号)。
)的反应,下列能说明反应达到平衡的是_____(填标号)。
(3)恒压0.1MPa下,将原料气配比改为下列三种情况:只有 、
、 :
: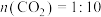 (对应曲线3)、
(对应曲线3)、 仅发生反应下i、ii,测得
仅发生反应下i、ii,测得 的平衡转化率与温度的变化关系如图1所示。
的平衡转化率与温度的变化关系如图1所示。
①图中表示原料气配比仅 的曲线是曲线
的曲线是曲线_____ (填“1”或“2”)。
②A点时, 的物质的量分数为0.01,该条件下反应i的
的物质的量分数为0.01,该条件下反应i的
_____ (分压=总压×物质的量分数)MPa.
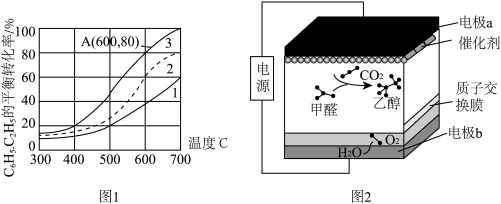
Ⅱ.中科院化学所研究出了一种常温常压下通过电化学共还原 和甲醛进行偶联的方法,该方法能够同时实现甲醛的处理与
和甲醛进行偶联的方法,该方法能够同时实现甲醛的处理与 的高附加值转化,其工作原理如图2所示,总反应为
的高附加值转化,其工作原理如图2所示,总反应为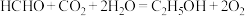 。
。
(4)电极b的电极反应式为_____ ,每生成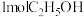 ,电路中转移的电子数为
,电路中转移的电子数为_____  。
。
Ⅰ.
 耦合乙苯(
耦合乙苯( )脱氢制备苯乙烯(
)脱氢制备苯乙烯( )是综合利用
)是综合利用 的热点研究领域。制备苯乙烯涉及的主要反应如下:
的热点研究领域。制备苯乙烯涉及的主要反应如下:i、
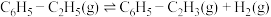

ii、


iii、
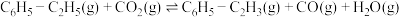
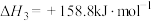
(1)

 。当反应达到平衡时,要提高
。当反应达到平衡时,要提高 的平衡产率,可采取的措施为
的平衡产率,可采取的措施为(2)在某恒温恒容容器中发生
 耦合乙苯(
耦合乙苯( )脱氢制备苯乙烯(
)脱氢制备苯乙烯( )的反应,下列能说明反应达到平衡的是_____(填标号)。
)的反应,下列能说明反应达到平衡的是_____(填标号)。| A.容器内压强不再发生变化 |
| B.CO的百分含量不再发生变化 |
| C.容器内混合气体的密度不再发生变化 |
D.每消耗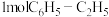 的同时生成 的同时生成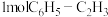 |
 、
、 :
: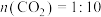 (对应曲线3)、
(对应曲线3)、 仅发生反应下i、ii,测得
仅发生反应下i、ii,测得 的平衡转化率与温度的变化关系如图1所示。
的平衡转化率与温度的变化关系如图1所示。
①图中表示原料气配比仅
 的曲线是曲线
的曲线是曲线②A点时,
 的物质的量分数为0.01,该条件下反应i的
的物质的量分数为0.01,该条件下反应i的
Ⅱ.中科院化学所研究出了一种常温常压下通过电化学共还原
 和甲醛进行偶联的方法,该方法能够同时实现甲醛的处理与
和甲醛进行偶联的方法,该方法能够同时实现甲醛的处理与 的高附加值转化,其工作原理如图2所示,总反应为
的高附加值转化,其工作原理如图2所示,总反应为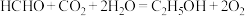 。
。(4)电极b的电极反应式为
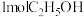 ,电路中转移的电子数为
,电路中转移的电子数为 。
。
您最近一年使用:0次
2023-06-29更新
|
298次组卷
|
3卷引用:甘肃省靖远县第一中学2022-2023学年高二下学期期末练习化学试题
名校
7 . 回答下列问题
(1)在一定条件下,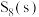 和
和 (g)发生反应依次转化为
(g)发生反应依次转化为 (g)和
(g)和 (g)。反应过程和能量关系可用如图简单表示(图中的
(g)。反应过程和能量关系可用如图简单表示(图中的 表示生成1mol产物的数据)
表示生成1mol产物的数据)

①写出表示 燃烧热的热化学方程式:
燃烧热的热化学方程式:_______ 。
②写出 分解生成
分解生成 和
和 的热化学方程式:
的热化学方程式:_______ 。
(2)恒温恒容条件下,硫可以发生如下转化,其反应过程和能量关系如图所示。
已知:
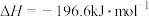
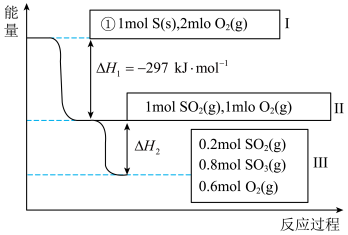
①写出能表示硫的燃烧热的热化学方程式:_______ 。
②
_______  。
。
(3) 焙烧产生的
焙烧产生的 可用于制硫酸。
可用于制硫酸。
已知25℃、101kPa时,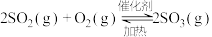
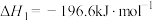
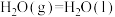
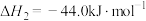 ;
;
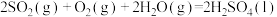
 ;
;
则 (g)与
(g)与 反应生成
反应生成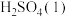 的热化学方程式是
的热化学方程式是_______ 。
(1)在一定条件下,
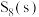 和
和 (g)发生反应依次转化为
(g)发生反应依次转化为 (g)和
(g)和 (g)。反应过程和能量关系可用如图简单表示(图中的
(g)。反应过程和能量关系可用如图简单表示(图中的 表示生成1mol产物的数据)
表示生成1mol产物的数据)
①写出表示
 燃烧热的热化学方程式:
燃烧热的热化学方程式:②写出
 分解生成
分解生成 和
和 的热化学方程式:
的热化学方程式:(2)恒温恒容条件下,硫可以发生如下转化,其反应过程和能量关系如图所示。
已知:

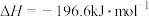

①写出能表示硫的燃烧热的热化学方程式:
②

 。
。(3)
 焙烧产生的
焙烧产生的 可用于制硫酸。
可用于制硫酸。已知25℃、101kPa时,
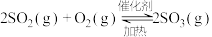
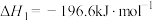
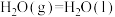
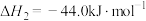 ;
;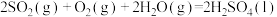
 ;
;则
 (g)与
(g)与 反应生成
反应生成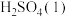 的热化学方程式是
的热化学方程式是
您最近一年使用:0次
8 . 工业上常利用 和
和 合成尿素
合成尿素 ,该可逆反应分两步进行,整个过程中的能量变化如图所示。下列说法错误的是
,该可逆反应分两步进行,整个过程中的能量变化如图所示。下列说法错误的是
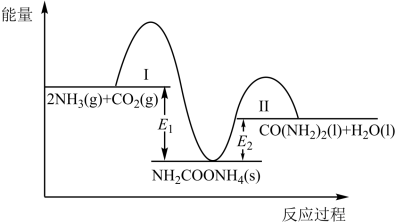
 和
和 合成尿素
合成尿素 ,该可逆反应分两步进行,整个过程中的能量变化如图所示。下列说法错误的是
,该可逆反应分两步进行,整个过程中的能量变化如图所示。下列说法错误的是
A. 为合成尿素反应的中间产物 为合成尿素反应的中间产物 |
B.利用 和 和 合成尿素是放热反应 合成尿素是放热反应 |
| C.反应II在热力学上进行趋势很大 |
D.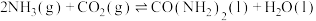 的焓变 的焓变 |
您最近一年使用:0次
2023-01-12更新
|
237次组卷
|
2卷引用:甘肃天祝藏族自治县第一中学2022-2023学年高二上学期1月期末考试化学试题
名校
9 . HCl气体被氧气氧化的能量关系如图,下列叙述正确的是


A.该反应 、 、 |
B.该反应的浓度平衡常数 |
C.用E表示键能,则该反应 |
D.反应 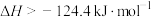 |
您最近一年使用:0次
2023-01-11更新
|
320次组卷
|
3卷引用:甘肃省庆阳市2022-2023学年高二上学期期末考试化学试题
名校
10 . 二氧化碳是常见的温室气体, 的回收利用是环保领域研究的热点课题。请回答下列问题:
的回收利用是环保领域研究的热点课题。请回答下列问题:
(1)利用 和
和 合成甲醇,下列为合成甲醇的有关化学方程式:
合成甲醇,下列为合成甲醇的有关化学方程式:
①
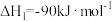
②

③

上述反应中
___________  。
。
(2)以 与
与 为原料可以合成尿素[
为原料可以合成尿素[ ],合成尿素的反应为
],合成尿素的反应为 。
。
①在不同温度及不同y值下合成尿素,达到平衡时,氨气转化率的变化情况如图所示,该反应的
___________ (填“>”“<”或“=”,下同)0,其他条件相同时,若y表示压强,则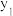
___________ 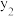 ,若y表示反应开始时的氨碳比[
,若y表示反应开始时的氨碳比[ ],则
],则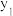
___________ 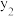 。
。

②T℃时,若向某压强为 的恒压密闭容器中充入
的恒压密闭容器中充入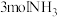 和
和 ,发生反应
,发生反应 ,达到平衡时,容器的体积变为开始时的
,达到平衡时,容器的体积变为开始时的 ,该条件下
,该条件下 的平衡转化率为
的平衡转化率为___________ ,T℃时,该反应的平衡常数
___________ (用含 的代数式表示,利用各物质的平衡分压计算)。再向该容器中充入
的代数式表示,利用各物质的平衡分压计算)。再向该容器中充入 和
和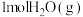 ,
, 的反应速率:
的反应速率:
___________  (填“>”“<”或“=”)。
(填“>”“<”或“=”)。
(3)某甲醇燃料电池的工作原理如图所示,质子交换膜(只有质子能够通过)左右两侧的溶液均为1L2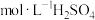 溶液,电极a的电极反应式为
溶液,电极a的电极反应式为___________ ,当导线中有1mol 转移时,左右两侧溶液的质量差为
转移时,左右两侧溶液的质量差为___________ g(假设反应物耗尽,忽略气质子交换膜体的溶解)。

 的回收利用是环保领域研究的热点课题。请回答下列问题:
的回收利用是环保领域研究的热点课题。请回答下列问题:(1)利用
 和
和 合成甲醇,下列为合成甲醇的有关化学方程式:
合成甲醇,下列为合成甲醇的有关化学方程式:①

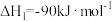
②


③


上述反应中

 。
。(2)以
 与
与 为原料可以合成尿素[
为原料可以合成尿素[ ],合成尿素的反应为
],合成尿素的反应为 。
。①在不同温度及不同y值下合成尿素,达到平衡时,氨气转化率的变化情况如图所示,该反应的

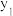
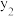 ,若y表示反应开始时的氨碳比[
,若y表示反应开始时的氨碳比[ ],则
],则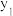
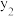 。
。
②T℃时,若向某压强为
 的恒压密闭容器中充入
的恒压密闭容器中充入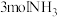 和
和 ,发生反应
,发生反应 ,达到平衡时,容器的体积变为开始时的
,达到平衡时,容器的体积变为开始时的 ,该条件下
,该条件下 的平衡转化率为
的平衡转化率为
 的代数式表示,利用各物质的平衡分压计算)。再向该容器中充入
的代数式表示,利用各物质的平衡分压计算)。再向该容器中充入 和
和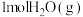 ,
, 的反应速率:
的反应速率:
 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。(3)某甲醇燃料电池的工作原理如图所示,质子交换膜(只有质子能够通过)左右两侧的溶液均为1L2
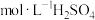 溶液,电极a的电极反应式为
溶液,电极a的电极反应式为 转移时,左右两侧溶液的质量差为
转移时,左右两侧溶液的质量差为
您最近一年使用:0次
2022-01-26更新
|
252次组卷
|
3卷引用:甘肃省酒泉市2022-2023学年高二上学期1月期末考试化学试题



