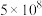二氧化碳是常见的温室气体, 的回收利用是环保领域研究的热点课题。请回答下列问题:
的回收利用是环保领域研究的热点课题。请回答下列问题:
(1)利用 和
和 合成甲醇,下列为合成甲醇的有关化学方程式:
合成甲醇,下列为合成甲醇的有关化学方程式:
①
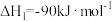
②

③

上述反应中
___________  。
。
(2)以 与
与 为原料可以合成尿素[
为原料可以合成尿素[ ],合成尿素的反应为
],合成尿素的反应为 。
。
①在不同温度及不同y值下合成尿素,达到平衡时,氨气转化率的变化情况如图所示,该反应的
___________ (填“>”“<”或“=”,下同)0,其他条件相同时,若y表示压强,则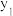
___________ 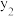 ,若y表示反应开始时的氨碳比[
,若y表示反应开始时的氨碳比[ ],则
],则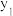
___________ 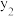 。
。

②T℃时,若向某压强为 的恒压密闭容器中充入
的恒压密闭容器中充入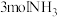 和
和 ,发生反应
,发生反应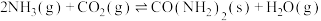 ,达到平衡时,容器的体积变为开始时的
,达到平衡时,容器的体积变为开始时的 ,该条件下
,该条件下 的平衡转化率为
的平衡转化率为___________ ,T℃时,该反应的平衡常数
___________ (用含 的代数式表示,利用各物质的平衡分压计算)。再向该容器中充入
的代数式表示,利用各物质的平衡分压计算)。再向该容器中充入 和
和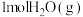 ,
, 的反应速率:
的反应速率:
___________  (填“>”“<”或“=”)。
(填“>”“<”或“=”)。
(3)某甲醇燃料电池的工作原理如图所示,质子交换膜(只有质子能够通过)左右两侧的溶液均为1L2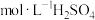 溶液,电极a的电极反应式为
溶液,电极a的电极反应式为___________ ,当导线中有1mol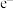 转移时,左右两侧溶液的质量差为
转移时,左右两侧溶液的质量差为___________ g(假设反应物耗尽,忽略气质子交换膜体的溶解)。

 的回收利用是环保领域研究的热点课题。请回答下列问题:
的回收利用是环保领域研究的热点课题。请回答下列问题:(1)利用
 和
和 合成甲醇,下列为合成甲醇的有关化学方程式:
合成甲醇,下列为合成甲醇的有关化学方程式:①

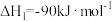
②


③


上述反应中

 。
。(2)以
 与
与 为原料可以合成尿素[
为原料可以合成尿素[ ],合成尿素的反应为
],合成尿素的反应为 。
。①在不同温度及不同y值下合成尿素,达到平衡时,氨气转化率的变化情况如图所示,该反应的

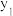
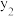 ,若y表示反应开始时的氨碳比[
,若y表示反应开始时的氨碳比[ ],则
],则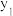
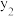 。
。
②T℃时,若向某压强为
 的恒压密闭容器中充入
的恒压密闭容器中充入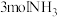 和
和 ,发生反应
,发生反应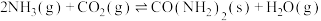 ,达到平衡时,容器的体积变为开始时的
,达到平衡时,容器的体积变为开始时的 ,该条件下
,该条件下 的平衡转化率为
的平衡转化率为
 的代数式表示,利用各物质的平衡分压计算)。再向该容器中充入
的代数式表示,利用各物质的平衡分压计算)。再向该容器中充入 和
和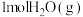 ,
, 的反应速率:
的反应速率:
 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。(3)某甲醇燃料电池的工作原理如图所示,质子交换膜(只有质子能够通过)左右两侧的溶液均为1L2
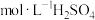 溶液,电极a的电极反应式为
溶液,电极a的电极反应式为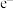 转移时,左右两侧溶液的质量差为
转移时,左右两侧溶液的质量差为
更新时间:2022-01-26 10:10:15
|
相似题推荐
解答题-原理综合题
|
适中
(0.65)
名校
【推荐1】铁在自然界分布广泛,在工业、农业和国防科技中有重要应用。

回答下列问题:
(1)用铁矿石(赤铁矿)冶炼生铁的高炉如图(a)所示。原料中除铁矿石和焦炭外含有____________ 。除去铁矿石中脉石(主要成分为SiO2)的化学反应方程式为______________ 、______________ ;高炉排出气体的主要成分有N2、CO2和______________ (填化学式)。
(2)已知:①Fe2O3(s)+3C(s)=2Fe(s)+3CO(g) ΔH=+494kJ·mol-1
②CO(g)+ O2(g)=CO2(g) ΔH=-283kJ·mol-1
O2(g)=CO2(g) ΔH=-283kJ·mol-1
③C(s)+ O2(g)=CO(g) ΔH=-110kJ·mol-1
O2(g)=CO(g) ΔH=-110kJ·mol-1
则反应Fe2O3(s)+3C(s)+ O2(g)=2Fe(s)+3CO2(g) 的ΔH=
O2(g)=2Fe(s)+3CO2(g) 的ΔH=________ kJ·mol-1。理论上反应________ 放出的热量足以供给反应__________ 所需的热量(填上述方程式序号)
(3)有人设计出“二步熔融还原法”炼铁工艺,其流程如图(b)所示,其中,还原竖炉相当于高炉的_____ 部分,主要反应的化学方程式为_________________________ ;熔融造气炉相当于高炉的____ 部分。
(4)铁矿石中常含有硫,使高炉气中混有SO2污染空气,脱SO2的方法是________________ 。

回答下列问题:
(1)用铁矿石(赤铁矿)冶炼生铁的高炉如图(a)所示。原料中除铁矿石和焦炭外含有
(2)已知:①Fe2O3(s)+3C(s)=2Fe(s)+3CO(g) ΔH=+494kJ·mol-1
②CO(g)+
 O2(g)=CO2(g) ΔH=-283kJ·mol-1
O2(g)=CO2(g) ΔH=-283kJ·mol-1③C(s)+
 O2(g)=CO(g) ΔH=-110kJ·mol-1
O2(g)=CO(g) ΔH=-110kJ·mol-1则反应Fe2O3(s)+3C(s)+
 O2(g)=2Fe(s)+3CO2(g) 的ΔH=
O2(g)=2Fe(s)+3CO2(g) 的ΔH=(3)有人设计出“二步熔融还原法”炼铁工艺,其流程如图(b)所示,其中,还原竖炉相当于高炉的
(4)铁矿石中常含有硫,使高炉气中混有SO2污染空气,脱SO2的方法是
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐2】甲醇是重要的化工原料,又可作为燃料。利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主反应如下:
①CO(g)+2H2(g) CH3OH(g) ΔH1
CH3OH(g) ΔH1
②CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH2
CH3OH(g)+H2O(g) ΔH2
③CO2(g)+H2(g) CO(g)+H2O(g) ΔH3
CO(g)+H2O(g) ΔH3
回答下列问题:
(1)已知反应①中的相关的化学键键能数据如下:
已知ΔH2=-58 kJ·mol-1,由此计算ΔH3=________ kJ·mol-1。
(2)图1中能正确反映平衡常数K随温度变化关系的曲线为________ (填曲线标记字母),其判断理由是___________________________________________________ 。

(3)合成气的组成n(H2)/n(CO+CO2)=2.60时,体系中的CO平衡转化率(α)与温度和压强的关系如图2所示。α(CO)值随温度升高而________ (填“增大”或“减小”),其原因是______________________________________________________ 。图2中的压强由大到小为__________ ,其判断理由是___________________________________ 。
①CO(g)+2H2(g)
 CH3OH(g) ΔH1
CH3OH(g) ΔH1②CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) ΔH2
CH3OH(g)+H2O(g) ΔH2③CO2(g)+H2(g)
 CO(g)+H2O(g) ΔH3
CO(g)+H2O(g) ΔH3回答下列问题:
(1)已知反应①中的相关的化学键键能数据如下:
| 化学键 | H—H | C—O | C←=O | H—O | C—H |
| E/(kJ·mol-1) | 436 | 343 | 1076 | 465 | 413 |
已知ΔH2=-58 kJ·mol-1,由此计算ΔH3=
(2)图1中能正确反映平衡常数K随温度变化关系的曲线为

(3)合成气的组成n(H2)/n(CO+CO2)=2.60时,体系中的CO平衡转化率(α)与温度和压强的关系如图2所示。α(CO)值随温度升高而
您最近一年使用:0次
【推荐3】氢能源是公认的零碳消洁能源,用乙醇为原料可通过多种方法制氢,具有理想的应用前景。回答下列问题:
(一)乙醇催化重整制氢
原理:C2H5OH(g)+3H2O(g) 2CO2(g)+6H2(g)△H1
2CO2(g)+6H2(g)△H1
以Ni/凹凸棒石做催化剂,在2L刚性容器中,分别以水醇比为2:1、4:1、6:1、8:1投料(乙醇的起始物质的量相同),反应相同时间测得乙醇转化率随温度变化的关系如图所示。

已知:过多的水分子会占据催化剂表面活性位,导致反应速率降低:上图中水醇比为2:1时,各点均已达到平衡状态。
(1)反应热△H1________ 0(填“>”或“<”)。若乙醇的起始物质的量为n0mol,则K(400℃)=______________ (列出计算式)。
(2)400℃时,水醇比过高不利于乙醇转化的原因是____________________________ ;B、C、D三点中,一定未达到平衡状态的是______________ (填标号)。
(二)乙醇氧化制氢
原理:C2H5OH(g)+ O2(g)
O2(g) 2CO2(g)+3H2(g) △H2
2CO2(g)+3H2(g) △H2
(3)已知H2(g)+ O2(g)
O2(g) H2O(g) △H3,则△H2=
H2O(g) △H3,则△H2=_____ (用含△H1和△H3的式子表示)。在密闭容器中通入一定量的乙醇和氧气,达到平衡状态后增大容器体积,则混合气体的平均相对分子质量将_________ (填“增大”“减小”或“不变”)。
(三)乙醇电解法制氢
乙醇电解法不仅可以利用乙醇本身的氢,还可以从水中获得氢,且电解乙醇所需电压比电解水的理论电压要低很多。

(4)利用如图所示装过(MEA为复杂的膜电极)电解乙醇制氢,阳极的电极反式应为___________ ,理论上每转移lmol电子,可以产生________ L氢气(标准状况下)。
(一)乙醇催化重整制氢
原理:C2H5OH(g)+3H2O(g)
 2CO2(g)+6H2(g)△H1
2CO2(g)+6H2(g)△H1以Ni/凹凸棒石做催化剂,在2L刚性容器中,分别以水醇比为2:1、4:1、6:1、8:1投料(乙醇的起始物质的量相同),反应相同时间测得乙醇转化率随温度变化的关系如图所示。

已知:过多的水分子会占据催化剂表面活性位,导致反应速率降低:上图中水醇比为2:1时,各点均已达到平衡状态。
(1)反应热△H1
(2)400℃时,水醇比过高不利于乙醇转化的原因是
(二)乙醇氧化制氢
原理:C2H5OH(g)+
 O2(g)
O2(g) 2CO2(g)+3H2(g) △H2
2CO2(g)+3H2(g) △H2(3)已知H2(g)+
 O2(g)
O2(g) H2O(g) △H3,则△H2=
H2O(g) △H3,则△H2=(三)乙醇电解法制氢
乙醇电解法不仅可以利用乙醇本身的氢,还可以从水中获得氢,且电解乙醇所需电压比电解水的理论电压要低很多。

(4)利用如图所示装过(MEA为复杂的膜电极)电解乙醇制氢,阳极的电极反式应为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐1】Ⅰ.氮的固定是几百年来科学家一直研究的课题。
(1)下表列举了不同温度下大气固氮和工业固氮的部分化学平衡常数K的值。.
①分析数据可知:大气固氮反应属于__________ (填“吸热”或“放热”)反应。
②分析数据可知:人类不适合大规模模拟大气固氮的原因:__________ 。
(2)工业固氮反应中,在其他条件相同时,分别测定 的平衡转化率在不同压强(
的平衡转化率在不同压强( 、
、 )下随温度变化的曲线,下图所示的图示中,正确的是
)下随温度变化的曲线,下图所示的图示中,正确的是______ (填“A”或“B”);比较 、
、 的大小关系:
的大小关系:__________ 。
Ⅱ.目前工业合成氨的原理是 。
。
(3)在一定温度下,将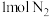 和
和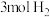 混合置于体积不变的密闭容器中发生反应。
混合置于体积不变的密闭容器中发生反应。
①下列描述能说明反应达到平衡状态的是__________ (填字母)。
A.单位时间内消耗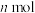 的
的 同时消耗
同时消耗 的
的
B. 、
、 、
、 的浓度相等
的浓度相等
C.混合气体的平均相对分子质量不变
D.混合气体的密度不变
②已知450℃时,某时刻测得 ,
, ,
, ,此时可逆反应
,此时可逆反应__________ 。
A.向正方向进行 B.向逆方向进行 C.处于平衡状态
(1)下表列举了不同温度下大气固氮和工业固氮的部分化学平衡常数K的值。.
| 反应 | 大气固氮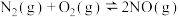 | 工业固氮 | |||
温度/℃ | 27 | 2000 | 25 | 400 | 450 |
平衡常数K |
| 0.1 |
| 0.507 | 0.152 |
②分析数据可知:人类不适合大规模模拟大气固氮的原因:
(2)工业固氮反应中,在其他条件相同时,分别测定
 的平衡转化率在不同压强(
的平衡转化率在不同压强( 、
、 )下随温度变化的曲线,下图所示的图示中,正确的是
)下随温度变化的曲线,下图所示的图示中,正确的是 、
、 的大小关系:
的大小关系:
Ⅱ.目前工业合成氨的原理是
 。
。(3)在一定温度下,将
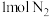 和
和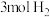 混合置于体积不变的密闭容器中发生反应。
混合置于体积不变的密闭容器中发生反应。①下列描述能说明反应达到平衡状态的是
A.单位时间内消耗
 的
的 同时消耗
同时消耗 的
的
B.
 、
、 、
、 的浓度相等
的浓度相等C.混合气体的平均相对分子质量不变
D.混合气体的密度不变
②已知450℃时,某时刻测得
 ,
, ,
, ,此时可逆反应
,此时可逆反应A.向正方向进行 B.向逆方向进行 C.处于平衡状态
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐2】汽车尾气中含有较多的氮氧化物和不完全燃烧的CO,汽车三元催化器可以实现降低氮氧化物的排放量。汽车尾气中的NO(g)和CO(g)在催化剂的作用下转化成两种无污染的气体。
已知:N2(g)+O2(g)⇌2NO(g) ∆H1=+180.0kJ·mol-1,CO的燃烧热为-283.5kJ·mol-l
(1)请写出CO燃烧的热化学方程式:___________
(2)则反应I.2CO(g)+2NO(g)⇌N2(g)+2CO2(g)的 ∆H=___________ kJ·mol-1
(3)若在恒容的密闭容器中,充入2molCO和1molNO,发生反应I,下列选项中不能说明该反应已经达到平衡状态的是___________ 。
a.CO和NO的物质的量之比不变 b.混合气体的密度保持不变
c.混合气体的压强保持不变 d.2v(N2)正=v(CO)逆
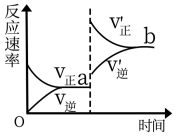
(4)对于反应I,在t时刻改变某个条件时速率随时间的变化如图所示,则改变的条件是:___________ 。
已知:N2(g)+O2(g)⇌2NO(g) ∆H1=+180.0kJ·mol-1,CO的燃烧热为-283.5kJ·mol-l
(1)请写出CO燃烧的热化学方程式:
(2)则反应I.2CO(g)+2NO(g)⇌N2(g)+2CO2(g)的 ∆H=
(3)若在恒容的密闭容器中,充入2molCO和1molNO,发生反应I,下列选项中不能说明该反应已经达到平衡状态的是
a.CO和NO的物质的量之比不变 b.混合气体的密度保持不变
c.混合气体的压强保持不变 d.2v(N2)正=v(CO)逆
(4)对于反应I,在t时刻改变某个条件时速率随时间的变化如图所示,则改变的条件是:

您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐3】为应对全球气候问题,中国政府承诺“2030年碳达峰”,“2060年碳中和”。研究如何转化 和
和 ,对减少温室气体的排放,改善大气环境具有重要的意义。
,对减少温室气体的排放,改善大气环境具有重要的意义。
(1) 催化重整反应为:
催化重整反应为: 。
。
已知: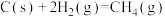

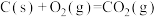



该催化重整反应的
___________  。有利于提高
。有利于提高 平衡转化率的条件是
平衡转化率的条件是___________ (填标号)。
A.高温低压 B.低温高压 C.高温高压 D.低温低压
(2)t℃的恒容密闭容器中, 和
和 的分压分别为20kPa、25kPa,加入
的分压分别为20kPa、25kPa,加入 催化剂使其发生反应
催化剂使其发生反应 。研究表明CO的生成速率
。研究表明CO的生成速率 ,某时刻t℃下测得p(CO)=20kPa,则
,某时刻t℃下测得p(CO)=20kPa,则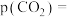
___________  ,
,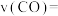
___________  。
。
(3)在密闭容器中通入物质的量均为0.1mol的 和
和 ,在一定条件下发生反应
,在一定条件下发生反应 ,
, 的平衡转化率与温度及压强的关系如图所示。
的平衡转化率与温度及压强的关系如图所示。

①由上图可知:压强
___________  (选填“>”、“<”或“=”),理由是
(选填“>”、“<”或“=”),理由是___________ 。
②Y点:v(正)___________ v(逆)(选填“>”、“<”或“=”);已知气体分压(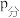 )=气体总压(
)=气体总压(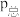 )×气体的物质的量分数。用平衡分压代替平衡浓度可以得到平衡常数Kp,已知P2=aPa求X点对应温度下反应的平衡常数Kp=
)×气体的物质的量分数。用平衡分压代替平衡浓度可以得到平衡常数Kp,已知P2=aPa求X点对应温度下反应的平衡常数Kp=___________ 。
 和
和 ,对减少温室气体的排放,改善大气环境具有重要的意义。
,对减少温室气体的排放,改善大气环境具有重要的意义。(1)
 催化重整反应为:
催化重整反应为: 。
。已知:
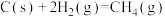

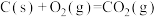



该催化重整反应的

 。有利于提高
。有利于提高 平衡转化率的条件是
平衡转化率的条件是A.高温低压 B.低温高压 C.高温高压 D.低温低压
(2)t℃的恒容密闭容器中,
 和
和 的分压分别为20kPa、25kPa,加入
的分压分别为20kPa、25kPa,加入 催化剂使其发生反应
催化剂使其发生反应 。研究表明CO的生成速率
。研究表明CO的生成速率 ,某时刻t℃下测得p(CO)=20kPa,则
,某时刻t℃下测得p(CO)=20kPa,则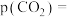
 ,
,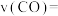
 。
。(3)在密闭容器中通入物质的量均为0.1mol的
 和
和 ,在一定条件下发生反应
,在一定条件下发生反应 ,
, 的平衡转化率与温度及压强的关系如图所示。
的平衡转化率与温度及压强的关系如图所示。
①由上图可知:压强

 (选填“>”、“<”或“=”),理由是
(选填“>”、“<”或“=”),理由是②Y点:v(正)
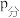 )=气体总压(
)=气体总压(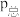 )×气体的物质的量分数。用平衡分压代替平衡浓度可以得到平衡常数Kp,已知P2=aPa求X点对应温度下反应的平衡常数Kp=
)×气体的物质的量分数。用平衡分压代替平衡浓度可以得到平衡常数Kp,已知P2=aPa求X点对应温度下反应的平衡常数Kp=
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐1】汽车尾气排放的CO、NOx等气体是大气污染的主要来源,NOx也是雾天气的主要成因之一。
(1)科学家研究利用催化技术将尾气中有害的NO和CO转变成无污染的气体,已知:
N2(g)+O2(g)=2NO(g) ΔH1=+180.5kJ·mol-1
2C(s)+O2(g)=2CO(g) ΔH2=-221.0kJ·mol-1
CO2(g)=C(s)+O2(g) ΔH3=+393.5kJ·mol-1
①C(s)的燃烧热ΔH=__ 。
②请写出CO和NO生成无污染气体的热化学方程式为__ 。
(2)往1L恒容密闭容器中充入一定量的NO2,在三种不同条件下发生反应:2NO2(g) 2NO(g)+O2(g),实验测得NO2的浓度随时间的变化如下表(均使用了催化剂,不考虑生成N2O4)。
2NO(g)+O2(g),实验测得NO2的浓度随时间的变化如下表(均使用了催化剂,不考虑生成N2O4)。
①下列说法正确的是__ 。
A.实验2容器内压强比实验1的小
B.在0→10min内实验2的反应速率υ(O2)=0.015mol/(L·min)
C.实验1比实验3的平衡常数大
D.实验2使用了比实验1效率更高的催化剂
②不能判断反应已达到化学平衡状态的是__ 。
A.容器内的气体压强不变
B.2v正(NO2)=v逆(O2)
C.气体的平均相对分子质量保持不变
D.NO2和NO的浓度比保持不变
③已知容器内的起始压强为P0kPa,在800℃温度下该反应的平衡常数Kp=__ (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。在该温度下达到平衡后,再向容器中加入NO2和NO各2mol,平衡将__ (填“向正反应方向移动”或“向逆反应方向移动”或“不移动”)。
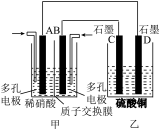
(3)若将NO2与O2通入甲中设计成如图所示装置,D电极上有红色物质析出,则A电极处通入的气体为__ (填化学式);A电极的电极反应式为__ 。
(1)科学家研究利用催化技术将尾气中有害的NO和CO转变成无污染的气体,已知:
N2(g)+O2(g)=2NO(g) ΔH1=+180.5kJ·mol-1
2C(s)+O2(g)=2CO(g) ΔH2=-221.0kJ·mol-1
CO2(g)=C(s)+O2(g) ΔH3=+393.5kJ·mol-1
①C(s)的燃烧热ΔH=
②请写出CO和NO生成无污染气体的热化学方程式为
(2)往1L恒容密闭容器中充入一定量的NO2,在三种不同条件下发生反应:2NO2(g)
 2NO(g)+O2(g),实验测得NO2的浓度随时间的变化如下表(均使用了催化剂,不考虑生成N2O4)。
2NO(g)+O2(g),实验测得NO2的浓度随时间的变化如下表(均使用了催化剂,不考虑生成N2O4)。| 时间(min) 浓度(mol/L) 实验序号/温度 | 0 | 10 | 20 | 30 | 40 | 50 |
| 实验1/800℃ | 1.00 | 0.80 | 0.65 | 0.55 | 0.50 | 0.50 |
| 实验2/800℃ | 1.00 | 0.70 | 0.50 | 0.50 | 0.50 | 0.50 |
| 实验3/850℃ | 1.00 | 0.50 | 0.40 | 0.35 | 0.35 | 0.35 |
A.实验2容器内压强比实验1的小
B.在0→10min内实验2的反应速率υ(O2)=0.015mol/(L·min)
C.实验1比实验3的平衡常数大
D.实验2使用了比实验1效率更高的催化剂
②不能判断反应已达到化学平衡状态的是
A.容器内的气体压强不变
B.2v正(NO2)=v逆(O2)
C.气体的平均相对分子质量保持不变
D.NO2和NO的浓度比保持不变
③已知容器内的起始压强为P0kPa,在800℃温度下该反应的平衡常数Kp=
(3)若将NO2与O2通入甲中设计成如图所示装置,D电极上有红色物质析出,则A电极处通入的气体为

您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐2】CO2的有效转化有助于我国实现2060年“碳中和”目标。将CO2和H2在催化剂作用下,可实现二氧化碳甲烷化。已知:
(1)写出CO2甲烷化生成气态水的热化学方程式______________________________________ 。
(2)二氧化碳甲烷化反应体系中,存在副反应:CO2(g)+ H2(g)= CO(g)+H2O(g) ΔH>0。向1L恒容密闭容器中通入1 mol CO2和5 mol H2,测得相同反应时间内,不同催化剂作用下温度对CO2转化率和CH4选择性的影响如图所示。

CH4选择性=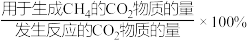
①写出一种既能提高二氧化碳甲烷化的反应速率又能提高甲烷产率的措施__________________________ 。
②反应温度在260°C ~320°C之间时,应选择__________ 为催化剂,该温度范围内,升高温度CH4的产率________ (填“增大”“减小”或“不变”)。
③温度高于320°C后,以Ni为催化剂,CO2的转化率随温度升高显著上升的原因是_______________ 。
④若A点表示320°C时的平衡状态,则容器中CH4的浓度为___________ mol·L-1,二氧化碳甲烷化反应的平衡常数K=_______ (mol·L-1)-2(用含a、b的表达式表示)。
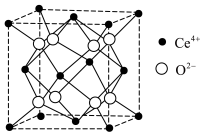
(3)CeO2理想晶胞如图所示。若晶胞边长为a nm, NA为阿伏加德罗常数的值。CeO2理想晶胞中Ce4+的配位数为__ ,CeO2晶体的密度为___________ g·cm-3。
键能 | C=O | H-H | C-H | H-O |
kJ·mol-1 | 803 | 436 | 414 | 464 |
(2)二氧化碳甲烷化反应体系中,存在副反应:CO2(g)+ H2(g)= CO(g)+H2O(g) ΔH>0。向1L恒容密闭容器中通入1 mol CO2和5 mol H2,测得相同反应时间内,不同催化剂作用下温度对CO2转化率和CH4选择性的影响如图所示。

CH4选择性=
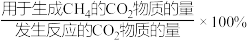
①写出一种既能提高二氧化碳甲烷化的反应速率又能提高甲烷产率的措施
②反应温度在260°C ~320°C之间时,应选择
③温度高于320°C后,以Ni为催化剂,CO2的转化率随温度升高显著上升的原因是
④若A点表示320°C时的平衡状态,则容器中CH4的浓度为
(3)CeO2理想晶胞如图所示。若晶胞边长为a nm, NA为阿伏加德罗常数的值。CeO2理想晶胞中Ce4+的配位数为

您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐3】化工原料异丁烯(i-C4H8)可由异丁烷(i-C4H10)直接催化脱氢制备,相关反应如下:
主反应:(i-C4H10)(g) (i-C4H8)(g)+H2(g) △H1
(i-C4H8)(g)+H2(g) △H1
副反应:(i-C4H10)(g) C3H6(g)+CH4(g) △H2>0
C3H6(g)+CH4(g) △H2>0
(1)已知(i-C4H10)(g)、(i-C4H8)(g)、H2(g)的燃烧热分别为△H3、△H4、△H5,则△H1=____ (用△H3、△H4、△H5表示)。
(2)实验室模拟异丁烷脱氢反应,改变温度、压强对异丁烷平衡转化率的影响如图所示:

△H1____ 0(填“>”或“<”),p1____ p2(填“>”或“<”)。
(3)一定温度和压强下,向异丁烷中充入惰性气体并发生脱氢反应,随着 的增大,异丁烷的平衡转化率
的增大,异丁烷的平衡转化率____ (填“增大”“减小”或“不变”)。
(4)一定条件下,在2L密闭容器中充入1mol异丁烷,t min后达到平衡状态,异丁烷的转化率为50%,其中异丁烯的选择性为80%,则生成异丁烯的速率v(i-C4H8)=____ 。脱氢反应的平衡常数K=____ 。(异丁烯的选择性= ×100%)
×100%)
(5)为提高脱氢反应的选择性,可采取的措施是____ 。
主反应:(i-C4H10)(g)
 (i-C4H8)(g)+H2(g) △H1
(i-C4H8)(g)+H2(g) △H1副反应:(i-C4H10)(g)
 C3H6(g)+CH4(g) △H2>0
C3H6(g)+CH4(g) △H2>0(1)已知(i-C4H10)(g)、(i-C4H8)(g)、H2(g)的燃烧热分别为△H3、△H4、△H5,则△H1=
(2)实验室模拟异丁烷脱氢反应,改变温度、压强对异丁烷平衡转化率的影响如图所示:

△H1
(3)一定温度和压强下,向异丁烷中充入惰性气体并发生脱氢反应,随着
 的增大,异丁烷的平衡转化率
的增大,异丁烷的平衡转化率(4)一定条件下,在2L密闭容器中充入1mol异丁烷,t min后达到平衡状态,异丁烷的转化率为50%,其中异丁烯的选择性为80%,则生成异丁烯的速率v(i-C4H8)=
 ×100%)
×100%)(5)为提高脱氢反应的选择性,可采取的措施是
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐1】以氧化铝为原料,通过碳热还原法可合成氮化铝(AlN);通过电解法可制取铝。回答下列问题:
(1)已知:2Al2O3(s)=4Al(g)+3O2(g) ΔH1=3351kJ·molˉ1
2C(s)+O2(g)=2CO(g) ΔH2=-221kJ·molˉ1
2Al(g)+N2(g)=2AlN(s) ΔH3=-318kJ·molˉ1
碳热还原Al2O3合成AlN的总热化学方程式是___ 。
(2)工业上用电解熔融氧化铝的方法来制取金属铝。纯净氧化铝的熔点很高(约2045℃),在实际生产中,通过加入助熔剂冰晶石(Na3AlF6)在1000℃左右就可以得到熔融体。
如图是电解槽的示意图。

①写出电解时阳极的电极反应式:___ 。
②电解过程中生成的氧气全部与石墨电极反应生成CO和CO2气体。因此,需要不断补充石墨电极。工业生产中,每生产9吨铝阳极损失5.4吨石墨。每生产9吨铝转移电子的物质的量为___ mol,生成的二氧化碳的物质的量为___ mol。
(3)可用于电动汽车的铝—空气燃料电池,通常以NaCl溶液或NaOH溶液为电解质溶液,以铝合金为负极。
①以NaCl溶液为电解质溶液时,正极反应式为___ 。
②以NaOH溶液为电解质溶液时,负极反应式为___ 。
(1)已知:2Al2O3(s)=4Al(g)+3O2(g) ΔH1=3351kJ·molˉ1
2C(s)+O2(g)=2CO(g) ΔH2=-221kJ·molˉ1
2Al(g)+N2(g)=2AlN(s) ΔH3=-318kJ·molˉ1
碳热还原Al2O3合成AlN的总热化学方程式是
(2)工业上用电解熔融氧化铝的方法来制取金属铝。纯净氧化铝的熔点很高(约2045℃),在实际生产中,通过加入助熔剂冰晶石(Na3AlF6)在1000℃左右就可以得到熔融体。
如图是电解槽的示意图。

①写出电解时阳极的电极反应式:
②电解过程中生成的氧气全部与石墨电极反应生成CO和CO2气体。因此,需要不断补充石墨电极。工业生产中,每生产9吨铝阳极损失5.4吨石墨。每生产9吨铝转移电子的物质的量为
(3)可用于电动汽车的铝—空气燃料电池,通常以NaCl溶液或NaOH溶液为电解质溶液,以铝合金为负极。
①以NaCl溶液为电解质溶液时,正极反应式为
②以NaOH溶液为电解质溶液时,负极反应式为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐2】某化学兴趣小组为了探索铝电极在原电池中的作用,设计并进行了以下一系列实验,实验结果记录如下:
根据上表中记录的实验现象,回答下列问题:
(1)与实验2中Al电极的作用相同的实验为___________ (填写实验编号)。
(2)实验1中镁为___________ 极,电极反应式为___________ 。
(3)实验4中铝为___________ 极,电极反应式为___________ ,若该实验反应一段时间后,收集到标准状况下的气体体积为224mL,则转移电子的物质的量为___________ 。
(4)实验5中指针偏向Al的原因为___________ 。
(5)根据实验结果总结出影响铝在原电池中做正极或负极的因素:___________ 。
| 实验编号 | 电极材料 | 电解质溶液 | 电流表指针偏转方向 |
| 1 | Mg、Al | 稀盐酸 | 偏向Al |
| 2 | Al、Cu | 稀盐酸 | 偏向Cu |
| 3 | Al、石 墨 | 稀盐酸 | 偏向石墨 |
| 4 | Mg、Al | NaOH溶液 | 偏向Mg |
| 5 | Zn、Al | 浓硝酸 | 偏向Al |
(1)与实验2中Al电极的作用相同的实验为
(2)实验1中镁为
(3)实验4中铝为
(4)实验5中指针偏向Al的原因为
(5)根据实验结果总结出影响铝在原电池中做正极或负极的因素:
您最近一年使用:0次