汽车尾气排放的CO、NOx等气体是大气污染的主要来源,NOx也是雾天气的主要成因之一。
(1)科学家研究利用催化技术将尾气中有害的NO和CO转变成无污染的气体,已知:
N2(g)+O2(g)=2NO(g) ΔH1=+180.5kJ·mol-1
2C(s)+O2(g)=2CO(g) ΔH2=-221.0kJ·mol-1
CO2(g)=C(s)+O2(g) ΔH3=+393.5kJ·mol-1
①C(s)的燃烧热ΔH=__ 。
②请写出CO和NO生成无污染气体的热化学方程式为__ 。
(2)往1L恒容密闭容器中充入一定量的NO2,在三种不同条件下发生反应:2NO2(g) 2NO(g)+O2(g),实验测得NO2的浓度随时间的变化如下表(均使用了催化剂,不考虑生成N2O4)。
2NO(g)+O2(g),实验测得NO2的浓度随时间的变化如下表(均使用了催化剂,不考虑生成N2O4)。
①下列说法正确的是__ 。
A.实验2容器内压强比实验1的小
B.在0→10min内实验2的反应速率υ(O2)=0.015mol/(L·min)
C.实验1比实验3的平衡常数大
D.实验2使用了比实验1效率更高的催化剂
②不能判断反应已达到化学平衡状态的是__ 。
A.容器内的气体压强不变
B.2v正(NO2)=v逆(O2)
C.气体的平均相对分子质量保持不变
D.NO2和NO的浓度比保持不变
③已知容器内的起始压强为P0kPa,在800℃温度下该反应的平衡常数Kp=__ (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。在该温度下达到平衡后,再向容器中加入NO2和NO各2mol,平衡将__ (填“向正反应方向移动”或“向逆反应方向移动”或“不移动”)。
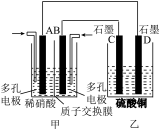
(3)若将NO2与O2通入甲中设计成如图所示装置,D电极上有红色物质析出,则A电极处通入的气体为__ (填化学式);A电极的电极反应式为__ 。
(1)科学家研究利用催化技术将尾气中有害的NO和CO转变成无污染的气体,已知:
N2(g)+O2(g)=2NO(g) ΔH1=+180.5kJ·mol-1
2C(s)+O2(g)=2CO(g) ΔH2=-221.0kJ·mol-1
CO2(g)=C(s)+O2(g) ΔH3=+393.5kJ·mol-1
①C(s)的燃烧热ΔH=
②请写出CO和NO生成无污染气体的热化学方程式为
(2)往1L恒容密闭容器中充入一定量的NO2,在三种不同条件下发生反应:2NO2(g)
 2NO(g)+O2(g),实验测得NO2的浓度随时间的变化如下表(均使用了催化剂,不考虑生成N2O4)。
2NO(g)+O2(g),实验测得NO2的浓度随时间的变化如下表(均使用了催化剂,不考虑生成N2O4)。| 时间(min) 浓度(mol/L) 实验序号/温度 | 0 | 10 | 20 | 30 | 40 | 50 |
| 实验1/800℃ | 1.00 | 0.80 | 0.65 | 0.55 | 0.50 | 0.50 |
| 实验2/800℃ | 1.00 | 0.70 | 0.50 | 0.50 | 0.50 | 0.50 |
| 实验3/850℃ | 1.00 | 0.50 | 0.40 | 0.35 | 0.35 | 0.35 |
A.实验2容器内压强比实验1的小
B.在0→10min内实验2的反应速率υ(O2)=0.015mol/(L·min)
C.实验1比实验3的平衡常数大
D.实验2使用了比实验1效率更高的催化剂
②不能判断反应已达到化学平衡状态的是
A.容器内的气体压强不变
B.2v正(NO2)=v逆(O2)
C.气体的平均相对分子质量保持不变
D.NO2和NO的浓度比保持不变
③已知容器内的起始压强为P0kPa,在800℃温度下该反应的平衡常数Kp=
(3)若将NO2与O2通入甲中设计成如图所示装置,D电极上有红色物质析出,则A电极处通入的气体为

更新时间:2020-05-14 12:42:12
|
相似题推荐
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐1】氮及其化合物在工农业生产和生命活动中起着重要的作用,铵盐、硝酸盐均是植物生长的“食物”,将氮气转化为氮气是植物获得“食物”的第一步,在常温常压下使N2高效地转化成为NH3是众多科学家们一直在探究的问题:

(1)已知:①4NH3(g)+5O2(g)⇌4NO(g)+6H2O(g)△H=﹣1025kJ•mol﹣1
②N2(g)+O2(g)⇌2NO(g)△H=+180.5kJ•mol﹣1水的汽化热△H=+44kJ•mol﹣1据报道,科学家已找到一种催化剂,使氨气与液态水在常温条件下转化为NH3及氧气,写出反应的热化学方程式____________________________________________________________ ;
(2)工业时合成氨的原理为:N2(g)+3H2(g)⇌2NH3(g)△H=﹣92.4kJ•mol﹣1 。图1表示H2的转化率与温度、压强之间的关系,图2表示H2的转化率与起始投料比[n(N2)/n(H2)]、压强的变化关系,则T1、T2、T3的大小关系为___ , 曲线与曲线对应的压强P1___ P2(填“>”“<”“=”).测得B(X,60)点时N2的转化率为40%,则X=______________________ 。
(3)一定温度下,将2molN2和6molH2置于一密闭容器中反应,测得平衡时容器的总压为aMPa,NH3的物质的量总数为20%,列式计算出此时的平衡常数Kp=___ (用平衡分压代替平衡浓度进行计算,分压=总压×体积分数,可不化简)。
下列各项中能说明反应已达到平衡状态的是_____________________ 。
a.混合气体的平均相对分子质量不变
b.N2的消耗速率等于NH3的生成速率
c.混合气体的密度不变
d.N2和H2的物质的量之比保持不变
(4)NH3催化剂生成NO,以NO为原料通过电解的方法可以制备NH4NO3, 其总反应是8NO+7H2═3NH4NO3+2HNO3, 试写出以惰性材料作电极的阴极反应式:___ . 电解过程中为使电解产物全部转化为NH4NO3, 需要补充NH3的原因是___ 。

(1)已知:①4NH3(g)+5O2(g)⇌4NO(g)+6H2O(g)△H=﹣1025kJ•mol﹣1
②N2(g)+O2(g)⇌2NO(g)△H=+180.5kJ•mol﹣1水的汽化热△H=+44kJ•mol﹣1据报道,科学家已找到一种催化剂,使氨气与液态水在常温条件下转化为NH3及氧气,写出反应的热化学方程式
(2)工业时合成氨的原理为:N2(g)+3H2(g)⇌2NH3(g)△H=﹣92.4kJ•mol﹣1 。图1表示H2的转化率与温度、压强之间的关系,图2表示H2的转化率与起始投料比[n(N2)/n(H2)]、压强的变化关系,则T1、T2、T3的大小关系为
(3)一定温度下,将2molN2和6molH2置于一密闭容器中反应,测得平衡时容器的总压为aMPa,NH3的物质的量总数为20%,列式计算出此时的平衡常数Kp=
下列各项中能说明反应已达到平衡状态的是
a.混合气体的平均相对分子质量不变
b.N2的消耗速率等于NH3的生成速率
c.混合气体的密度不变
d.N2和H2的物质的量之比保持不变
(4)NH3催化剂生成NO,以NO为原料通过电解的方法可以制备NH4NO3, 其总反应是8NO+7H2═3NH4NO3+2HNO3, 试写出以惰性材料作电极的阴极反应式:
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐2】温室效应和污染正在成为日益严重的环境问题。
Ⅰ.煤制得的化工原料中含有羰基硫(O=C=S),该物质可转化为H2S,主要反应如下:
①水解反应:COS(g)+H2O(g) H2S(g)+CO2(g) ΔH1=-94 kJ·mol-1
H2S(g)+CO2(g) ΔH1=-94 kJ·mol-1
②氢解反应:COS(g)+H2(g) H2S(g)+CO(g) ΔH2=-54 kJ·mol-1
H2S(g)+CO(g) ΔH2=-54 kJ·mol-1
(1)请计算CO(g)+H2O(g) H2(g)+CO2(g) ΔH3=
H2(g)+CO2(g) ΔH3=_________ kJ·mol-1。
(2)在定温定容条件下,下列事实说明反应①达到平衡状态的是________ (填字母)。
A.容器的压强不再改变 B.混合气体的密度不再改变
C.H2S的百分含量不再改变 D.生成1 mol H—O键,同时生成1 mol H—S键
(3)一定温度和压强下,在1 L的密闭容器中,充入1 mol CO2和3 mol H2,发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g);测得CO2(g)和CH3OH(g)的浓度随时间变化如下图所示。
CH3OH(g)+H2O(g);测得CO2(g)和CH3OH(g)的浓度随时间变化如下图所示。
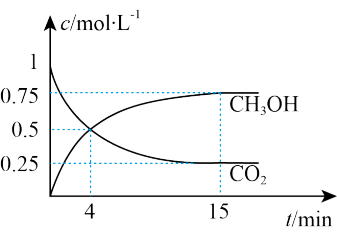
①反应进行到4 min 时,v(正)______ v(逆) (填“>”“<"或“=”)。0~4 min,H2的平均反应速率v(H2)=___ mol· L-1·min-1。
②写出一种在该温度下提高CH3OH产率的方法_____________________ 。
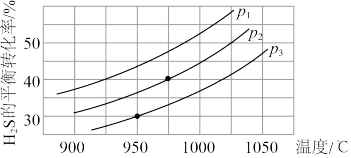
Ⅱ.在容积为2 L的恒容密闭容器中,充入0.5 mol H2S(g),发生反应:
2H2S(g) 2H2(g)+S2(g),在不同温度和压强下进行实验,结果如下图所示。
2H2(g)+S2(g),在不同温度和压强下进行实验,结果如下图所示。
(4)该反应ΔH_________ 0;ΔS________ 0。(填“>”或“<”)
(5)图中压强P1、P2、P3由大到小的顺序是__________________ 。
(6)在压强为P2,温度为975℃时,该反应的平衡常数K=___________ (保留2位有效数字)
Ⅰ.煤制得的化工原料中含有羰基硫(O=C=S),该物质可转化为H2S,主要反应如下:
①水解反应:COS(g)+H2O(g)
 H2S(g)+CO2(g) ΔH1=-94 kJ·mol-1
H2S(g)+CO2(g) ΔH1=-94 kJ·mol-1②氢解反应:COS(g)+H2(g)
 H2S(g)+CO(g) ΔH2=-54 kJ·mol-1
H2S(g)+CO(g) ΔH2=-54 kJ·mol-1(1)请计算CO(g)+H2O(g)
 H2(g)+CO2(g) ΔH3=
H2(g)+CO2(g) ΔH3=(2)在定温定容条件下,下列事实说明反应①达到平衡状态的是
A.容器的压强不再改变 B.混合气体的密度不再改变
C.H2S的百分含量不再改变 D.生成1 mol H—O键,同时生成1 mol H—S键
(3)一定温度和压强下,在1 L的密闭容器中,充入1 mol CO2和3 mol H2,发生反应:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g);测得CO2(g)和CH3OH(g)的浓度随时间变化如下图所示。
CH3OH(g)+H2O(g);测得CO2(g)和CH3OH(g)的浓度随时间变化如下图所示。
①反应进行到4 min 时,v(正)
②写出一种在该温度下提高CH3OH产率的方法
Ⅱ.在容积为2 L的恒容密闭容器中,充入0.5 mol H2S(g),发生反应:
2H2S(g)
 2H2(g)+S2(g),在不同温度和压强下进行实验,结果如下图所示。
2H2(g)+S2(g),在不同温度和压强下进行实验,结果如下图所示。(4)该反应ΔH
(5)图中压强P1、P2、P3由大到小的顺序是
(6)在压强为P2,温度为975℃时,该反应的平衡常数K=

您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐3】为回收利用废镍催化剂(主要成分为NiO,另含Fe2O3、CaO、CuO、BaO等),科研人员研制了一种回收镍的新工艺。工艺流程如图所示:

已知:①常温下,有关氢氧化物开始沉淀和沉淀完全的pH如下表所示:
②常温下,Ksp(CaF2)=2.7×10-11。请回答下列问题:
(1)加快酸浸速率的常用措施有______________ (任写一条即可得分)。
(2)“浸出渣”主要成分为CaSO4·2H2O和______ 两种物质。
(3)“操作B”的过程是,先在40~50℃加入H2O2,其作用是_______________ (用离子方程式表示);再调pH至3.7~7.7,操作B可除去溶液中的____ (填元素名称)元素。
(4)操作C可除去溶液中的Ca2+,若控制溶液中F-,浓度为3.0×10-3mol·L-1,则溶液中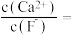
____ 。
(5)在碱性条件下,电解产生2NiOOH·H2O的原理分两步:
①Cl-在阳极被氧化为ClO-,则阳极的电极反应为____________ 。
②Ni2+被ClO-氧化产生2NiOOH·H2O沉淀,则该步反应的离子方程式为______________________ 。

已知:①常温下,有关氢氧化物开始沉淀和沉淀完全的pH如下表所示:
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Ni(OH)2 |
| 开始沉淀的pH | 1.5 | 6.5 | 7.7 |
| 沉淀完全的pH | 3.7 | 9.7 | 9.2 |
②常温下,Ksp(CaF2)=2.7×10-11。请回答下列问题:
(1)加快酸浸速率的常用措施有
(2)“浸出渣”主要成分为CaSO4·2H2O和
(3)“操作B”的过程是,先在40~50℃加入H2O2,其作用是
(4)操作C可除去溶液中的Ca2+,若控制溶液中F-,浓度为3.0×10-3mol·L-1,则溶液中
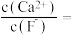
(5)在碱性条件下,电解产生2NiOOH·H2O的原理分两步:
①Cl-在阳极被氧化为ClO-,则阳极的电极反应为
②Ni2+被ClO-氧化产生2NiOOH·H2O沉淀,则该步反应的离子方程式为
您最近一年使用:0次
【推荐1】N2O是《联合国气候变化框架公约》所列六种温室气体之一。目前,直接催化分解法是消除N2O的主要方法,该过程中发生的反应如下:
i.2N2O(g) 2N2(g)+O2(g) △H1
2N2(g)+O2(g) △H1
ii.2N2O(g) N2(g)+2NO(g) △H2
N2(g)+2NO(g) △H2
iii.4N2O(g) 3N2(g)+2NO2(g) △H3
3N2(g)+2NO2(g) △H3
回答下列问题:
(1)根据盖斯定律,反应2NO(g)+O2(g) 2NO2(g)的△H=
2NO2(g)的△H=___ (写出代数式即可)。
(2)已知反应i在任意温度下均能自发进行,则反应i为___ (填“吸热”或“放热”)反应。
(3)反应i的势能曲线示意图如图(…表示吸附作用,A表示催化剂,TS表示过渡态分子):
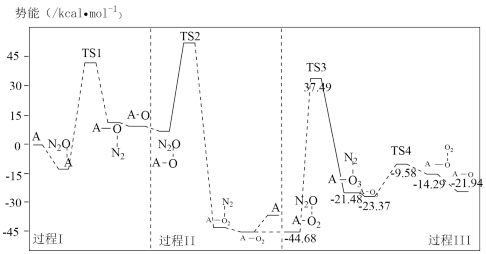
①过程Ⅲ中最大势能垒(活化能)为___ kcal·mol-1。
②下列有关反应i的说法不正确的是___ (填标号)。
A.过程Ⅰ中有极性键断裂
B.过程Ⅰ、Ⅱ、Ⅲ中都有N2生成
C.该反应中只有两种物质能够吸附N2O分子
D.过程Ⅱ中间体A—O2可释放O2也可吸附N2O分子
(4)模拟废气中N2O直接催化分解过程。
①515℃时,将模拟废气(N2O体积分数为40%)以6000m3·h-1的速度通过催化剂,测得N2O的转化率为40%,则平均反应速率v(N2O)为____ m3·h-1。欲提高N2O的转化率,可采取的措施为____ (任写一条)。
②T℃和P0kPa时,在恒压密闭容器中进行模拟实验。各组分的相关信息如表:
其中x=____ ,N2O的平衡转化率为____ (保留三位有效数字);该温度下,反应2N2O(g) 2N2(g)+O2(g)的压强平衡常数Kp=
2N2(g)+O2(g)的压强平衡常数Kp=___ kPa(以分压表示,分压=总压×物质的量分数)。
i.2N2O(g)
 2N2(g)+O2(g) △H1
2N2(g)+O2(g) △H1ii.2N2O(g)
 N2(g)+2NO(g) △H2
N2(g)+2NO(g) △H2iii.4N2O(g)
 3N2(g)+2NO2(g) △H3
3N2(g)+2NO2(g) △H3回答下列问题:
(1)根据盖斯定律,反应2NO(g)+O2(g)
 2NO2(g)的△H=
2NO2(g)的△H=(2)已知反应i在任意温度下均能自发进行,则反应i为
(3)反应i的势能曲线示意图如图(…表示吸附作用,A表示催化剂,TS表示过渡态分子):

①过程Ⅲ中最大势能垒(活化能)为
②下列有关反应i的说法不正确的是
A.过程Ⅰ中有极性键断裂
B.过程Ⅰ、Ⅱ、Ⅲ中都有N2生成
C.该反应中只有两种物质能够吸附N2O分子
D.过程Ⅱ中间体A—O2可释放O2也可吸附N2O分子
(4)模拟废气中N2O直接催化分解过程。
①515℃时,将模拟废气(N2O体积分数为40%)以6000m3·h-1的速度通过催化剂,测得N2O的转化率为40%,则平均反应速率v(N2O)为
| 物质 | N2 | N2O | O2 | CO2 | NO | NO2 |
| n(投料)/mol | 19 | 34 | 6.5 | 25 | 0 | 0 |
| n(平衡)/mol | 50 | x | 20 | 25 | 2 | 2 |
其中x=
 2N2(g)+O2(g)的压强平衡常数Kp=
2N2(g)+O2(g)的压强平衡常数Kp=
您最近一年使用:0次
【推荐2】碳排放问题是第26届联合国气候变化大会讨论的焦点。下面是 转化为高附加值化学品的反应。相关反应的热化学方程式如下:
转化为高附加值化学品的反应。相关反应的热化学方程式如下:
反应I:

反应II: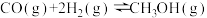

反应III: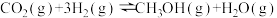
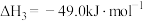
反应IV: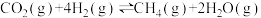

反应V:

请回答下列问题:
(1)反应III一般认为通过反应I、II来实现,则反应I的
___________  ;已知:由实验测得反应I的
;已知:由实验测得反应I的 ,
, (
( 、
、 为速率常数,其与温度、催化剂有关)。若平衡后升高温度,则
为速率常数,其与温度、催化剂有关)。若平衡后升高温度,则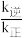
___________ (填“增大”“不变”或“减小”)。
(2) 在一定条件下催化加氢生成
在一定条件下催化加氢生成 ,主要发生三个竞争反应(即反应III、IV、V),为分析催化剂对反应的选择性,在1L恒容密闭容器中充入2.0 mol
,主要发生三个竞争反应(即反应III、IV、V),为分析催化剂对反应的选择性,在1L恒容密闭容器中充入2.0 mol  和5.3mol
和5.3mol ,若测得反应进行相同时间后,有关物质的物质的量随温度变化如下图所示:
,若测得反应进行相同时间后,有关物质的物质的量随温度变化如下图所示:

①催化剂在较低温度时主要选择反应___________ (填“III”“IV”或“V”)。研究发现,若温度过高,三种含碳产物的物质的量均会迅速降低,其主要原因可能是___________ 。
②在一定温度下达到平衡,此时测得容器中部分物质的含量为: ,
, ,
,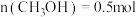 。则该温度下反应III的平衡常数
。则该温度下反应III的平衡常数
___________  (保留两位小数)。
(保留两位小数)。
(3)常温下,以NaOH溶液作 捕捉剂不仅可以降低碳排放,而且可得到重要的化工产品
捕捉剂不仅可以降低碳排放,而且可得到重要的化工产品 。用1L
。用1L 溶液将2.33 g
溶液将2.33 g  固体全都转化为
固体全都转化为 ,再过滤,则下列说法正确的是___________(填标号)。 [已知:常温下
,再过滤,则下列说法正确的是___________(填标号)。 [已知:常温下 ,
, ;忽略溶液体积的变化。]
;忽略溶液体积的变化。]
(4)研究人员研究出一种方法,可实现水泥生产时 零排放,其基本原理如下图所示。温度小于900℃时进行电解反应,碳酸钙先分解为CaO和
零排放,其基本原理如下图所示。温度小于900℃时进行电解反应,碳酸钙先分解为CaO和 ,电解质为熔融碳酸钠,阳极的电极反应为
,电解质为熔融碳酸钠,阳极的电极反应为 ,则阴极的电极反应为
,则阴极的电极反应为___________ 。

 转化为高附加值化学品的反应。相关反应的热化学方程式如下:
转化为高附加值化学品的反应。相关反应的热化学方程式如下:反应I:


反应II:
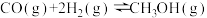

反应III:
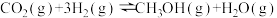
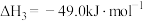
反应IV:
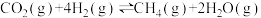

反应V:


请回答下列问题:
(1)反应III一般认为通过反应I、II来实现,则反应I的

 ;已知:由实验测得反应I的
;已知:由实验测得反应I的 ,
, (
( 、
、 为速率常数,其与温度、催化剂有关)。若平衡后升高温度,则
为速率常数,其与温度、催化剂有关)。若平衡后升高温度,则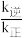
(2)
 在一定条件下催化加氢生成
在一定条件下催化加氢生成 ,主要发生三个竞争反应(即反应III、IV、V),为分析催化剂对反应的选择性,在1L恒容密闭容器中充入2.0 mol
,主要发生三个竞争反应(即反应III、IV、V),为分析催化剂对反应的选择性,在1L恒容密闭容器中充入2.0 mol  和5.3mol
和5.3mol ,若测得反应进行相同时间后,有关物质的物质的量随温度变化如下图所示:
,若测得反应进行相同时间后,有关物质的物质的量随温度变化如下图所示:
①催化剂在较低温度时主要选择反应
②在一定温度下达到平衡,此时测得容器中部分物质的含量为:
 ,
, ,
,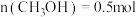 。则该温度下反应III的平衡常数
。则该温度下反应III的平衡常数
 (保留两位小数)。
(保留两位小数)。(3)常温下,以NaOH溶液作
 捕捉剂不仅可以降低碳排放,而且可得到重要的化工产品
捕捉剂不仅可以降低碳排放,而且可得到重要的化工产品 。用1L
。用1L 溶液将2.33 g
溶液将2.33 g  固体全都转化为
固体全都转化为 ,再过滤,则下列说法正确的是___________(填标号)。 [已知:常温下
,再过滤,则下列说法正确的是___________(填标号)。 [已知:常温下 ,
, ;忽略溶液体积的变化。]
;忽略溶液体积的变化。]A.所用的 溶液的物质的量浓度至少为 溶液的物质的量浓度至少为 |
B. 溶液中存在: 溶液中存在: |
C.反应 正向进行,需满足 正向进行,需满足 |
D.过滤后所得清液中一定存在: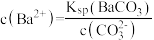 且 且 |
 零排放,其基本原理如下图所示。温度小于900℃时进行电解反应,碳酸钙先分解为CaO和
零排放,其基本原理如下图所示。温度小于900℃时进行电解反应,碳酸钙先分解为CaO和 ,电解质为熔融碳酸钠,阳极的电极反应为
,电解质为熔融碳酸钠,阳极的电极反应为 ,则阴极的电极反应为
,则阴极的电极反应为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐3】Cu2O是重要的催化剂和化工原料,工业上制备Cu2O的主要反应如下:
①C(s)+CO2(g)⇌2CO(g) ΔH=+172.5 kJ·mol-1
②CO(g)+2CuO(s) ⇌Cu2O(s)+CO2(g) ΔH=-138.0 kJ·mol-1
(1)C与CuO反应生成Cu2O和CO的热化学方程式为_______ 。
(2)一定温度下,向5L恒容密闭容器中加入1molCO和2 molCuO,发生反应②,5 min时达到平衡,测得容器中CuO的物质的量为0.8mol。
①0~5 min内,用CO2表示的反应速率v(CO2)=____ 。
②CO的平衡转化率α=_______ 。
(3)向5L密闭容器中加入1molC和1molCO2,发生反应①,CO2、CO的平衡体积分数(φ)与温度(T)的关系如图所示:
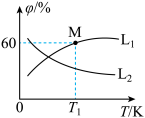
①能表示CO2的平衡体积分数与温度关系的曲线为____ (填“L1”或“L2”),理由为_______ 。
②温度为T1时,该反应的平衡常数K=_____ 。
①C(s)+CO2(g)⇌2CO(g) ΔH=+172.5 kJ·mol-1
②CO(g)+2CuO(s) ⇌Cu2O(s)+CO2(g) ΔH=-138.0 kJ·mol-1
(1)C与CuO反应生成Cu2O和CO的热化学方程式为
(2)一定温度下,向5L恒容密闭容器中加入1molCO和2 molCuO,发生反应②,5 min时达到平衡,测得容器中CuO的物质的量为0.8mol。
①0~5 min内,用CO2表示的反应速率v(CO2)=
②CO的平衡转化率α=
(3)向5L密闭容器中加入1molC和1molCO2,发生反应①,CO2、CO的平衡体积分数(φ)与温度(T)的关系如图所示:

①能表示CO2的平衡体积分数与温度关系的曲线为
②温度为T1时,该反应的平衡常数K=
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐1】恒温条件下,在2L的恒容密闭容器中,充入
 和
和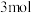
 ,在一定条件下发生反应的化学方程式为
,在一定条件下发生反应的化学方程式为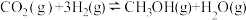 。根据所学知识,目答下列问题:
。根据所学知识,目答下列问题:
(1)3s末测得CO2的物质的量为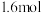 ,此时容器内
,此时容器内 的物质的量浓度为
的物质的量浓度为_______ 
_______ 。
(2)一段时间后,能说明该反应已达到平衡状态的是_______ (填标号)。
a.
b.容器内压强保持不变
c.
d.容器内混合气体的密度保持不变。
(3)若反应在ts后达到平衡,测得 转化了
转化了 ,则平衡时
,则平衡时 的体积分数为
的体积分数为_______ 。
(4) 是一种重要的化工产品。通过上述反应获得
是一种重要的化工产品。通过上述反应获得 是一种重要的途径,下列有关说法中正确的是
是一种重要的途径,下列有关说法中正确的是_______ (填标号)。
a.该反应为可逆反应,故在一定条件下 和
和 不可能全部转化为
不可能全部转化为
b.达到平衡后,反应就停止了,故此时正、逆反应速率相等且均为
c.在利用上述反应生产 时,要同时考虑反应所能达到的限度及化学反应速率两方面的问题
时,要同时考虑反应所能达到的限度及化学反应速率两方面的问题

 和
和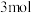
 ,在一定条件下发生反应的化学方程式为
,在一定条件下发生反应的化学方程式为 。根据所学知识,目答下列问题:
。根据所学知识,目答下列问题:(1)3s末测得CO2的物质的量为
 ,此时容器内
,此时容器内 的物质的量浓度为
的物质的量浓度为
(2)一段时间后,能说明该反应已达到平衡状态的是
a.

b.容器内压强保持不变
c.

d.容器内混合气体的密度保持不变。
(3)若反应在ts后达到平衡,测得
 转化了
转化了 ,则平衡时
,则平衡时 的体积分数为
的体积分数为(4)
 是一种重要的化工产品。通过上述反应获得
是一种重要的化工产品。通过上述反应获得 是一种重要的途径,下列有关说法中正确的是
是一种重要的途径,下列有关说法中正确的是a.该反应为可逆反应,故在一定条件下
 和
和 不可能全部转化为
不可能全部转化为
b.达到平衡后,反应就停止了,故此时正、逆反应速率相等且均为

c.在利用上述反应生产
 时,要同时考虑反应所能达到的限度及化学反应速率两方面的问题
时,要同时考虑反应所能达到的限度及化学反应速率两方面的问题
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐2】甲醇是一种优质燃料,在工业上常用CO和H2合成甲醇,反应方程式为CO(g)+2H2(g)  CH3OH(g)。
CH3OH(g)。
已知:
①CO(g)+1/2O2(g)=CO2(g) △H1=-283.0kJ/mol
②H2(g)+1/2O2(g)=H2O(g) △H2=-241.8kJ/mol
③CH3OH(g)+3/2O2(g)=CO2(g)+2H2O(g) △H3=-192.2kJ/mol
回答下列问题:
(1)计算CO(g)+2H2(g) CH3OH(g)的反应热△H4=
CH3OH(g)的反应热△H4=________________ 。
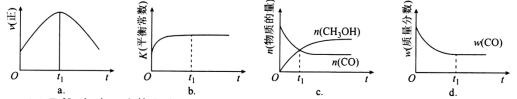
(2)若在绝热、恒容的密闭容器中充入1 mol CO、2 mol H2,发生CO(g)+2H2(g) CH3OH(g)反应,下列示意图正确且能说明反应在进行到t1时刻为平衡状态的是
CH3OH(g)反应,下列示意图正确且能说明反应在进行到t1时刻为平衡状态的是________ (填选项字母)。
(3)T1℃时,在一个体积为5 L的恒容容器中充入1 mol CO、2 mol H2,经过5 min达到平衡,CO的转化率为0.8,则5 min内用H2表示的反应速率为v(H2)=_______________________ 。T1℃时,在另一体积不变的密闭容器中也充入1 mol CO、2 mol H2,达到平衡时CO的转化率为0.7,则该容器的体积______ 5 L(填“>”“<”或“=”);T1℃时,CO(g)+2H2(g)  CH3OH(g)的平衡常数K=
CH3OH(g)的平衡常数K=____________________________ 。
(4)为了提高燃料的利用率可以将甲醇设计为燃料电池,写出KOH作电解质溶液时,甲醇燃料电池的负极反应式:_________________________ 。该电池负极与水库的铁闸相连时,可以保护铁闸不被腐蚀,这种电化学保护方法叫做___________ 。
(5)含有甲醇的废水随意排放会造成水污染,可用ClO2将其氧化为CO2,然后再加碱中和即可。写出处理甲醇酸性废水过程中,ClO2与甲醇反应的离子方程式:_________ 。
 CH3OH(g)。
CH3OH(g)。已知:
①CO(g)+1/2O2(g)=CO2(g) △H1=-283.0kJ/mol
②H2(g)+1/2O2(g)=H2O(g) △H2=-241.8kJ/mol
③CH3OH(g)+3/2O2(g)=CO2(g)+2H2O(g) △H3=-192.2kJ/mol
回答下列问题:
(1)计算CO(g)+2H2(g)
 CH3OH(g)的反应热△H4=
CH3OH(g)的反应热△H4=(2)若在绝热、恒容的密闭容器中充入1 mol CO、2 mol H2,发生CO(g)+2H2(g)
 CH3OH(g)反应,下列示意图正确且能说明反应在进行到t1时刻为平衡状态的是
CH3OH(g)反应,下列示意图正确且能说明反应在进行到t1时刻为平衡状态的是
(3)T1℃时,在一个体积为5 L的恒容容器中充入1 mol CO、2 mol H2,经过5 min达到平衡,CO的转化率为0.8,则5 min内用H2表示的反应速率为v(H2)=
 CH3OH(g)的平衡常数K=
CH3OH(g)的平衡常数K=(4)为了提高燃料的利用率可以将甲醇设计为燃料电池,写出KOH作电解质溶液时,甲醇燃料电池的负极反应式:
(5)含有甲醇的废水随意排放会造成水污染,可用ClO2将其氧化为CO2,然后再加碱中和即可。写出处理甲醇酸性废水过程中,ClO2与甲醇反应的离子方程式:
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐3】以NOx为主要成分的雾霾的综合治理是当前重要的研究课题。
(1)已知:2C(s)+O2(g)=2CO(g) ∆H=-akJ/mol
N2(g)+O2(g)=2NO(g) ∆H=-bkJ/mol
2NO(g)+2CO(g)=2CO2(g)+N2(g) ∆H=-ckJ/mol
则2NO(g)+C(s)=CO2(g)+N2(g) ∆H=____ kJ/mol。
(2)NO和CO均为汽车尾气的成分,在催化转换器中二者可发生反应减少尾气污染。
已知2NO(g)+2CO(g) N2(g)+2CO2(g) ∆H<0。
N2(g)+2CO2(g) ∆H<0。
①该反应能自发进行的条件是____ 。
②在500℃时,向恒容密闭体系中通入1mol的NO和1mol的CO进行反应时,下列描述能说明反应达到平衡状态的是____ 。
A.v(CO)正=2v(N2)逆
B.体系中混合气体密度不变
C.混合气体的平均相对分子质量不变
D.体系中NO、CO的浓度相等
E.单位时间内消耗nmol的NO同时消耗nmol的N2
③向1L密闭容器中通入1mol的NO和lmol的CO气体,在不同温度下反应达到平衡时,NO的平衡转化率随压强变化曲线如图所示:

T1____ T2(填“>”、“<”),反应经过5min达到平衡M,该反应的化学平衡常数表达式为K=____ ,平衡时混合气体中CO的体积分数为____ 。
(1)已知:2C(s)+O2(g)=2CO(g) ∆H=-akJ/mol
N2(g)+O2(g)=2NO(g) ∆H=-bkJ/mol
2NO(g)+2CO(g)=2CO2(g)+N2(g) ∆H=-ckJ/mol
则2NO(g)+C(s)=CO2(g)+N2(g) ∆H=
(2)NO和CO均为汽车尾气的成分,在催化转换器中二者可发生反应减少尾气污染。
已知2NO(g)+2CO(g)
 N2(g)+2CO2(g) ∆H<0。
N2(g)+2CO2(g) ∆H<0。①该反应能自发进行的条件是
②在500℃时,向恒容密闭体系中通入1mol的NO和1mol的CO进行反应时,下列描述能说明反应达到平衡状态的是
A.v(CO)正=2v(N2)逆
B.体系中混合气体密度不变
C.混合气体的平均相对分子质量不变
D.体系中NO、CO的浓度相等
E.单位时间内消耗nmol的NO同时消耗nmol的N2
③向1L密闭容器中通入1mol的NO和lmol的CO气体,在不同温度下反应达到平衡时,NO的平衡转化率随压强变化曲线如图所示:

T1
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐1】甲醇是重要的化工原料,研究甲醇的制备及用途在工业上有重要的意义。
(1)一种重要的工业制备甲醇的反应为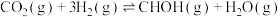 △H
△H
已知:①

②

试计算制备反应的△H=_______ 。
(2)在某恒温恒压容器中进行反应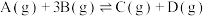 ,达到平衡时容器容积为1 L。A、B、C、D的物质的量依次为3 mol、1 mol、1 mol、1 mol;若往容器中再通入6 mol A,此时平衡
,达到平衡时容器容积为1 L。A、B、C、D的物质的量依次为3 mol、1 mol、1 mol、1 mol;若往容器中再通入6 mol A,此时平衡_______ (填“正向”“逆向”或“不”)移动,该反应的△H _______ (填“大于”或“小于”)0。
(3)对于反应 ,
,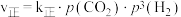 ,
, 。其中
。其中 、
、 分别为正、逆反应速率常数,p为气体分压(分压=物质的量分数×总压)。在540K下,按初始投料比
分别为正、逆反应速率常数,p为气体分压(分压=物质的量分数×总压)。在540K下,按初始投料比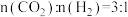 、
、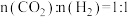 、
、 ,得到不同压强条件下
,得到不同压强条件下 的平衡转化率关系图:
的平衡转化率关系图:
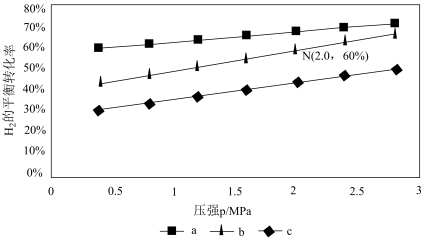
①比较a、b、c各曲线所表示的投料比大小顺序为_______ (用字母表示)。
②点N在线b上,计算540 K的压强平衡常数Kp=_______ (用平衡分压代替平衡浓度计算)。
③540K条件下,某容器测得某时刻 MPa,
MPa, MPa,
MPa,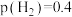 MPa,此时
MPa,此时
_______ 。
(4)甲醇催化可制取丙烯,反应为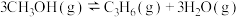 ,反应的Arrhenius经验公式的实验数据如图中曲线a所示,已知Arrhenius经验公式为
,反应的Arrhenius经验公式的实验数据如图中曲线a所示,已知Arrhenius经验公式为 (Ea为活化能,k为速率常数,R和C为常数)。
(Ea为活化能,k为速率常数,R和C为常数)。
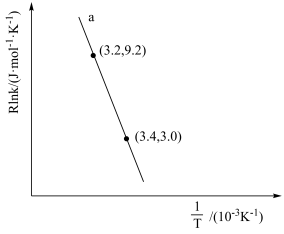
①该反应的活化能Ea=_______  。
。
②当使用更高效催化剂时,在图中画出 与
与 关系的示意图。
关系的示意图。_______
(1)一种重要的工业制备甲醇的反应为
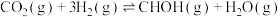 △H
△H已知:①


②


试计算制备反应的△H=
(2)在某恒温恒压容器中进行反应
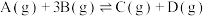 ,达到平衡时容器容积为1 L。A、B、C、D的物质的量依次为3 mol、1 mol、1 mol、1 mol;若往容器中再通入6 mol A,此时平衡
,达到平衡时容器容积为1 L。A、B、C、D的物质的量依次为3 mol、1 mol、1 mol、1 mol;若往容器中再通入6 mol A,此时平衡(3)对于反应
 ,
,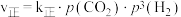 ,
, 。其中
。其中 、
、 分别为正、逆反应速率常数,p为气体分压(分压=物质的量分数×总压)。在540K下,按初始投料比
分别为正、逆反应速率常数,p为气体分压(分压=物质的量分数×总压)。在540K下,按初始投料比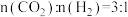 、
、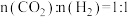 、
、 ,得到不同压强条件下
,得到不同压强条件下 的平衡转化率关系图:
的平衡转化率关系图:
①比较a、b、c各曲线所表示的投料比大小顺序为
②点N在线b上,计算540 K的压强平衡常数Kp=
③540K条件下,某容器测得某时刻
 MPa,
MPa, MPa,
MPa,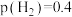 MPa,此时
MPa,此时
(4)甲醇催化可制取丙烯,反应为
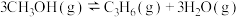 ,反应的Arrhenius经验公式的实验数据如图中曲线a所示,已知Arrhenius经验公式为
,反应的Arrhenius经验公式的实验数据如图中曲线a所示,已知Arrhenius经验公式为 (Ea为活化能,k为速率常数,R和C为常数)。
(Ea为活化能,k为速率常数,R和C为常数)。
①该反应的活化能Ea=
 。
。②当使用更高效催化剂时,在图中画出
 与
与 关系的示意图。
关系的示意图。
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐2】研究减少CO2排放是一项重要课题。CO2经催化加氢可以生成低碳有机物,主要有以下反应:
反应I:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g) △H=-49.6 kJ/mol
反应II:CH3OCH3(g)+H2O(g)⇌2CH3OH(g) △H2=+23.4 kJ/mol
反应III:2CO2(g)+6H2(g)⇌CH3OCH3(g)+3H2O(g) △H3
(1)△H3=_______ kJ/mol。
(2)反应II在某温度下的平衡常数为0.25,此温度下,在密闭容器中加入等物质的量的CH3OCH3(g)和H2O(g),反应到某时刻测得各组分浓度如表:
此时v正______ v逆(选填“>”“<”或“=”),当反应达到平衡状态时,混合气体中CH3OH体积分数(CH3OH)%=_____ %。
(3)在某压强下,反应III在不同温度、不同投料比时,CO2的平衡转化率如图所示。

①反应温度T1_______ T2(选填“>”“<”或“=”),说明原因:_______ ;
②T1温度下,将6 mol CO2和12 mol H2充入2 L的密闭容器中,5 min后反应达到平衡状态,则0~5min内的平均反应速率v(CH3OCH3)=_______ ;KA、KB、KC三者之间的大小关系为_______ 。
反应I:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g) △H=-49.6 kJ/mol
反应II:CH3OCH3(g)+H2O(g)⇌2CH3OH(g) △H2=+23.4 kJ/mol
反应III:2CO2(g)+6H2(g)⇌CH3OCH3(g)+3H2O(g) △H3
(1)△H3=
(2)反应II在某温度下的平衡常数为0.25,此温度下,在密闭容器中加入等物质的量的CH3OCH3(g)和H2O(g),反应到某时刻测得各组分浓度如表:
物质 | CH3OCH3(g) | H2O(g) | CH3OH(g) |
浓度/mol∙L-1 | 1.8 | 1.8 | 0.4 |
(3)在某压强下,反应III在不同温度、不同投料比时,CO2的平衡转化率如图所示。

①反应温度T1
②T1温度下,将6 mol CO2和12 mol H2充入2 L的密闭容器中,5 min后反应达到平衡状态,则0~5min内的平均反应速率v(CH3OCH3)=
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐3】研究含氮元素物质的反应对生产、生活、科研等方面具有重要的意义。
(1)NOx的排放主要来自于汽车尾气,包含NO2和NO,有人提出用活性炭对NOx进行吸收,发生如下反应:C(s)+2NO(g) N2(g)+CO2(g) △H=﹣34.0kJ/mol。对于反应T1℃时,借助传感器测得反应在不同时间点上各物质的浓度如下:
N2(g)+CO2(g) △H=﹣34.0kJ/mol。对于反应T1℃时,借助传感器测得反应在不同时间点上各物质的浓度如下:
①0~10min内,NO的平均反应速率v(NO)=___________ ,当升高反应温度,该反应的平衡常数K_________ (选填“增大”、“减小“或“不变”)。
②30min后。只改变某一条件,反应重新达到平衡;根据上表中的数据判断改变的条件可能是___________ (填字母)。
a.加入一定量的活性炭 b.通入一定量的NO
c.适当缩小容器的体积 d.加入合适的催化剂。
(2)科研人员发现碘蒸气存在能大幅度提高N2O的分解速率,反应历程为
第一步:I2(g)→2I(g)(快反应)
第二步:I(g)+N2O(g)→N2(g)+IO(g)(慢反应)
第三步:2IO(g)+2N2O(g)→2N2(g)+2O2(g)+I2(g)(快反应)
实验表明,含碘时N2O分解速率方程v=k•c(N2O)•[(I2)]0.5(k为速率常数),下列表述正确的是________ (填字母)。
A.I2(g)是反应的催化剂,I2(g)浓度增大,N2O分解反应速率增大
B.第二步是整个反应的决速步骤
C.I2(g)能降低反应的焓变,从而化学反应速率增大
(3)工业生产硝酸的核心反应之一是在恒压装置中将NO转化为NO2:
反应Ⅰ.NO(g)+ O2(g)
O2(g)  NO2(g) △H
NO2(g) △H
目前认为反应Ⅰ分两步进行:
反应Ⅱ.2NO(g) N2O2(g) △H<0(快速平衡)
N2O2(g) △H<0(快速平衡)
反应Ⅲ.N2O2(g)+O2(g) 2NO2(g)
2NO2(g)
反应Ⅲ的速率方程为v=k•p(N2O2)•p(O2)
①控制投料比n(NO):n(O2)=2:1,在不同条件下,反应Ⅰ中NO转化率随时间的变化如图所示:

由图知相同压强下反应Ⅰ的速率随温度升高而___________ (填写“增大”“减小”),可能的原因是 ___________ 。
②已知不同温度下反应Ⅰ的浓度平衡常数Kc如下表:
NO由NH3催化氧化得到,而催化后的产物气体往往高于800°C,为使反应I顺利进行,再进行反应。“急刷冷却”的原因有:低温下有利于反应速率增大; ________ 。
(4)为避免汽车尾气中的氮氧化合物对大气的污染。需给汽车安装尾气净化装置。在净化装置中CO和NO发生反应2NO(g)+2CO(g)=N2(g)+2CO2(g) △H=﹣746.8kJ•mol﹣1,实验测得:v正=k正•p2(NO)•p(CO),v逆=k逆•p(N2)•p((CO2),其中k正、k逆分别为正、逆反应速率常数,只与温度有关;p为气体分压(分压=物质的量分数×总压)。一定温度下在刚性密闲容器中充入CO、NO和N2物质的量之比为2 : 2 : 1,压强为p0kPa.达平衡时压强为0.9p0kPa,则 =
=___________ 。
(1)NOx的排放主要来自于汽车尾气,包含NO2和NO,有人提出用活性炭对NOx进行吸收,发生如下反应:C(s)+2NO(g)
 N2(g)+CO2(g) △H=﹣34.0kJ/mol。对于反应T1℃时,借助传感器测得反应在不同时间点上各物质的浓度如下:
N2(g)+CO2(g) △H=﹣34.0kJ/mol。对于反应T1℃时,借助传感器测得反应在不同时间点上各物质的浓度如下: | 0 | 10 | 20 | 30 | 40 | 50 |
| NO | 1.00 | 0.58 | 0.40 | 0.40 | 0.48 | 0.48 |
| N2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
②30min后。只改变某一条件,反应重新达到平衡;根据上表中的数据判断改变的条件可能是
a.加入一定量的活性炭 b.通入一定量的NO
c.适当缩小容器的体积 d.加入合适的催化剂。
(2)科研人员发现碘蒸气存在能大幅度提高N2O的分解速率,反应历程为
第一步:I2(g)→2I(g)(快反应)
第二步:I(g)+N2O(g)→N2(g)+IO(g)(慢反应)
第三步:2IO(g)+2N2O(g)→2N2(g)+2O2(g)+I2(g)(快反应)
实验表明,含碘时N2O分解速率方程v=k•c(N2O)•[(I2)]0.5(k为速率常数),下列表述正确的是
A.I2(g)是反应的催化剂,I2(g)浓度增大,N2O分解反应速率增大
B.第二步是整个反应的决速步骤
C.I2(g)能降低反应的焓变,从而化学反应速率增大
(3)工业生产硝酸的核心反应之一是在恒压装置中将NO转化为NO2:
反应Ⅰ.NO(g)+
 O2(g)
O2(g)  NO2(g) △H
NO2(g) △H目前认为反应Ⅰ分两步进行:
反应Ⅱ.2NO(g)
 N2O2(g) △H<0(快速平衡)
N2O2(g) △H<0(快速平衡)反应Ⅲ.N2O2(g)+O2(g)
 2NO2(g)
2NO2(g)反应Ⅲ的速率方程为v=k•p(N2O2)•p(O2)
①控制投料比n(NO):n(O2)=2:1,在不同条件下,反应Ⅰ中NO转化率随时间的变化如图所示:

由图知相同压强下反应Ⅰ的速率随温度升高而
②已知不同温度下反应Ⅰ的浓度平衡常数Kc如下表:
| 温度/℃ | 27 | 77 | 127 | 177 | 227 | 500 |
| 平衡常数Kc | 1.1×106 | 1.3×104 | 3.7×103 | 5.61×102 | 1.2×102 | 1.0 |
(4)为避免汽车尾气中的氮氧化合物对大气的污染。需给汽车安装尾气净化装置。在净化装置中CO和NO发生反应2NO(g)+2CO(g)=N2(g)+2CO2(g) △H=﹣746.8kJ•mol﹣1,实验测得:v正=k正•p2(NO)•p(CO),v逆=k逆•p(N2)•p((CO2),其中k正、k逆分别为正、逆反应速率常数,只与温度有关;p为气体分压(分压=物质的量分数×总压)。一定温度下在刚性密闲容器中充入CO、NO和N2物质的量之比为2 : 2 : 1,压强为p0kPa.达平衡时压强为0.9p0kPa,则
 =
=
您最近一年使用:0次



