1 . 研究碳、氮、硫等元素化合物的性质或转化对建设生态文明、美丽中国具有重要意义,请按要求回答下列问题。
I.H2S是石油化工行业广泛存在的污染性气体,但同时也是重要的氢源和硫源,工业上可以采取多种方式处理。
(1)已知:2H2S(g)+3O2(g)=2SO2(g)+2H2O(l);ΔH1=akJ·mol-1
S(s)+O2(g)=SO2(g);ΔH2=bkJ·mol-1
则空气氧化脱除H2S反应2H2S(g)+O2(g)=2S(s)+2H2O(l)的ΔH=___________ kJ·mol-1.
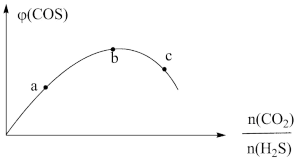
(2)H2S与CO2在高温下发生反应: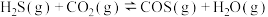 。在340℃时,将1molCO2与1molH2S充入2L的空钢瓶中。该反应平衡后
。在340℃时,将1molCO2与1molH2S充入2L的空钢瓶中。该反应平衡后 的物质的量分数为
的物质的量分数为 ,反应平衡常数K=
,反应平衡常数K=___________ 。
(3)若将H2S和CO2按不同比例投入一密闭容器中发生上述反应,反应达到平衡时,COS的体积分数随H2S和CO2的投料比的变化曲线如图所示,则b点时,平衡体系中S、C原子个数比接近___________ ;a、b、c三点CO2的转化率最大的是___________ 。
II.下图是一个电化学过程的示意图。请回答下列问题:

(4)写出通入CH3OH的电极的电极反应式:___________ 。
(5)乙池中反应的化学方程式___________ 。
(6)当乙池中B(Ag)极质量增加10.8g,甲池中理论上消耗标准状况O2的体积为___________,此时丙池中某电极析出某金属,则丙池中的某盐溶液可能是___________
I.H2S是石油化工行业广泛存在的污染性气体,但同时也是重要的氢源和硫源,工业上可以采取多种方式处理。
(1)已知:2H2S(g)+3O2(g)=2SO2(g)+2H2O(l);ΔH1=akJ·mol-1
S(s)+O2(g)=SO2(g);ΔH2=bkJ·mol-1
则空气氧化脱除H2S反应2H2S(g)+O2(g)=2S(s)+2H2O(l)的ΔH=
(2)H2S与CO2在高温下发生反应:
 。在340℃时,将1molCO2与1molH2S充入2L的空钢瓶中。该反应平衡后
。在340℃时,将1molCO2与1molH2S充入2L的空钢瓶中。该反应平衡后 的物质的量分数为
的物质的量分数为 ,反应平衡常数K=
,反应平衡常数K=(3)若将H2S和CO2按不同比例投入一密闭容器中发生上述反应,反应达到平衡时,COS的体积分数随H2S和CO2的投料比的变化曲线如图所示,则b点时,平衡体系中S、C原子个数比接近

II.下图是一个电化学过程的示意图。请回答下列问题:

(4)写出通入CH3OH的电极的电极反应式:
(5)乙池中反应的化学方程式
(6)当乙池中B(Ag)极质量增加10.8g,甲池中理论上消耗标准状况O2的体积为___________,此时丙池中某电极析出某金属,则丙池中的某盐溶液可能是___________
| A.MgSO4 | B.CuSO4 | C.NaCl | D.AgNO3 |
您最近一年使用:0次
2018高三下·全国·专题练习
名校
解题方法
2 . 氢气是一种重要的工业原料和清洁能源,可用作合成氨、合成甲醇、合成盐酸的原料,冶金用还原剂等。
(1)已知:CH4(g)+H2O(g)=CO(g)+3H2(g) ΔH=+206.2 kJ·mol−1。
CH4(g)+CO2(g)=2CO(g)+2H2(g) ΔH=+247.4 kJ·mol−1
则反应CH4(g)+2H2O(g)=CO2(g)+4H2(g) ΔH=_______ kJ·mol−1。
(2)工业合成氨的反应原理为N2(g)+3H2(g) 2NH3(g) ΔH=−92.4 kJ·mol−1。
2NH3(g) ΔH=−92.4 kJ·mol−1。
①该反应中的H2制取成本较高,工业生产中往往追求H2的转化率。增大H2的平衡转化率的措施有_______ (填字母代号)。
a.增大压强
b.升高温度
c.增大N2浓度
d.及时移走生成物NH3
e.使用高效催化剂
②升高温度,该可逆反应的平衡常数K__________ (填“增大”“不变”或“减小”)。
③某温度下,把10 mol N2与28 mol H2置于容积为10 L的恒容密闭容器内,10 min时反应达到平衡状态,测得平均速率v(NH3)=0.12 mol·L−1·min−1,H2的平衡转化率为_______ (保留三位有效数字),则该温度下反应的平衡常数K=_______ 。
(3)下图所示装置工作时均与H2有关。
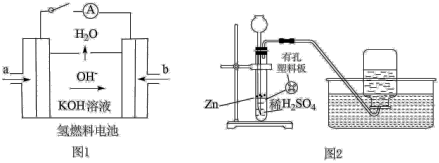
①图l所示装置,通入H2的管口是______ (填字母),正极反应式为___________________ 。
②图2是实验室制备H2的实验装置,在漏斗中加入1 mL CuSO4溶液,可观察到气泡生成速率明显加快,原因是_____________________ ,若反应装置中硫酸过量,则加入CuSO4溶液后,生成的氢气量__________ (填“增大”“不变”或“减小”)。
(1)已知:CH4(g)+H2O(g)=CO(g)+3H2(g) ΔH=+206.2 kJ·mol−1。
CH4(g)+CO2(g)=2CO(g)+2H2(g) ΔH=+247.4 kJ·mol−1
则反应CH4(g)+2H2O(g)=CO2(g)+4H2(g) ΔH=
(2)工业合成氨的反应原理为N2(g)+3H2(g)
 2NH3(g) ΔH=−92.4 kJ·mol−1。
2NH3(g) ΔH=−92.4 kJ·mol−1。①该反应中的H2制取成本较高,工业生产中往往追求H2的转化率。增大H2的平衡转化率的措施有
a.增大压强
b.升高温度
c.增大N2浓度
d.及时移走生成物NH3
e.使用高效催化剂
②升高温度,该可逆反应的平衡常数K
③某温度下,把10 mol N2与28 mol H2置于容积为10 L的恒容密闭容器内,10 min时反应达到平衡状态,测得平均速率v(NH3)=0.12 mol·L−1·min−1,H2的平衡转化率为
(3)下图所示装置工作时均与H2有关。

①图l所示装置,通入H2的管口是
②图2是实验室制备H2的实验装置,在漏斗中加入1 mL CuSO4溶液,可观察到气泡生成速率明显加快,原因是
您最近一年使用:0次
2018-04-20更新
|
105次组卷
|
3卷引用:甘肃省临泽县第一中学2018-2019学年高二下学期期末考试化学试题
甘肃省临泽县第一中学2018-2019学年高二下学期期末考试化学试题甘肃省张掖市临泽一中2018-2019学年高二下学期期末考试化学试题(已下线)2018年3月2018届高三第一次全国大联考(新课标Ⅲ卷)-化学试题



