1 . 下列实验方案能够达到实验目的的是
| 选项 | 实验目的 | 实验方案 |
| A | 探究生成物浓度改变FeCl3+3KSCN Fe(SCN)3+3KCl化学平衡的影响 Fe(SCN)3+3KCl化学平衡的影响 | 在平衡体系中加入KCl晶体,观察并比较实验现象 |
| B | 探究草酸浓度对反应速率的影响 | 向两支试管中分别加入2mL0.01mol/L的酸性KMnO4溶液,再同时分别向两支试管加入2mL0.1mol/L的H2C2O4溶液和2mL0.05mol/L的H2C2O4溶液,观察KMnO4溶液褪色所需时间 |
| C | 比较H2CO3和HClO酸性强弱 | 相同温度下,用pH试纸测定等浓度的NaHCO3和NaClO溶液的pH |
| D | 比较AgCl和AgI的Ksp大小 | 向盛有1mL0.1mol·L-1AgNO3溶液的试管中滴加2滴0.1mol·L-1NaCl溶液,有白色沉淀生成,向其中继续滴加几滴0.1mol/LKI溶液,有黄色沉淀产生 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
2 . I.某小组对Cu与浓HNO3的反应进行研究。记录如下:
(1)Cu与浓HNO3反应的化学方程式是___________ 。
II.探究实验1中溶液A呈绿色而不是蓝色的原因。
(2)甲认为溶液呈绿色是由Cu2+离子浓度较大引起的。乙根据实验记录,认为此观点不正确,乙的依据是___________ 。
(3)乙认为溶液呈绿色是由溶解的NO2引起的。
进行实验2:先将NO2通入B中,再鼓入N2,结果证实假设成立。
则以上两步操作对应的现象分别是___________ 、___________ 。
(4)为深入研究,丙查阅资料,有如下信息:
i.溶有NO2的浓HNO3呈黄色;水或稀HNO3中通少量NO2溶液呈无色。
ii.NO2溶于水,会发生反应2NO2+H2O= HNO3+HNO2;
HNO2是弱酸,只能稳定存在于冷、稀的溶液中,否则易分解。
iii. 能与Cu2+反应:Cu2+(蓝色)+4
能与Cu2+反应:Cu2+(蓝色)+4

 (绿色)
(绿色)
据此,丙进一步假设:
①可能是A中剩余的浓HNO3溶解了NO2得到的黄色溶液与Cu(NO3)2的蓝色溶液混合而形成的绿色;
②可能是A中生成了 使溶液呈绿色。
使溶液呈绿色。
丙进行如下实验:
①亚硝酸分解的化学方程式是___________ 。
②请用平衡原理解释加入H2SO4后绿色溶液变蓝的原因:___________ 。
(5)根据实验得出结论:实验1中溶液A呈绿色的主要原因是___________ 。请依据实验现象阐述理由:___________ 。
| 装置 | 药品 | 现象 | |
| 实验1 | 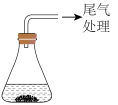 | 0.64gCu片(0.01mol) Cu片和20.0 mL浓HNO3 | Cu片消失,得到绿色溶液A,放置较长时间后得到蓝色溶 液B,…… |
(1)Cu与浓HNO3反应的化学方程式是
II.探究实验1中溶液A呈绿色而不是蓝色的原因。
(2)甲认为溶液呈绿色是由Cu2+离子浓度较大引起的。乙根据实验记录,认为此观点不正确,乙的依据是
(3)乙认为溶液呈绿色是由溶解的NO2引起的。
进行实验2:先将NO2通入B中,再鼓入N2,结果证实假设成立。
则以上两步操作对应的现象分别是
(4)为深入研究,丙查阅资料,有如下信息:
i.溶有NO2的浓HNO3呈黄色;水或稀HNO3中通少量NO2溶液呈无色。
ii.NO2溶于水,会发生反应2NO2+H2O= HNO3+HNO2;
HNO2是弱酸,只能稳定存在于冷、稀的溶液中,否则易分解。
iii.
 能与Cu2+反应:Cu2+(蓝色)+4
能与Cu2+反应:Cu2+(蓝色)+4

 (绿色)
(绿色)据此,丙进一步假设:
①可能是A中剩余的浓HNO3溶解了NO2得到的黄色溶液与Cu(NO3)2的蓝色溶液混合而形成的绿色;
②可能是A中生成了
 使溶液呈绿色。
使溶液呈绿色。丙进行如下实验:
| 操作 | 现象 | |
| 实验3 | i.配制与溶液A的c(H+)相同的HNO3溶液,取20.0mL,通入NO2气体 | 溶液呈黄色 |
| ii.再加0.01molCu(NO3)2固体搅拌至完全溶解 | 溶液变为绿色 | |
| iii.加水稀释 | 溶液立即变蓝 | |
| 实验4 | i.向20.0mL0.5mol/L Cu(NO3)2蓝色溶液中通入少量NO2 | 溶液呈绿色 |
| ii.加入稀H2SO4 | 有无色气体放出,遇空气变红棕色,溶液很快变为蓝色 |
②请用平衡原理解释加入H2SO4后绿色溶液变蓝的原因:
(5)根据实验得出结论:实验1中溶液A呈绿色的主要原因是
您最近一年使用:0次



