2023高三·全国·专题练习
1 . 二氧化碳催化加氢合成乙烯是综合利用CO2的热点研究领域。回答下列问题:
(1) CO2催化加氢生成乙烯和水的反应中,产物的物质的量之比n(C2H4):n(H2O)=_______ 。当反应达到平衡时,若增大压强,则n(C2H4)_______ (填“变大”“变小”或“不变”)。
(2)理论计算表明,原料初始组成n(CO2):n(H2O)=1:3,在体系压强为0.1MPa,反应达到平衡时,四种组分的物质的量分数x随温度T的变化如图所示。
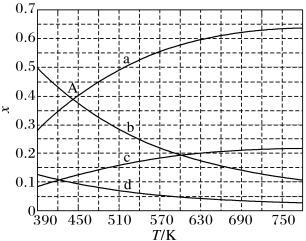
图中,表示C2H4、CO2变化的曲线分别是_______ 、_______ 。CO2催化加氢合成C2H4反应的△H_______ 0(填“大于”或“小于”)。
(3)根据图中点A(440,0.39),计算该温度时反应的平衡常数Kp=_______ (MPa)-3 (列出计算式。以分压表示,分压=总压×物质的量分数)。
(4)二氧化碳催化加氢合成乙烯反应往往伴随副反应,生成C3H4、C3H5、C4H3等低碳烃。一定温度和压强条件下,为了提高反应速率和乙烯选择性,应当_______ 。
(1) CO2催化加氢生成乙烯和水的反应中,产物的物质的量之比n(C2H4):n(H2O)=
(2)理论计算表明,原料初始组成n(CO2):n(H2O)=1:3,在体系压强为0.1MPa,反应达到平衡时,四种组分的物质的量分数x随温度T的变化如图所示。

图中,表示C2H4、CO2变化的曲线分别是
(3)根据图中点A(440,0.39),计算该温度时反应的平衡常数Kp=
(4)二氧化碳催化加氢合成乙烯反应往往伴随副反应,生成C3H4、C3H5、C4H3等低碳烃。一定温度和压强条件下,为了提高反应速率和乙烯选择性,应当
您最近一年使用:0次
名校
解题方法
2 . 丙烯腈(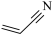 )是一种重要的化工原料,广泛应用在合成纤维、合成橡胶及合成树脂等工业生产中。以3-羟基丙酸乙酯(
)是一种重要的化工原料,广泛应用在合成纤维、合成橡胶及合成树脂等工业生产中。以3-羟基丙酸乙酯( )为原料合成丙烯腈,主要反应过程如下:
)为原料合成丙烯腈,主要反应过程如下:
反应I:



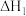 >0
>0
反应II: +NH3(g)
+NH3(g) 
 (g)+H2O(g)+
(g)+H2O(g)+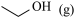
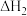 >0
>0
(1)已知部分化学键键能如下表所示:
据此计算ΔH1=___________ ;此反应自发进行的条件是___________ (填“高温易自发”“低温易自发”或“任何温度都能自发”)。
(2)在盛有催化剂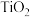 、压强为200kPa的恒压密闭容器中按体积比2∶15充入
、压强为200kPa的恒压密闭容器中按体积比2∶15充入 和
和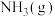 发生反应,通过实验测得平衡体系中含碳物质(乙醇除外)的物质的量分数随温度的变化如图所示。
发生反应,通过实验测得平衡体系中含碳物质(乙醇除外)的物质的量分数随温度的变化如图所示。
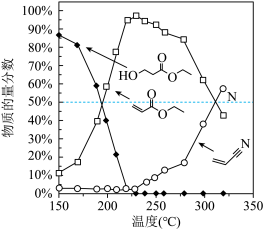
①随着温度的升高, (g)的平衡物质的量分数先增大后减小的原因为
(g)的平衡物质的量分数先增大后减小的原因为___________ 。
②N点对应反应II的平衡常数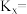
___________ (x代表物质的量分数)。
③科学家通过DFT计算得出反应II的反应历程有两步,其中第一步反应的化学方程式为: +NH3(g)
+NH3(g)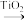
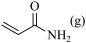 +
+ 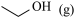 ,则第二步反应的化学方程式为
,则第二步反应的化学方程式为___________ ;实验过程中未检测到 的原因可能
的原因可能___________ 。
④实际生产中若充入一定量N2(不参与反应),可提高丙烯腈的平衡产率,原因为___________ 。
 )是一种重要的化工原料,广泛应用在合成纤维、合成橡胶及合成树脂等工业生产中。以3-羟基丙酸乙酯(
)是一种重要的化工原料,广泛应用在合成纤维、合成橡胶及合成树脂等工业生产中。以3-羟基丙酸乙酯( )为原料合成丙烯腈,主要反应过程如下:
)为原料合成丙烯腈,主要反应过程如下: 反应I:




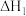 >0
>0反应II:
 +NH3(g)
+NH3(g) 
 (g)+H2O(g)+
(g)+H2O(g)+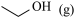
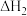 >0
>0(1)已知部分化学键键能如下表所示:
| 化学键 | C﹣O | C﹣C | C=C | C﹣H | O﹣H | C=O |
| 键能(kJ•mol ﹣1) | 351 | 348 | 615 | 413 | 463 | 745 |
据此计算ΔH1=
(2)在盛有催化剂
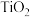 、压强为200kPa的恒压密闭容器中按体积比2∶15充入
、压强为200kPa的恒压密闭容器中按体积比2∶15充入 和
和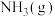 发生反应,通过实验测得平衡体系中含碳物质(乙醇除外)的物质的量分数随温度的变化如图所示。
发生反应,通过实验测得平衡体系中含碳物质(乙醇除外)的物质的量分数随温度的变化如图所示。
①随着温度的升高,
 (g)的平衡物质的量分数先增大后减小的原因为
(g)的平衡物质的量分数先增大后减小的原因为②N点对应反应II的平衡常数
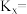
③科学家通过DFT计算得出反应II的反应历程有两步,其中第一步反应的化学方程式为:
 +NH3(g)
+NH3(g)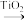
 +
+ 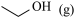 ,则第二步反应的化学方程式为
,则第二步反应的化学方程式为 的原因可能
的原因可能④实际生产中若充入一定量N2(不参与反应),可提高丙烯腈的平衡产率,原因为
您最近一年使用:0次
3 . (一)以四甲基氯化铵[(CH3)4NCl]水溶液为原料,通过电解法可以制备四甲基氢氧化铵[(CH3)4NOH],装置如图所示。
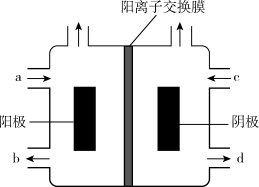
(1)收集到(CH3)4NOH的区域是_______ (填a、b、c或d)。
(2)写出电池总反应_______ 。
(二)乙酸乙酯一般通过乙酸和乙醇酯化合成:CH3COOH(l)+C2H5OH(l)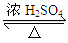 CH3COOC2H5(l)+H2O(l) ΔH=-2.7kJ·mol-1
CH3COOC2H5(l)+H2O(l) ΔH=-2.7kJ·mol-1
已知纯物质和相关恒沸混合物的常压沸点如下表:
请完成:
(1)关于该反应,下列说法不合理 的是_______ 。
A.反应体系中硫酸有催化作用
B.因为化学方程式前后物质的化学计量数之和相等,所以反应的ΔS等于零
C.因为反应的△H 接近于零,所以温度变化对平衡转化率的影响大
D.因为反应前后都是液态物质,所以压强变化对化学平衡的影响可忽略不计
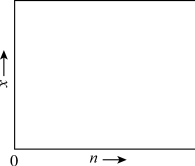
(2)一定温度下该反应的平衡常数K=4.0。若按化学方程式中乙酸和乙醇的化学计量数比例投料,则乙酸乙酯的平衡产率y =_______ ;若乙酸和乙醇的物质的量之比为n : 1,相应平衡体系中乙酸乙酯的物质的量分数为x,请在图中绘制x随n变化的示意图(计算时不计副反应)_______ 。
(3)工业上多采用乙酸过量的方法,将合成塔中乙酸、乙醇和硫酸混合液加热至110℃左右发生酯化反应并回流,直到塔顶温度达到70~71℃,开始从塔顶出料。控制乙酸过量的作用有_______ 。
(4)近年,科学家研究了乙醇催化合成乙酸乙酯的新方法:2C2H5OH(g) CH3COOC2H5(g)+2H2(g)
CH3COOC2H5(g)+2H2(g)
在常压下反应,冷凝收集,测得常温下液体收集物中主要产物的质量分数如图所示。关于该方法,下列推测合理的是_______ 。
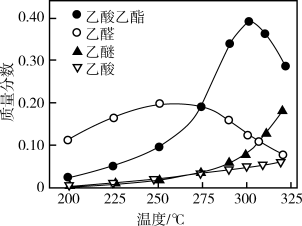
A.反应温度不宜超过300℃
B.增大体系压强,有利于提高乙醇平衡转化率
C.在催化剂作用下,乙醛是反应历程中的中间产物
D.提高催化剂的活性和选择性,减少乙醚、乙烯等副产物是工艺的关键

(1)收集到(CH3)4NOH的区域是
(2)写出电池总反应
(二)乙酸乙酯一般通过乙酸和乙醇酯化合成:CH3COOH(l)+C2H5OH(l)
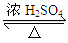 CH3COOC2H5(l)+H2O(l) ΔH=-2.7kJ·mol-1
CH3COOC2H5(l)+H2O(l) ΔH=-2.7kJ·mol-1已知纯物质和相关恒沸混合物的常压沸点如下表:
| 纯物质 | 沸点/℃ | 恒沸混合物(质量分数) | 沸点/℃ |
| 乙醇 | 78.3 | 乙酸乙酯(0.92)+水(0.08) | 70.4 |
| 乙酸 | 117.9 | 乙酸乙酯(0.69)+乙醇(0.31) | 71.8 |
| 乙酸乙酯 | 77.1 | 乙酸乙酯(0.83)+乙醇(0.08) +水(0.09) | 70.2 |
请完成:
(1)关于该反应,下列说法
A.反应体系中硫酸有催化作用
B.因为化学方程式前后物质的化学计量数之和相等,所以反应的ΔS等于零
C.因为反应的△H 接近于零,所以温度变化对平衡转化率的影响大
D.因为反应前后都是液态物质,所以压强变化对化学平衡的影响可忽略不计
(2)一定温度下该反应的平衡常数K=4.0。若按化学方程式中乙酸和乙醇的化学计量数比例投料,则乙酸乙酯的平衡产率y =

(3)工业上多采用乙酸过量的方法,将合成塔中乙酸、乙醇和硫酸混合液加热至110℃左右发生酯化反应并回流,直到塔顶温度达到70~71℃,开始从塔顶出料。控制乙酸过量的作用有
(4)近年,科学家研究了乙醇催化合成乙酸乙酯的新方法:2C2H5OH(g)
 CH3COOC2H5(g)+2H2(g)
CH3COOC2H5(g)+2H2(g)在常压下反应,冷凝收集,测得常温下液体收集物中主要产物的质量分数如图所示。关于该方法,下列推测合理的是

A.反应温度不宜超过300℃
B.增大体系压强,有利于提高乙醇平衡转化率
C.在催化剂作用下,乙醛是反应历程中的中间产物
D.提高催化剂的活性和选择性,减少乙醚、乙烯等副产物是工艺的关键
您最近一年使用:0次
2018-11-09更新
|
2277次组卷
|
4卷引用:三轮冲刺2020届高三化学考题必刷——有机物制备类探究实验题
三轮冲刺2020届高三化学考题必刷——有机物制备类探究实验题浙江省普通高校招生选考科目2018年4月考试化学试题山东省滕州市第一中学2020届高三3月线上模拟考试化学试题(已下线)专题20.化学反应原理综合应用-十年(2012-2021)高考化学真题分项汇编(浙江专用)



