1 . 某兴趣小组同学探究 酸性溶液与草酸
酸性溶液与草酸 溶液反应速率的影响因素。将
溶液反应速率的影响因素。将 的
的 酸性溶液与
酸性溶液与 草酸溶液按如下比例混合。
草酸溶液按如下比例混合。
【设计实验】
(1)补全 酸性溶液与草酸溶液反应的离子方程式:
酸性溶液与草酸溶液反应的离子方程式:_______ 。

(2)实验①和②的目的是_______ 。
【进行实验】
小组同学进行实验①和②,发现紫色并未直接褪去,而是分成两个阶段:
Ⅰ.紫色溶液变为青色溶液;Ⅱ.青色溶液逐渐褪至无色溶液。
【查阅资料】
a. 酸性溶液与草酸溶液的反应主要包含如下几个过程:
酸性溶液与草酸溶液的反应主要包含如下几个过程:
反应ⅰ.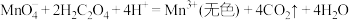
反应ⅱ.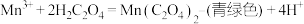
反应ⅲ。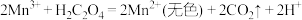
b. 的氧化性较弱,在本实验条件下不能氧化
的氧化性较弱,在本实验条件下不能氧化 。
。
c. 呈绿色,在酸性条件下不稳定,迅速分解为
呈绿色,在酸性条件下不稳定,迅速分解为 和
和 。
。
【继续探究】
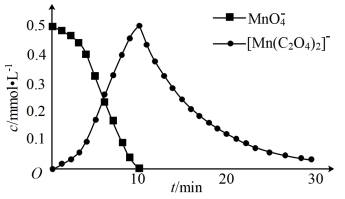
进一步实验证明溶液中含有 ,实验①反应过程中
,实验①反应过程中 和
和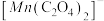 的浓度随时间的变化如下图。
的浓度随时间的变化如下图。
【解释与反思】
(3)本实验中,化学反应速率:反应ⅱ_______ 反应ⅲ(填“>”、“=”或“<”)。
(4)小组同学认为反应ⅱ的离子方程式应该改为: ,结合实验现象,说明其理由
,结合实验现象,说明其理由_______ 。
 酸性溶液与草酸
酸性溶液与草酸 溶液反应速率的影响因素。将
溶液反应速率的影响因素。将 的
的 酸性溶液与
酸性溶液与 草酸溶液按如下比例混合。
草酸溶液按如下比例混合。【设计实验】
| 序号 | V( 酸性溶液)/ 酸性溶液)/ | V(草酸溶液)/ | 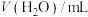 | 反应温度/ |
| ① | 2.0 | 2.0 | 0 | 20 |
| ② | 2.0 | 1.0 | 1.0 | 20 |
 酸性溶液与草酸溶液反应的离子方程式:
酸性溶液与草酸溶液反应的离子方程式:
(2)实验①和②的目的是
【进行实验】
小组同学进行实验①和②,发现紫色并未直接褪去,而是分成两个阶段:
Ⅰ.紫色溶液变为青色溶液;Ⅱ.青色溶液逐渐褪至无色溶液。
【查阅资料】
a.
 酸性溶液与草酸溶液的反应主要包含如下几个过程:
酸性溶液与草酸溶液的反应主要包含如下几个过程:反应ⅰ.
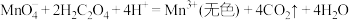
反应ⅱ.
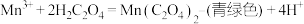
反应ⅲ。
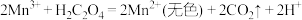
b.
 的氧化性较弱,在本实验条件下不能氧化
的氧化性较弱,在本实验条件下不能氧化 。
。c.
 呈绿色,在酸性条件下不稳定,迅速分解为
呈绿色,在酸性条件下不稳定,迅速分解为 和
和 。
。【继续探究】
进一步实验证明溶液中含有
 ,实验①反应过程中
,实验①反应过程中 和
和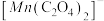 的浓度随时间的变化如下图。
的浓度随时间的变化如下图。
【解释与反思】
(3)本实验中,化学反应速率:反应ⅱ
(4)小组同学认为反应ⅱ的离子方程式应该改为:
 ,结合实验现象,说明其理由
,结合实验现象,说明其理由
您最近一年使用:0次
2 . 绿色能源是未来能源发展的方向,积极发展氢能,是实现“碳达峰、碳中和”的重要举措,可以用以下方法制备氢气。
I.甲烷和水蒸气催化制氢气。主要反应如下:
i.CH4(g)+H2O(g) CO(g)+3H2(g) △H=+206.2kJ•mol-1
CO(g)+3H2(g) △H=+206.2kJ•mol-1
ii.CO(g)+H2O(g) CO2(g)+H2(g) △H=-41.2kJ•mol-1
CO2(g)+H2(g) △H=-41.2kJ•mol-1
(1)反应CH4(g)+CO2(g) 2CO(g)+2H2(g)的△H=
2CO(g)+2H2(g)的△H=______ kJ•mol-1。
(2)在容积不变的绝热密闭容器中发生反应i,下列能说明反应达到平衡状态的是______ (填标号)。
A.气体混合物的密度不再变化
B.CH4消耗速率和H2的生成速率相等
C.CO的浓度保持不变
D.气体平均相对分子质量不再变化
E.体系的温度不再发生变化
(3)恒定压强为P0MPa时,将n(CH4):n(H2O)=1:3的混合气体投入反应器中发生反应i和ii,平衡时,各组分的物质的量分数与温度的关系如图所示。
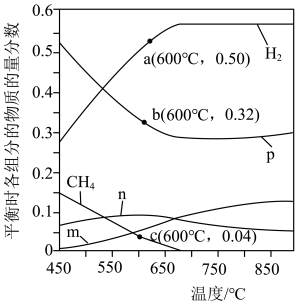
①图中表示CO2的物质的量分数与温度的变化曲线是______ (填字母)。
②结合图中数据,其他条件不变,若要H2的产量最大,最适宜的反应温度是______ (填标号)。
A.550~600℃ B.650~700℃ C.750~800℃
在其他条件不变的情况下,向体系中加入CaO可明显提高平衡体系中H2的含量,原因是______ 。
③600℃时,反应ii的平衡常数的计算式为Kp=______ (Kp是以分压表示的平衡常数,分压=总压×物质的量分数)。
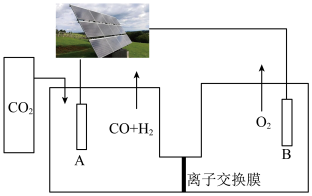
Ⅱ.电解法制氢气。某科研小组设计如图所示电解池,利用CO2和H2O在碱性电解液中制备水煤气(H2、CO),产物中H2和CO的物质的量之比为1∶1。
(4)电极B是______ 极,生成水煤气的电极反应式为______ 。
I.甲烷和水蒸气催化制氢气。主要反应如下:
i.CH4(g)+H2O(g)
 CO(g)+3H2(g) △H=+206.2kJ•mol-1
CO(g)+3H2(g) △H=+206.2kJ•mol-1ii.CO(g)+H2O(g)
 CO2(g)+H2(g) △H=-41.2kJ•mol-1
CO2(g)+H2(g) △H=-41.2kJ•mol-1(1)反应CH4(g)+CO2(g)
 2CO(g)+2H2(g)的△H=
2CO(g)+2H2(g)的△H=(2)在容积不变的绝热密闭容器中发生反应i,下列能说明反应达到平衡状态的是
A.气体混合物的密度不再变化
B.CH4消耗速率和H2的生成速率相等
C.CO的浓度保持不变
D.气体平均相对分子质量不再变化
E.体系的温度不再发生变化
(3)恒定压强为P0MPa时,将n(CH4):n(H2O)=1:3的混合气体投入反应器中发生反应i和ii,平衡时,各组分的物质的量分数与温度的关系如图所示。

①图中表示CO2的物质的量分数与温度的变化曲线是
②结合图中数据,其他条件不变,若要H2的产量最大,最适宜的反应温度是
A.550~600℃ B.650~700℃ C.750~800℃
在其他条件不变的情况下,向体系中加入CaO可明显提高平衡体系中H2的含量,原因是
③600℃时,反应ii的平衡常数的计算式为Kp=
Ⅱ.电解法制氢气。某科研小组设计如图所示电解池,利用CO2和H2O在碱性电解液中制备水煤气(H2、CO),产物中H2和CO的物质的量之比为1∶1。
(4)电极B是

您最近一年使用:0次
2023-10-27更新
|
946次组卷
|
3卷引用:广西南宁市2024届高三上学期毕业班摸底测试化学试题



