名校
解题方法
1 . 下列事实不能用电化学原理解释的是。
| A.镀锌铁比镀锡铁耐腐蚀 |
| B.生铁比熟铁(几乎是纯铁)容易生锈 |
| C.常温条件下,在空气中铝不容易被腐蚀 |
| D.用锌与硫酸制氢气时,往硫酸中滴少量硫酸铜,生成氢气的速率加快 |
您最近一年使用:0次
名校
解题方法
2 . 下列有关金属腐蚀与防护的说法不正确的是( )
| A.纯银器的表面在空气中因电化学腐蚀渐渐变暗 |
| B.当镀锌铁制品的镀层破损时,镀层仍能对铁制品起保护作用 |
| C.金属的电化学腐蚀比化学腐蚀更为普遍 |
| D.相对于在内河行驶的轮船来说,海轮更容易被腐蚀 |
您最近一年使用:0次
2019-12-07更新
|
155次组卷
|
5卷引用:福建省莆田九中2019-2020学年高二上学期期中考试化学试题
福建省莆田九中2019-2020学年高二上学期期中考试化学试题江苏省宿迁市沭阳县修远中学2019-2020学年高二下学期4月月考化学试题(已下线)1.3.1 金属的电化学腐蚀(重点练)——2020-2021学年高二化学上学期十分钟同步课堂专练(苏教版选修4)(已下线)1.3.2 金属的电化学防护(重点练)——2020-2021学年高二化学上学期十分钟同步课堂专练(苏教版选修4)(已下线)第12单元 电化学基础(B卷 滚动提升检测)-2021年高考化学一轮复习单元滚动双测卷
解题方法
3 . 已知铁生锈的过程为:Fe→Fe(OH)2→Fe(OH)3→Fe2O3•xH2O.又知草酸(H2C2O4)分解的化学方程式为 H2C2O4 CO↑+CO2↑+H2O,某化学小组为测定两种不同生锈铁片的组成(设只含有铁和Fe2O3•xH2O),进行了以下探究,请你参与并完成对有关问题的解答。
CO↑+CO2↑+H2O,某化学小组为测定两种不同生锈铁片的组成(设只含有铁和Fe2O3•xH2O),进行了以下探究,请你参与并完成对有关问题的解答。
(1)甲同学利用草酸分解产生的混合气体和如所示装置测定其中一种锈铁的组成。
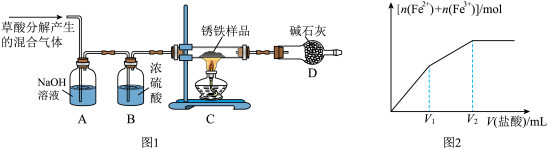
主要操作为:取锈铁样品12.6g置于装置C的硬质玻璃管中,加热完全反应后得到固体的质量为8.4g,装置D增重8.4g。
①钢铁在潮湿空气中发生电化学腐蚀时,其负极的电极反应式为______ 。
②装置A的作用是______ ,装置B的作用是 ______ 。
③根据以上数据能否测定出锈铁的组成?答:______ (填“能”或“不能”)。
④该装置还存在的一个明显的缺陷是______ 。
(2)乙同学在甲同学装置的基础上将装置D换成装浓硫酸的洗气瓶(装置E,此装置图略),经改进后,重新按甲同学的操作和样品取用量进行实验,若完全反应后得到固体的质量仍为8.4g,而装置E增重1.8g,则x=______ ;m(Fe):m (Fe2O3•xH2O)= ______ 。
(3)丙同学取少量的另外一种锈铁片放在烧杯中,然后逐滴加入稀盐酸,实验测知所得溶液中Fe2+、Fe3+的物质的量之和与加入稀盐酸的体积关系如图2示,此锈铁中n(Fe):n(Fe2O3•xH2O)的取值范围是______ 。(填字母)
a.大于1 b.等于1 c.小于1
 CO↑+CO2↑+H2O,某化学小组为测定两种不同生锈铁片的组成(设只含有铁和Fe2O3•xH2O),进行了以下探究,请你参与并完成对有关问题的解答。
CO↑+CO2↑+H2O,某化学小组为测定两种不同生锈铁片的组成(设只含有铁和Fe2O3•xH2O),进行了以下探究,请你参与并完成对有关问题的解答。 (1)甲同学利用草酸分解产生的混合气体和如所示装置测定其中一种锈铁的组成。

主要操作为:取锈铁样品12.6g置于装置C的硬质玻璃管中,加热完全反应后得到固体的质量为8.4g,装置D增重8.4g。
①钢铁在潮湿空气中发生电化学腐蚀时,其负极的电极反应式为
②装置A的作用是
③根据以上数据能否测定出锈铁的组成?答:
④该装置还存在的一个明显的缺陷是
(2)乙同学在甲同学装置的基础上将装置D换成装浓硫酸的洗气瓶(装置E,此装置图略),经改进后,重新按甲同学的操作和样品取用量进行实验,若完全反应后得到固体的质量仍为8.4g,而装置E增重1.8g,则x=
(3)丙同学取少量的另外一种锈铁片放在烧杯中,然后逐滴加入稀盐酸,实验测知所得溶液中Fe2+、Fe3+的物质的量之和与加入稀盐酸的体积关系如图2示,此锈铁中n(Fe):n(Fe2O3•xH2O)的取值范围是
a.大于1 b.等于1 c.小于1
您最近一年使用:0次
4 . 化学与生活息息相关。下列说法正确的是
| A.光导纤维是一种新型的有机高分子材料 |
| B.汽油、煤油、植物油的主要成分都是烃 |
| C.在糕点包装袋内放置活性铁粉作抗氧化剂 |
| D.轮船船身连接锌块叫做外接电源的阴极保护法 |
您最近一年使用:0次
5 . 如图所示装置,若开始时a、b两端液面相平,放置一段时间后,下列有关叙述中正确的是( )
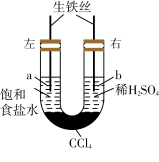

| A.铁丝在两处的腐蚀速率:a>b |
B.a、b两端相同的电极反应式为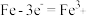 |
| C.一段时间后,a端液面高于b端液面 |
D.a处总反应为: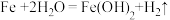 |
您最近一年使用:0次
2019-12-01更新
|
173次组卷
|
4卷引用:福建省永泰县第一中学2019-2020学年高二上学期期中考试化学试题
福建省永泰县第一中学2019-2020学年高二上学期期中考试化学试题山东省泰安市新泰第一中学(东校)2020-2021学年高二上学期期中考试化学试题(已下线)4.4 金属的腐蚀与防护-2021-2022学年高二化学课后培优练(人教版选修4)河南省洛阳市第一中学2022-2023学年高二上学期期末检测化学试题
6 . 钢铁很容易生锈而被腐蚀,每年因腐蚀而损失的钢铁占世界钢铁年产量的四分之一。钢铁容易生锈的主要原因是因为钢铁在炼制过程中混有少量的碳杂质,在潮湿的空气中容易形成原电池,发生电化学腐蚀。

I.如图装置中,U形管内为红墨水,a、b试管内分别盛有氯化铵(显酸性)溶液和食盐水,各加入生铁块,放置一段时间均被腐蚀,这两种腐蚀都属于_________ 。(填“化学腐蚀”或“电化学腐蚀”)
(1)红墨水柱两边的液面变为左低右高,则______ (填“a”或“b”)边盛有食盐水。
(2)b试管中铁发生的是______ 腐蚀,生铁中碳上发生的电极反应式______________________________ 。
Ⅱ.下图装置的盐桥中盛有饱和NH4NO3琼脂溶液,能够连接两份电解质溶液,形成闭合回路:

(1)该装置的能量转化形式为:______________ ,装置工作时,盐桥中的NH4+移向_________ 。(“CuSO4溶液”或“AgNO3溶液”)
(2)若将盐桥换成n型铜丝,电路中也有电流通过,则左边装置是_____ ,(填“原电池或电解池”),则n型铜丝左端为___ 极,该极反应式为:__ 。
(3)右边装置中Ag为_________ 极,左边装置中与Ag相连的铜片电极发生的反应式为:__________ 。
(4)将左边装置中与Ag相连的铜片电极换成石墨棒,一段时间后,若某一电极质量增重1.28 g,则另一电极生成________ mL(标况下)气体。

I.如图装置中,U形管内为红墨水,a、b试管内分别盛有氯化铵(显酸性)溶液和食盐水,各加入生铁块,放置一段时间均被腐蚀,这两种腐蚀都属于
(1)红墨水柱两边的液面变为左低右高,则
(2)b试管中铁发生的是
Ⅱ.下图装置的盐桥中盛有饱和NH4NO3琼脂溶液,能够连接两份电解质溶液,形成闭合回路:

(1)该装置的能量转化形式为:
(2)若将盐桥换成n型铜丝,电路中也有电流通过,则左边装置是
(3)右边装置中Ag为
(4)将左边装置中与Ag相连的铜片电极换成石墨棒,一段时间后,若某一电极质量增重1.28 g,则另一电极生成
您最近一年使用:0次
解题方法
7 . 钢铁很容易生锈而被腐蚀,每年因腐蚀而损失的钢铁占世界钢铁年产量的四分之一。请回答钢铁在腐蚀、防护过程中的有关问题。
(1)下列哪个装置可防止铁棒被腐蚀________________ 。
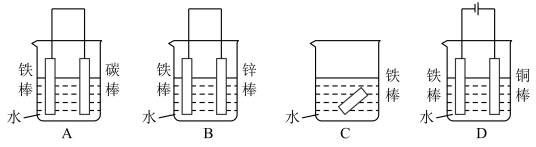
(2)在实际生产中,可在铁件的表面镀铜防止铁被腐蚀。装置示意图如图。请回答:

①铁件应与电源的________ 极相连(写正或负),B电极的电极反应式是______ 。
②若电镀前A、B两金属片质量相同,电镀完成后将它们取出洗净、烘干、称量,二者质量差为10.24 g,则电镀时电路中通过的电子为________ mol。
③电镀结束后CuSO4溶液的浓度______ (填变大,变小,不变)
④镀层破损后,铁不易被腐蚀的是___________ (填序号)。
A 镀铜铁 B 镀锌铁 C 镀锡铁
(1)下列哪个装置可防止铁棒被腐蚀
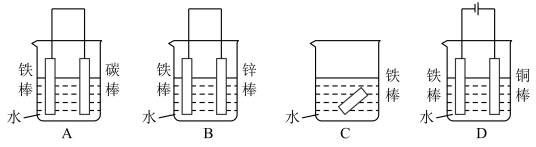
(2)在实际生产中,可在铁件的表面镀铜防止铁被腐蚀。装置示意图如图。请回答:

①铁件应与电源的
②若电镀前A、B两金属片质量相同,电镀完成后将它们取出洗净、烘干、称量,二者质量差为10.24 g,则电镀时电路中通过的电子为
③电镀结束后CuSO4溶液的浓度
④镀层破损后,铁不易被腐蚀的是
A 镀铜铁 B 镀锌铁 C 镀锡铁
您最近一年使用:0次
8 . 有关远洋轮船船壳腐蚀与防护叙述错误的是
| A.可在船壳外刷油漆进行保护 | B.可将船壳与电源的负极相连进行保护 |
| C.可在船底安装锌块进行保护 | D.在海上航行时,船壳主要发生析氢腐蚀 |
您最近一年使用:0次
名校
解题方法
9 . 下列叙述不正确的是
| A.在海轮外壳连接锌块保护外壳不受腐蚀是采用了牺牲阳极的保护法 |
| B.铅蓄电池在放电过程中,负极质量减小,正极质量增加 |
| C.外加电流的阴极保护法中,待保护金属作阴极 |
| D.电镀工业中,镀件作阴极 |
您最近一年使用:0次
2019-11-25更新
|
314次组卷
|
2卷引用:福建省福清西山学校高中部2020-2021学年高二上学期期中考试化学试题
名校
10 . Ⅰ.铁、铝及其化合物在生产和生活中有着广泛的应用。
(1)某研究性学习小组设计了如图所示装置探究钢铁的腐蚀与防护。
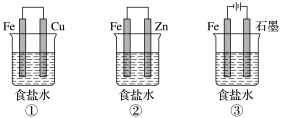
为防止金属Fe被腐蚀,可以采用上述________ (填装置序号)装置原理进行防护;装置③中总反应的离子方程式为_________________ 。
(2)为处理银器表面的黑斑(Ag2S),将银器浸于铝质容器里的食盐水中并与铝接触,Ag2S转化为Ag,食盐水的作用为_______________________ 。
Ⅱ.纳米级Cu2O由于具有优良的催化性能而受到关注,采用肼(N2H4)燃料电池为电源,用离子交换膜控制电解液中c(OH-)制备纳米Cu2O,其装置如图甲、乙。
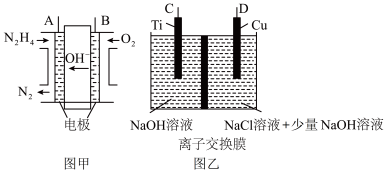
(1)上述装置中D电极应连接肼燃料电池的________ 极(填“A”或“B”),该电解池中离子交换膜为________ 离子交换膜(填“阴”或“阳”)。
(2)该电解池的阳极反应式为____________________ 。
(3)当反应生成14.4 g Cu2O时,至少需要肼________ mol。
(1)某研究性学习小组设计了如图所示装置探究钢铁的腐蚀与防护。

为防止金属Fe被腐蚀,可以采用上述
(2)为处理银器表面的黑斑(Ag2S),将银器浸于铝质容器里的食盐水中并与铝接触,Ag2S转化为Ag,食盐水的作用为
Ⅱ.纳米级Cu2O由于具有优良的催化性能而受到关注,采用肼(N2H4)燃料电池为电源,用离子交换膜控制电解液中c(OH-)制备纳米Cu2O,其装置如图甲、乙。

(1)上述装置中D电极应连接肼燃料电池的
(2)该电解池的阳极反应式为
(3)当反应生成14.4 g Cu2O时,至少需要肼
您最近一年使用:0次



