名校
解题方法
1 . 如图装置中,小试管内为红墨水,具支试管内盛有pH=4的雨水和生铁片,观察到:开始导管内液面下降,一段时间后导管内液面回升,略高于小试管液面,以下有关解释合理的是


| A.生铁片中的碳是原电池的负极,发生还原反应 |
| B.雨水酸性较强,生铁片仅发生析氢腐蚀 |
| C.墨水回升时,碳极反应式为O2+2H2O+4e—=4OH— |
| D.具支试管中溶液pH逐渐减小 |
您最近一年使用:0次
2022-10-01更新
|
220次组卷
|
4卷引用:黑龙江省哈尔滨市第一二二中学2021-2022学年高一下学期期末考试化学试题
2 . 实验小组研究金属电化学腐蚀,实验如下:
实验Ⅰ

5min时的现象:铁钉表面及周边未见明显变化。
25min时的现象:铁钉周边零星、随机出现极少量红色和蓝色区域,有少量红棕色铁锈生成。
实验Ⅱ
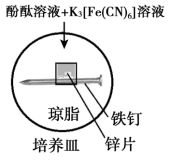
5min时的现象:铁钉周边出现红色区域,未见蓝色出现,锌片周边未见明显变化。
25min时的现象:铁钉周边红色加深,区域变大,未见蓝色出现,锌片周边未见明显变化。
下列说法不正确的是
实验Ⅰ

5min时的现象:铁钉表面及周边未见明显变化。
25min时的现象:铁钉周边零星、随机出现极少量红色和蓝色区域,有少量红棕色铁锈生成。
实验Ⅱ

5min时的现象:铁钉周边出现红色区域,未见蓝色出现,锌片周边未见明显变化。
25min时的现象:铁钉周边红色加深,区域变大,未见蓝色出现,锌片周边未见明显变化。
下列说法不正确的是
| A.实验Ⅱ中Zn保护了Fe,使铁的腐蚀速率比实验Ⅰ慢 |
B.实验Ⅱ中正极的电极反应式: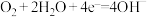 |
C.实验Ⅰ的现象说明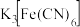 溶液与Fe反应生成了 溶液与Fe反应生成了 |
| D.若将Zn片换成Cu片,推测Cu片周边会出现红色,铁钉周边会出现蓝色 |
您最近一年使用:0次
2022-09-04更新
|
1372次组卷
|
13卷引用:北京市第十二中学2021-2022学年高一下学期6月月考化学试题
北京市第十二中学2021-2022学年高一下学期6月月考化学试题北京十二中2021-2022学年高一下学期六月月考(等级考)化学试题(已下线)【教材实验热点】17 金属的腐蚀与防护第四章 综合拔高练北京市海淀实验中学2022-2023学年高三上学期10月学科展示化学试题北京市北京师范大学燕化附中2022-2023学年高二上学期10月月考化学试题福建省莆田第二十四中学2021-2022学年高二下学期开学摸底考试化学(2卷)试题山东省枣庄市第一中学2022-2023学年高二上学期期末达标化学试题北京市朝阳区2021届高三上学期期末考试化学试题(已下线)2021年高考化学押题预测卷(辽宁卷)(03)(已下线)北京市第四中学2021-2022学年高二上学期期中考试化学试题福建省龙岩市连城县第一中学2023-2024学年高二上学期8月月考化学试题山东省滨州市2023-2024学年高三上学期11月期中考试化学试题
名校
解题方法
3 . 家用炒菜铁锅用水清洗放置后,出现红棕色的锈斑,在此过程中不发生反应
| A.4Fe(OH)2+2H2O+O2=4Fe(OH)3 | B.2Fe+2H2O+O2=2Fe(OH)2 |
| C.2H2O+O2+4e-=4OH- | D.Fe-3e-=Fe3+ |
您最近一年使用:0次
2022-08-22更新
|
98次组卷
|
37卷引用:福建省莆田市第一中学2021-2022学年高一下学期期末考试化学试题
福建省莆田市第一中学2021-2022学年高一下学期期末考试化学试题(已下线)2011-2012学年黑龙江省鹤岗一中高一下学期期末考试化学试卷(已下线)2012-2013学年江苏省江都区丁沟中学高一下学期期中考试化学试卷福建省平潭翰英中学2022-2023学年高二上学期第一次月考化学试题(已下线)江苏省2011届高三化学一轮过关测试(5)(已下线)2010—2011学年山西省大同一中高二上学期期末考试化学试卷(已下线)2013-2014学年福建省福州市八县高二上学期期末考试化学试卷(已下线)2013-2014河南省濮阳市高二下学期升级考试化学试卷2014-2015吉林省延边二中高二12月阶段考试化学试卷2014-2015山西省太原市五中高二12月月考化学试卷2014-2015陕西省西安市一中高二上学期期末化学试卷2014-2015学年山西省太原五中高二12月月考化学试卷2014-2015福建省泉州一中高三上学期期末考化学试卷2014-2015学年广东省深圳市明珠学校高二上学期期中化学试卷2015-2016学年福建省宁德市霞浦七中高二上期中(理)化学试卷2015-2016学年河南省许昌市四校高二上学期第三次联考化学试卷2015-2016学年陕西省黄陵中学高二上学期期末考试化学试卷2015-2016学年山东省烟台市莱山一中高二化学上学期段考试卷2016-2017学年河北省唐山市开滦一中高二上10月月考化学试卷 2016-2017学年黑龙江哈尔滨三中高二上期中理化学试卷福建省三明市第一中学2017-2018学年高二上学期第一次月考化学试题福建省三明市三地三校2017-2018学年高二上学期期中联考化学试题广东省惠州市惠东县惠东高级中学2018-2019学年高二上学期10月月考化学试题【全国百强校】四川省棠湖中学2018-2019学年高二上学期期中考试理综-化学试题宁夏回族自治区青铜峡市高级中学2018-2019学年高二上学期期末考试化学试题山东省新泰二中2019-2020学年高二上学期第一次阶段性考试化学试题福建省泉州第十六中学2019-2020学年高二10月份月考化学试题2019年秋高三化学复习强化练习—— 化学能与电能(已下线)1.3.1 金属的电化学腐蚀(基础练)——2020-2021学年高二化学上学期十分钟同步课堂专练(苏教版选修4)(已下线)四川省成都外国语学校2018-2019学年高二下学期期中考试化学试题河北省邯郸市永年区第二中学2020-2021学年高二上学期第一次月考教学质量检测化学试题福建省三明第一中学2020-2021学年高二上学期第一次月考化学试题陕西省宝鸡市渭滨区2020-2021学年高二上学期期末考试化学试题宁夏吴忠市吴忠中学2021-2022学年高二上学期月考化学试题福建省平潭翰英中学2021-2022学年高二上学期第一次月考(选考)化学试题福建省宁德市第一中学2021-2022学年高二上学期9月月考化学试题陕西省渭南市蒲城县蒲城中学2023-2024学年高二上学期期中考试化学试题
2022·广东·高考真题
真题
名校
4 . 为检验牺牲阳极的阴极保护法对钢铁防腐的效果,将镀层有破损的镀锌铁片放入酸化的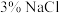 溶液中。一段时间后,取溶液分别实验,能说明铁片没有被腐蚀的是
溶液中。一段时间后,取溶液分别实验,能说明铁片没有被腐蚀的是
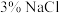 溶液中。一段时间后,取溶液分别实验,能说明铁片没有被腐蚀的是
溶液中。一段时间后,取溶液分别实验,能说明铁片没有被腐蚀的是A.加入 溶液产生沉淀 溶液产生沉淀 | B.加入淀粉碘化钾溶液无蓝色出现 |
C.加入 溶液无红色出现 溶液无红色出现 | D.加入 溶液无蓝色沉淀生成 溶液无蓝色沉淀生成 |
您最近一年使用:0次
2022-06-10更新
|
11395次组卷
|
38卷引用:第15讲 铁盐和亚铁盐(讲义)-【帮课堂】2022-2023学年高一化学同步精品讲义(人教2019必修第一册 )
(已下线)第15讲 铁盐和亚铁盐(讲义)-【帮课堂】2022-2023学年高一化学同步精品讲义(人教2019必修第一册 )2022年新高考广东化学高考真题(已下线)2022年广东卷高考真题变式题(11-16)(已下线)专题08 电化学及其应用-2022年高考真题模拟题分项汇编(已下线)专题11 化学实验基础-2022年高考真题模拟题分项汇编(已下线)专题08 电化学及其应用-三年(2020-2022)高考真题分项汇编(已下线)专题11 化学实验基础-三年(2020-2022)高考真题分项汇编(已下线)专题12 化学实验方案的设计与评价-三年(2020-2022)高考真题分项汇编(已下线)考点20 金属的腐蚀与防护-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)第02讲 离子反应 (讲)-2023年高考化学一轮复习讲练测(新教材新高考)(已下线)第09讲 铁及其重要化合物(练)-2023年高考化学一轮复习讲练测(全国通用)(已下线)专题11 金属的腐蚀与防护-备战2023年高考化学母题题源解密(广东卷)(已下线)第36练 金属的腐蚀与防护-2023年高考化学一轮复习小题多维练(全国通用)(已下线)第17讲 电解池 金属的腐蚀与防护 (讲)-2023年高考化学一轮复习讲练测(新教材新高考)(已下线)第28讲 物质的分离、提纯和检验(练)-2023年高考化学一轮复习讲练测(全国通用)(已下线)易错点06 铁及其化合物-备战2023年高考化学考试易错题(已下线)易错点19 电化学基础-备战2023年高考化学考试易错题吉林省延边第二中学2022-2023学年高三上学期第三次阶段测试化学试题(已下线)专题05 化学能与电能的转化(讲)-2023年高考化学二轮复习讲练测(新高考专用)辽宁省营口市2022-2023学年高三上学期期末考试化学试题突破超重点 牢固掌握实验重点 超重点4 物质检验与鉴别的方法(已下线)专题16 新型电化学装置分析-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)趋势6 模块杂糅命题(已下线)题型106 金属的腐蚀与防护广东省珠海市斗门区第一中学2022-2023学年高二上学期期末考试化学试题河南省驻马店市2022-2023学年高二下学期期末考试化学试题(已下线)第6讲 铁及其重要化合物(已下线)专题07 电化学及其应用-2023年高考化学真题题源解密(新高考专用)(已下线)考点20 金属的腐蚀与防护(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)专题05 化学实验基础-2023年高考化学真题题源解密(全国通用)(已下线)第4讲 电解池 金属的电化学腐蚀与防护第四章 化学反应与电能 第三节 金属的腐蚀与防护(已下线)广东省东莞市光正实验学校2023-2024学年高三上学期第二次月孝化学试题(已下线)考点3 电解池 金属的腐蚀与防护(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)江苏省苏州实验中学科技城校2023-2024学年高二上学期10月月考化学试题河南省南阳市2023-2024学年高二上学期期中考试化学试题 河北省石家庄精英中学2023-2024学年高二上学期2月月考化学试题天津市和平区2023-2024学年高二上学期期末考试化学试卷
名校
解题方法
5 . 下列关于金属腐蚀与防护的说法错误的是
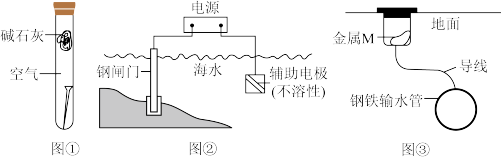

| A.图①,放置于干燥空气中的铁钉不易生锈 |
| B.图②,若将钢闸门与电源的正极相连,可防止钢闸门腐蚀 |
| C.图②,若断开电源,钢闸门将发生吸氧腐蚀 |
| D.图③,若金属M比Fe活泼,可防止输水管腐蚀 |
您最近一年使用:0次
2022-04-20更新
|
442次组卷
|
36卷引用:内蒙古通辽市开鲁县第一中学2021-2022学年高一下学期6月检测化学试题
内蒙古通辽市开鲁县第一中学2021-2022学年高一下学期6月检测化学试题(已下线)第4章 电化学基础(选拔卷)-【单元测试】2021-2022学年高二化学尖子生选拔卷(人教版选修4)福建省石狮市第一中学2022-2023学年高二上学期第一次月考化学试题福建省泉州科技中学2022-2023学年高二上学期第一次月考化学试题北京市第101中学2017-2018学年高二下学期期末考试化学试题【校级联考】福建省平和一中、南靖一中等五校2018-2019学年高二上学期第一次联考化学试题【全国百强校】福建省三明市第一中学2018-2019学年高二(理)上学期期中考试化学试题福建省漳平市第一中学2019-2020学年高二上学期第一次月考化学试题福建省莆田第一中学2019-2020学年高二上学期期中考试化学试题鲁科版(2019)选择性必修1第1章 化学反应与能量转化 第4节 金属的腐蚀与防护高中必刷题高二选择性必修1第四章 化学反应与电能 第三节 金属的腐蚀与防护河北省武安市第三中学2021届高三上学期期中考试化学试题福建省漳州市平和县第一中学2020-2021学年高二上学期期中考试化学试题山东省泰安肥城市2020-2021学年高二上学期期中考试化学试题福建省莆田第一中学2020-2021学年高二上学期期中考试化学试题新疆维吾尔自治区巴州二中2021届高三第六次月考化学试题选择性必修1(SJ)专题1第三单元 金属的腐蚀与防护(已下线)课时34 金属的腐蚀与防护-2022年高考化学一轮复习小题多维练(全国通用)(已下线)1.3.2 金属的电化学防护-2021-2022学年高二化学课后培优练(苏教版2019选择性必修1)(已下线)专题20 电解池 金属的电化学腐蚀与防护(热点讲义)-2022年高三毕业班化学常考点归纳与变式演练山东省济南市长清第一中学2021-2022学年高二上学期10月阶段性质量检测化学试题福建省泉州现代中学2021-2022学年高二上学期9月月考化学试题福建省南安市侨光中学2021-2022学年高二上学期第一次阶段考化学试题(已下线)第四章第四节 金属的电化学腐蚀与防护(备作业)-【上好课】2021-2022学年高二化学选修4同步备课系列(人教版)(已下线)备战2022年高考化学精准检测卷【全国卷】14(已下线)4.3.2 金属的防护(素养提优B练)-2021-2022学年高二化学课时过关提优AB练(人教版2019选择性必修1)(已下线)2020年江苏卷化学高考真题变式题11-15福建省泉州市第七中学 2020-2021学年高二上学期期中考试化学试题四川省成都市第七中学2022-2023学年高二下学期3月月考化学试题1.3金属的腐蚀和防护 课后四川省遂宁市2022-2023学年高二下学期期末监测化学试题福建省宁德市第一中学2021-2022学年高二上学期10月月考化学试题河北省唐山市开滦第二中学2023-2024学年高二上学期第一次月考化学试题福建省华安县第一中学2023-2024学年高二上学期10月月考化学试题(已下线)不定项选择题重庆市长寿区八校联考2023-2024学年高二上学期1月期末化学试题
21-22高一·全国·课时练习
6 . 电化学腐蚀
不纯的金属与电解质溶液接触,发生_______ 反应,_______ 金属失去电子而被氧化。
不纯的金属与电解质溶液接触,发生
您最近一年使用:0次
21-22高一·全国·课时练习
7 . 钢铁的电化学腐蚀原理
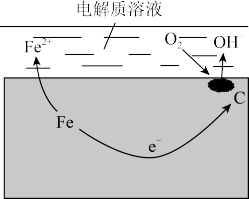
(1)电解质溶液:
在潮湿的空气里,钢铁表面吸附了一薄层水膜,水膜里含有少量_______ 、_______ 和_______ 等。
(2)电极:
钢铁里的铁和少量碳形成了无数微小的_______ ,其中,负极为_______ ,正极为_______ 。
(3)电极反应式:
①负极_______ ,②正极_______ 。
(4)铁锈的形成:
①2Fe+O2+2H2O=2Fe(OH)2
②_______
③2Fe(OH)3脱水:铁锈主要成分_______ 。

(1)电解质溶液:
在潮湿的空气里,钢铁表面吸附了一薄层水膜,水膜里含有少量
(2)电极:
钢铁里的铁和少量碳形成了无数微小的
(3)电极反应式:
①负极
(4)铁锈的形成:
①2Fe+O2+2H2O=2Fe(OH)2
②
③2Fe(OH)3脱水:铁锈主要成分
您最近一年使用:0次
8 . 2018年10月23日通车的最长跨海大桥“港珠澳大桥”全长近50公里,海中桥墩由将近1500根钢管复合桩组成。下列有关钢管桩的腐蚀与防护的说法不正确的是
| A.在钢管桩表面涂上环氧树脂涂料可以减缓钢管桩的腐蚀 |
| B.钢管桩在海水中的腐蚀速率比在淡水湖中的腐蚀速率慢 |
| C.将钢管桩与外加直流电源的负极相连接,可以减缓钢管桩的腐蚀速率 |
| D.在钢管桩水下区域装上若干镁铝合金,可以减缓钢管桩的腐蚀速率 |
您最近一年使用:0次
2021-12-01更新
|
439次组卷
|
5卷引用:上海市华东师范大学第二附属中学2021-2022学年高一下学期期末线上测试化学试题
(已下线)上海市华东师范大学第二附属中学2021-2022学年高一下学期期末线上测试化学试题吉林省长春市第二中学2021-2022学年高二上学期期末考试化学试题第三节 金属的腐蚀与防护北京市石景山区第九中学2021-2022学年高二上学期期中考试化学试题新疆博乐市第七中学2021-2022学年高二上学期期末考试化学试题
名校
9 . 用如图所示装置及试剂进行铁的电化学腐蚀实验探究,测定具支锥形瓶中压强随时间变化关系以及溶解氧随时间变化关系的曲线如下。下列说法不正确的是
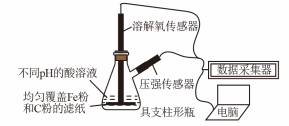
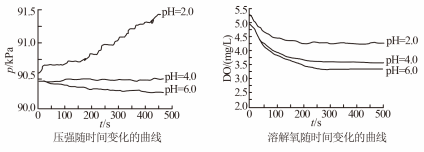


| A.压强增大主要是因为产生了H2 |
| B.整个过程中,负极电极反应式均为:Fe–2e- = Fe2+ |
| C.pH= 4.0时,体系为弱酸性,同时发生析氢腐蚀和吸氧腐蚀 |
| D.pH= 2.0时,体系为强酸性,正极只发生析氢腐蚀,电极方程式为:2H+ + 2e- = H2↑ |
您最近一年使用:0次
2021-11-26更新
|
1447次组卷
|
6卷引用:重庆南开中学2021-2022学年高一下学期4月第一次月考化学试题
重庆南开中学2021-2022学年高一下学期4月第一次月考化学试题湖北省武汉市华中师范大学第一附属中学2021-2022学年高一下学期期中考试化学试题福建省厦门市厦门双十中学2021-2022学年上学期期中考试化学试题(已下线)4.3 金属的腐蚀和防护-2021-2022学年高二化学课后培优练(人教版2019选择性必修1)(已下线)周末培优4 新型电池的电化学原理问题-2021-2022学年高二化学课后培优练(人教版选修4)(已下线)第四单元培优练-2021-2022学年高二化学课后培优练(人教版2019选择性必修1)
名校
解题方法
10 . 一般情况下,两种活泼性不同的金属在潮湿的环境中接触时,活泼性强的金属首先被腐蚀。为了避免轮船的钢质外壳被腐蚀,通常在轮船外壳上镶嵌的金属是
| A.锌板 | B.银板 | C.铜板 | D.铅板 |
您最近一年使用:0次
2021-09-09更新
|
176次组卷
|
4卷引用:陕西省延安市第一中学2021-2022学年高一下学期第二次月考化学试题
陕西省延安市第一中学2021-2022学年高一下学期第二次月考化学试题安徽省舒城中学2021-2022学年高一上学期第一次月考化学试题(已下线)第29讲 第四章《化学反应与电能》单元测试(基础巩固)-【帮课堂】2022-2023学年高二化学同步精品讲义(人教2019选择性必修1)宁夏中卫市中宁县2022-2023学年高二上学期质量测查(期末)化学试题



