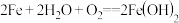2015-2016学年河南省许昌市四校高二上学期第三次联考化学试卷
河南
高二
阶段练习
2017-07-27
212次
整体难度:
适中
考查范围:
化学反应原理、认识化学科学、化学实验基础、物质结构与性质
一、单选题 添加题型下试题
| A.灯光变暗;二者电离常数相同 |
| B.灯光变暗;电离常数醋酸大于氨水 |
| C.灯光变亮;电离常数醋酸小于氨水 |
| D.灯光变亮;电离常数醋酸等于氨水 |
【知识点】 弱电解质的电离
A.NaHCO3的水溶液:NaHCO3 = Na++H++ |
B.熔融状态的NaHSO4:NaHSO4 = Na++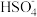 |
| C.HF的水溶液:HF=H++F- |
D.H2S 的水溶液:H2S 2H++S2- 2H++S2- |
【知识点】 弱电解质的电离方程式解读
| A.0.1mol·L﹣1的醋酸的pH=a,0.01mol·L﹣1的醋酸的pH=b,则a+1=b |
| B.常温下0.1mol·L﹣1的醋酸溶液与等浓度等体积NaOH溶液反应后的溶液中:c(CH3COOH)+c(CH3COO﹣)=0.1mol·L﹣1 |
| C.难溶电解质AB2的饱和溶液中,已知:c(A2+)=x mol·L﹣1,c(B﹣)=y mol·L﹣1,则Ksp值为4xy2 |
| D.用200mL4mol·L﹣1的NaOH溶液将0.6mol CO2完全吸收,反应的离子方程式为: 3CO2+4OH﹣=CO32﹣+2HCO3﹣+H2O |
【知识点】 溶液pH的计算 盐溶液中离子浓度大小的比较解读 溶度积
| A.为避免船体遭受腐蚀,在船舶的外壳装上若干锌块,称为牺牲阳极的阴极保护法 |
| B.原电池工作时,电流的方向由正极→负载→负极→原电池中电解质→正极 |
| C.白铁(镀锌铁)镀层破损后一段时间内,铁皮依然受到保护 |
| D.在铁制品上镀铜时,铁制品作电镀池的阳极,铜盐为电镀液 |
【知识点】 原电池 金属的电化学腐蚀与防护
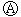 为直流电源,
为直流电源,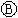 为浸透饱和氯化钠溶液和酚酞试液的滤纸,
为浸透饱和氯化钠溶液和酚酞试液的滤纸,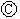 为电镀槽.接通电路后发现
为电镀槽.接通电路后发现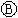 上的c点显红色.为实现铁上镀锌,接通
上的c点显红色.为实现铁上镀锌,接通 后,下列叙述正确的是
后,下列叙述正确的是 
| A.a为直流电源的负极 | B.d极发生的反应为2H++2e-=H2↑ |
| C.e极发生氧化反应 | D.f电极为锌板 |
【知识点】 电解池
| A.对水加热到100℃,测得PH=6 | B.在水中滴入稀硫酸 |
| C.在水中加入小苏打 | D.在水中加入氯化铝固体 |
【知识点】 水的电离及溶液的酸碱性
二、未知 添加题型下试题
三、单选题 添加题型下试题
| 操作和现象 | 结论 | |
| A | 处理锅炉水垢中的CaSO4时,依次加入饱和Na2CO3溶液和盐酸,水垢溶解 | Ksp:CaCO3<CaSO4 |
| B | 用石墨作电极电解MgSO4溶液,某电极附近有白色沉淀生成 | 该电极为阳极 |
| C | 向FeCl3和CuCl2混合溶液中加入少量铁粉,有红色固体析出 | 氧化性:Cu2+<Fe3+ |
| D | 向某溶液中先滴加硝酸酸化,再滴加BaCl2溶液,有白色沉淀生成 | 该溶液中一定含有Ag+ |
| A.A | B.B | C.C | D.D |
| A.Na2CO3溶液的碱性增强 |
| B.阳极反应:CO32--2e-+H2O = CO2↑+2OH- |
C.溶液中CO32-+H2O  HCO3-+OH-平衡不移动 HCO3-+OH-平衡不移动 |
| D.向溶液中加入一定量HCOOH的能复原 |
| 物质 | Fe(OH)2 | Cu(OH)2 | Fe(OH)3 |
| Ksp(25°C) | 8.0×10−16 | 2.2×10−20 | 4.0×10−38 |
| 完全沉淀时的pH范围 | ≥9.6 | ≥6.4 | 3~4 |
对含等物质的量的CuSO4、FeSO4、Fe2(SO4)3的混合溶液的说法,不科学的是( )
| A.向该混合溶液中逐滴加入NaOH溶液,最先看到红褐色沉淀 |
| B.该溶液中c(SO42−)∶[c(Cu2+)+c(Fe2+)+ c(Fe3+)]>5∶4 |
| C.向该溶液中加入适量氯水,并调节pH到3〜4后过滤,可获得纯净的CuSO4溶液 |
| D.在pH=5的溶液中Fe3+不能大量存在 |
| A.V一定等于0.2 |
| B.V大于或等于0.2,也有可能小于0.2 |
| C.混合溶液中离子浓度一定满足:c(Cl-)>c(NH4+)> c(H+)>c(OH-) |
| D.混合溶液中离子浓度可能满足:c(Cl-)> c(H+)> c(NH4+) >c(OH-) |
【知识点】 盐类的水解
| A.0.1 mol·L-1的NaOH溶液与0.1 mol·L-1的CH3COOH溶液等体积混合:c(Na+)>c(OH-)>c(CH3COO-)>c(H+) |
| B.常温下,0.01 mol·L-1的NaOH溶液与pH=2的CH3COOH溶液等体积混合:c(CH3COO-)>c(Na+)>c(H+)>c(OH-) |
| C.常温下,0.1 mol·L-1的CH3COOH溶液与0.1 mol·L-1的NaOH溶液混合后使pH=7,c(CH3COO-)=c(Na+)>c(H+)=c(OH-) |
| D.0.1 mol·L-1的CH3COOH溶液和0.1 mol·L-1的CH3COONa溶液等体积混合:c(CH3COO-)+c(OH-)=c(Na+)+c(H+) |
| A.泡沫灭火器中用的是硫酸铝和苏打溶液,并且苏打放在小塑料桶里。 |
B.图①表示25℃时,用0.1 mol·L-1盐酸滴定20 mL 0.1 mol·L-1 NaOH溶液,溶液的pH随加入酸体积的变化 |
| C.在常温下用惰性电极电解足量食盐水的实验中,若电解后溶液总体积为0.5L,阴极析出的气体的分子数为0.5NA,电解后溶液的pH为14 |
| D.常温时,浓度均为0.01mol/L Na2CO3溶液和NaHCO3溶液,等体积混合,其溶液中粒子浓度关系为2c(Na+)=3c(HCO3-)+3c(CO32-)+3c(H2CO3) |
【知识点】 水的电离及溶液的酸碱性 盐类的水解

| A.用18.4mol/L浓硫酸配制溶解所用4.00mol/L的稀硫酸,玻璃仪器一般只有4种 |
| B.利用Cu(OH)2替代CuO也可调试溶液pH,不影响实验结果 |
| C.洗涤晶体:向滤出晶体的漏斗中加少量冷水浸没晶体,自然流下,重复2-3次 |
| D.若要测定所得硫酸铜晶体中结晶水的数目,实验中要用到坩埚、坩埚钳和干燥器等 |
| A.作为二次电源,该电池在使用的过程中至少存在3种形式的能量转化 |
| B.Li﹣Al在电池中作为负极材料,负极的电极反应式为Li﹣e﹣=Li+ |
| C.该电池替代现在电动车广泛使用的铅蓄电池可以减少重金属的污染 |
| D.充电时,阳极发生的电极反应式为:Li2S+Fe﹣2e﹣=2Li++FeS |
【知识点】 化学电源

| A.4.32 g | B.2.16 g | C.1.08 g | D.0.54 g |
【知识点】 电解池
四、填空题 添加题型下试题
 HSO3﹣+OH﹣,请用Na2SO3溶液及必要的实验用品,设计简单实验,证明盐类的水解是一个吸热过程.必需的试剂有;操作和 现象是。
HSO3﹣+OH﹣,请用Na2SO3溶液及必要的实验用品,设计简单实验,证明盐类的水解是一个吸热过程.必需的试剂有;操作和 现象是。(2)已知等物质的量浓度的醋酸和醋酸钠溶液等体积混合呈酸性是因为醋酸的电离常数醋酸钠的水解常数(选填“大于”、“小于”或“等于”);可知该温度下醋酸钠(或醋酸根)的水解常数______1.0×10-7(选填“大于”、“小于”或“等于”)
【知识点】 沉淀溶解平衡
| 银盐 性质 | AgCl | AgI | AgCN | Ag2CrO4 | AgSCN |
| 沉淀颜色 | 白 | 黄 | 白 | 砖红 | 白 |
| 溶度积: | 1.8×10-10 | 8.3×10-17 | 1.2×10-10 | 1.2×10-12 | 1.0×10-12 |
A.NaCl B.KI C.NaCN D.Na2CrO4
刚好达到滴定终点时,发生的离子反应方程式为
【知识点】 沉淀溶解平衡
五、解答题 添加题型下试题

请帮助他们分析并回答下列问题:
(1)写出B装置中的电极反应:
阴极:
阳极:
(2)先后观察到A装置中的现象是:
①烧杯A中导管产生气泡数秒后溶液变红,
②烧瓶中液面
(3)当观察到A装置中的现象后,他们关闭止水夹a,打开止水夹b。再观察C装置(此溶液经过煮沸,且上层有油膜),若无现象,请说明理由;若有现象,请写出有关反应的化学方程式(是离子反应的写离子方程式):
【知识点】 电解池
六、填空题 添加题型下试题
C元素同周期;由A、B、C、D中的两种元素可形成原子个数比为1:1的多种化合物,甲、乙、丙、丁为其中的四种,它们的元素组成如下表所示:
| 化合物 | 甲 | 乙 | 丙 | 丁 |
| 组成元素 | B、C | A、C | A、D | C、D |
(1)丙物质的化学式为
(2)研究表明乙物质具有弱酸性,则乙物质在水中的电离方程式为
(3)某同学设计了一个以结构简式为 BA3-CA的物质为燃料的电池,并用该电池电解200mL一定浓度的NaCl与CuSO4的混合溶液,其装置如下图:

①写出ⅰ中通入该物质这一极的电极反应式

②理论上ⅱ中两极所得气体的体积随时间变化的关系如坐标图所示(气体体积已换算成标准状况下的体积),写出在t1后,石墨电极上的电极反应式
【知识点】 弱电解质的电离 电解池 元素周期表 元素周期律
H2CO3 Ka1=4.4×10﹣7 Ka2=4.7×10﹣11
HNO2 Ka=5.1×10﹣4 HClO Ka=3.0×10﹣8
饱和NaClO溶液的浓度约为3mol/L.
(1)室温下,0.1mol/L NaClO溶液的pH
(2)下列离子反应正确的有:
A.2HCO3﹣+SO2═SO32﹣+2CO2+H2O B.ClO﹣+CO2+H2O═HClO+HCO3﹣
C.ClO﹣+SO2+H2O═HClO+HSO3﹣ D.2ClO﹣+SO2+H2O═2HClO+SO32﹣
(3)某消毒液的有效成分为NaClO,还含有一定量的NaOH等,下列用来解释事实的方程式中不合理的是:
A.该消毒液可用NaOH溶液吸收Cl2制备:Cl2+2OH﹣═Cl﹣+ClO﹣+H2O
B.室温下,该消毒液的pH约为12,主要是因为:ClO﹣+H2O
 HClO+OH﹣
HClO+OH﹣C.该消毒液加白醋生成HClO,可增强漂白作用:H++ClO﹣═HClO
D.该消毒液与洁厕灵(主要成分为HCl)混用,产生Cl2:2H++Cl﹣+ClO﹣═Cl2↑+H2O
(4)25℃时,0.1mol下列气体分别与1L0.l mol·L﹣1的NaOH溶液反应(已知2NO2+2NaOH═NaNO2+NaNO3+H2O),形成的溶液的pH由大到小的顺序为:
A.NO2 B.SO3 C.SO2 D.CO2.
(5)下列说法不正确的是
A.在相同温度下将pH相同的稀硫酸和醋酸溶液等体积混合,所得混合液的pH与原来相同。
B.含等物质的量的NaClO、NaHCO3混合溶液中:c(HClO)+c(ClO﹣)=c(HCO3﹣)+c(H2CO3)+c(CO32﹣)
C.CH3COOH溶液加水稀释后,溶液中c(H+)/C(CH3COO-)的值减小
(6)已知某温度下,0.10mol/LNH4Cl溶液的PH=5,则该温度下NH3·H2O的电离常数约为
【知识点】 水的电离及溶液的酸碱性
试卷分析
试卷题型(共 21题)
试卷难度
知识点分析
细目表分析 导出
| 题号 | 难度系数 | 详细知识点 | 备注 |
| 一、单选题 | |||
| 1 | 0.64 | 弱电解质的电离 | |
| 2 | 0.85 | 弱电解质的电离方程式 | |
| 3 | 0.65 | 溶液pH的计算 盐溶液中离子浓度大小的比较 溶度积 | |
| 4 | 0.64 | 原电池 金属的电化学腐蚀与防护 | |
| 5 | 0.4 | 电解池 | |
| 6 | 0.64 | 水的电离及溶液的酸碱性 | |
| 8 | 0.65 | 离子反应在化合物组成的分析、鉴定的应用 沉淀转化 电解池电解基本判断 | |
| 9 | 0.4 | 盐类的水解 电解池 | |
| 10 | 0.4 | 沉淀溶解平衡的应用 溶度积规则及其应用 | |
| 11 | 0.4 | 盐类的水解 | |
| 12 | 0.65 | 盐类水解规律理解及应用 盐溶液中微粒间的电荷守恒、物料守恒、质子守恒原理 盐溶液中离子浓度大小的比较 | |
| 13 | 0.4 | 水的电离及溶液的酸碱性 盐类的水解 | |
| 14 | 0.4 | 化学实验基础 仪器使用与实验安全 | |
| 15 | 0.4 | 化学电源 | |
| 16 | 0.4 | 电解池 | |
| 二、未知 | |||
| 7 | 0.65 | 金属的电化学腐蚀与防护 吸氧腐蚀 | 未知 |
| 三、填空题 | |||
| 17 | 0.4 | 沉淀溶解平衡 | |
| 18 | 0.4 | 沉淀溶解平衡 | |
| 20 | 0.4 | 弱电解质的电离 电解池 元素周期表 元素周期律 | |
| 21 | 0.64 | 水的电离及溶液的酸碱性 | |
| 四、解答题 | |||
| 19 | 0.4 | 电解池 | 实验探究题 |