3.1.1强电解质和弱电解质 弱电解质的电离平衡 课前
全国
高二
课前预习
2023-08-25
74次
整体难度:
容易
考查范围:
认识化学科学、化学反应原理
3.1.1强电解质和弱电解质 弱电解质的电离平衡 课前
全国
高二
课前预习
2023-08-25
74次
整体难度:
容易
考查范围:
认识化学科学、化学反应原理
一、填空题 添加题型下试题
填空题
|
容易(0.94)
解题方法
1. 电解质和非电解质
(1)电解质:在水溶液中或熔融状态下能___________ 的___________ 。电解质在水溶液或熔融状态下能产生___________ 的离子。
(2)非电解质:在水溶液中和熔融状态下都___________ 的___________ 。
(1)电解质:在水溶液中或熔融状态下能
(2)非电解质:在水溶液中和熔融状态下都
【知识点】 电解质、非电解质概念解读
您最近一年使用:0次
填空题
|
较易(0.85)
2. 强电解质和弱电解质
(1)【实验探究1】盐酸和醋酸的电离实验。
实验结论:两种酸的浓度相等时,盐酸的电离程度___________ 醋酸。
【实验探究2】氢氧化钠溶液和氨水的电离实验。
(2)概念
根据电解质在水溶液中的___________ ,可把电解质分为强电解质和弱电解质。
①强电解质是在水溶液中___________ 的电解质。常见的强电解质有___________ 、___________ 和___________ 。
②弱电解质是在水溶液中___________ 的电解质。常见的弱电解质有___________ 、___________ 。
(1)【实验探究1】盐酸和醋酸的电离实验。
| 实验内容 | 盐酸 | 醋酸 |
| 测量1mol·L-1溶液的pH | ||
| 等体积、等浓度的溶液与镁条反应的现象 |
【实验探究2】氢氧化钠溶液和氨水的电离实验。
| 实验假设 | NaOH的电离程度大于NH3·H2O的电离程度 |
| 实验方案 | 配制相同物质的量浓度的NaOH溶液和氨水,测量溶液的pH |
| 实验现象 | |
| 实验结论 |
根据电解质在水溶液中的
①强电解质是在水溶液中
②弱电解质是在水溶液中
【知识点】 强电解质与弱电解质解读 一元强酸与一元弱酸的比较解读
您最近一年使用:0次
填空题
|
较易(0.85)
解题方法
4. 弱电解质的电离方程式
(1)弱电解质的电离过程是可逆的,其电离方程式用“ ”表示。如:
”表示。如:
CH3COOH:___________ ;
NH3·H2O:___________ 。
(2)多元弱酸是分步电离的,电离程度逐步减弱,可分步书写电离方程式。
如H2CO3的电离方程式:___________ 、___________ 。
(3)多元弱碱的电离也是分步进行的,但是一般按一步电离的形式书写。
如Fe(OH)3的电离方程式是:___________ 。
(1)弱电解质的电离过程是可逆的,其电离方程式用“
 ”表示。如:
”表示。如:CH3COOH:
NH3·H2O:
(2)多元弱酸是分步电离的,电离程度逐步减弱,可分步书写电离方程式。
如H2CO3的电离方程式:
(3)多元弱碱的电离也是分步进行的,但是一般按一步电离的形式书写。
如Fe(OH)3的电离方程式是:
您最近一年使用:0次
填空题
|
容易(0.94)
5. 电离平衡的概念
在一定温度下,当弱电解质在水溶液中的电离程度达到___________ 时,弱电解质分子电离成离子与离子结合成弱电解质分子的___________ 相等,溶液中各分子和离子的浓度___________ 的状态。
在一定温度下,当弱电解质在水溶液中的电离程度达到
【知识点】 弱电解质的电离平衡
您最近一年使用:0次
填空题
|
容易(0.94)
6. 电离平衡的特征
(1)弱电解质的电离平衡是一种___________ 平衡,达到平衡时,分子电离成离子和离子结合成分子的过程并___________ 。
(2)___________ 速率和___________ 速率相等。
(3)溶液中各分子和离子的浓度都___________ 。
(4)外界条件发生变化,电离平衡___________ 。
(1)弱电解质的电离平衡是一种
(2)
(3)溶液中各分子和离子的浓度都
(4)外界条件发生变化,电离平衡
【知识点】 弱电解质的电离平衡
您最近一年使用:0次
填空题
|
较易(0.85)
7. 外部因素:
电离平衡的移动符合勒夏特列原理,在分析影响电离平衡的因素的问题时,关键是要正确运用化学平衡移动的知识,既要考虑平衡移动的方向,又要考虑各物质的量的变化。注意平衡正向移动时,生成物离子浓度不一定增大,还要考虑引起平衡移动的原因。
现以0.1 mol·L-1 的CH3COOH溶液为例,分析影响电离平衡的因素及平衡移动结果。
电离方程式为CH3COOH CH3COO-+H+。
CH3COO-+H+。
电离平衡的移动符合勒夏特列原理,在分析影响电离平衡的因素的问题时,关键是要正确运用化学平衡移动的知识,既要考虑平衡移动的方向,又要考虑各物质的量的变化。注意平衡正向移动时,生成物离子浓度不一定增大,还要考虑引起平衡移动的原因。
现以0.1 mol·L-1 的CH3COOH溶液为例,分析影响电离平衡的因素及平衡移动结果。
电离方程式为CH3COOH
 CH3COO-+H+。
CH3COO-+H+。| 影响因素 | 平衡移动方向 | n(H+) | c(H+) | c(CH3COO-) | pH | 导电能力 |
| 升温(不考虑挥发) | ||||||
| 加冰醋酸 | ||||||
| 加水稀释 | ||||||
| 加CH3COONa固体 | ||||||
| 通HCl气体 | ||||||
| 加NaOH固体 | ||||||
| 加金属Zn |
【知识点】 弱电解质电离平衡的影响因素
您最近一年使用:0次
填空题
|
较易(0.85)
8. 现有如下各物质:
①酒精 ②氯化铵 ③氢氧化钡 ④氨水 ⑤硫酸 ⑥铜 ⑦磷酸 ⑧二氧化碳。
(1)属于强电解质的有___________ 。
(2)属于弱电解质的有___________ 。
(3)属于非电解质的有___________ 。
(4)能导电的有___________ 。
①酒精 ②氯化铵 ③氢氧化钡 ④氨水 ⑤硫酸 ⑥铜 ⑦磷酸 ⑧二氧化碳。
(1)属于强电解质的有
(2)属于弱电解质的有
(3)属于非电解质的有
(4)能导电的有
【知识点】 非电解质、电解质物质类别判断解读 强电解质与弱电解质解读
您最近一年使用:0次
二、单选题 添加题型下试题
单选题
|
较易(0.85)
9. 下列有关弱电解质的电离平衡的叙述正确的是
| A.达到电离平衡时,弱电解质分子浓度和离子浓度相等 |
| B.达到电离平衡时,由于分子和离子的浓度不断发生变化,所以说电离平衡是动态平衡 |
| C.电离平衡是相对的、暂时的,外界条件改变时,平衡就可能发生移动 |
| D.达到电离平衡后,溶液中不存在分子,只存在离子 |
【知识点】 弱电解质的电离平衡
您最近一年使用:0次
单选题
|
较易(0.85)
10. 下列说法正确的是
| A.根据溶液中有CH3COOH、CH3COO-和H+即可证明CH3COOH达到电离平衡状态 |
| B.根据溶液中CH3COO-和H+的物质的量浓度相等即可证明CH3COOH达到电离平衡状态 |
| C.当NH3·H2O达到电离平衡时,溶液中NH3·H2O、NH4+和OH-的浓度相等 |
| D.H2CO3是分步电离的,电离程度依次减弱 |
【知识点】 弱电解质的电离平衡 弱电解质在水溶液中的电离平衡解读
您最近一年使用:0次
2016-12-09更新
|
676次组卷
|
11卷引用:2015-2016学年内蒙古杭锦后旗奋斗中学高二下期中化学卷
2015-2016学年内蒙古杭锦后旗奋斗中学高二下期中化学卷(已下线)同步君 选修4 第3章 第1节 弱电解质的电离(已下线)【百强校】2016-2017学年浙江省温州中学高二上期中化学卷(带解析)高中化学人教版 选修四 第三章 水溶液中的离子反应 第一节 弱电解质的电离 弱电解质的电离(已下线)2019年10月2日 《每日一题》选修4—— 电离平衡的特征及建立浙江省丽水四校2019-2020学年高三10月联考化学试题辽宁省铁岭市开原市第二高级中学2020-2021学年高二上学期期初考试化学试题广西贺州市平桂管理区公会中学2021-2022学年上学期高二第二次月考化学(理)试题山西省太原市英才学校2021-2022学年高二上学期第二次月考化学试题(已下线)专题卷12 强弱电解质分析比较-【小题小卷】冲刺2023年高考化学小题限时集训(新高考专用)3.1.1强电解质和弱电解质 弱电解质的电离平衡 课前
单选题
|
较易(0.85)
名校
11. 下列各项中电解质的电离方程式中正确的是( )
A.NaHCO3的水溶液:NaHCO3 = Na++H++ |
B.熔融状态的NaHSO4:NaHSO4 = Na++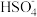 |
| C.HF的水溶液:HF=H++F- |
D.H2S 的水溶液:H2S 2H++S2- 2H++S2- |
【知识点】 弱电解质的电离方程式解读
您最近一年使用:0次
2016-12-09更新
|
420次组卷
|
7卷引用:2015-2016学年河南省许昌市四校高二上学期第三次联考化学试卷
2015-2016学年河南省许昌市四校高二上学期第三次联考化学试卷北京市通州区2019-2020学年高二下学期期末考试化学试题(已下线)第18讲 弱电解质的电离-2021年高考化学一轮复习名师精讲练(已下线)第三章 水溶液中的离子平衡(基础过关)-2020-2021学年高二化学单元测试定心卷(人教版选修4)陕西省西安市西航一中2021-2022学年高二上学期期中考试化学试题广西贺州市平桂管理区公会中学2021-2022学年上学期高二第二次月考化学(理)试题3.1.1强电解质和弱电解质 弱电解质的电离平衡 课前
单选题
|
较易(0.85)
名校
12. 在0.1 mol·L-1的HCN溶液中存在如下电离平衡:HCN H++CN-,下列叙述不正确的是
H++CN-,下列叙述不正确的是
 H++CN-,下列叙述不正确的是
H++CN-,下列叙述不正确的是| A.加入少量NaOH固体,平衡正向移动 |
| B.加水,平衡正向移动 |
| C.滴加少量0.1 mol·L-1的HCl溶液,溶液中c(H+) 增大 |
| D.加入少量NaCN固体,平衡正向移动 |
【知识点】 弱电解质电离平衡的影响因素
您最近一年使用:0次
2023-07-15更新
|
187次组卷
|
2卷引用:3.1.1强电解质和弱电解质 弱电解质的电离平衡 课前
试卷分析
整体难度:较易
考查范围:认识化学科学、化学反应原理
试卷题型(共 12题)
题型
数量
填空题
8
单选题
4
试卷难度
细目表分析 导出
| 题号 | 难度系数 | 详细知识点 | 备注 |
| 一、填空题 | |||
| 1 | 0.94 | 电解质、非电解质概念 | |
| 2 | 0.85 | 强电解质与弱电解质 一元强酸与一元弱酸的比较 | |
| 3 | 0.94 | 电离方程式 | |
| 4 | 0.85 | 弱电解质的电离平衡 弱电解质的电离方程式 弱电解质在水溶液中的电离平衡 | |
| 5 | 0.94 | 弱电解质的电离平衡 | |
| 6 | 0.94 | 弱电解质的电离平衡 | |
| 7 | 0.85 | 弱电解质电离平衡的影响因素 | |
| 8 | 0.85 | 非电解质、电解质物质类别判断 强电解质与弱电解质 | |
| 二、单选题 | |||
| 9 | 0.85 | 弱电解质的电离平衡 | |
| 10 | 0.85 | 弱电解质的电离平衡 弱电解质在水溶液中的电离平衡 | |
| 11 | 0.85 | 弱电解质的电离方程式 | |
| 12 | 0.85 | 弱电解质电离平衡的影响因素 | |



