名校
1 . 电化学原理在电池制造、能量转换、物质合成等方面应用广泛。
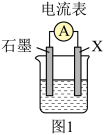
(1)若用如图1装置,依据反应Cu+2Fe3+=2Fe2++Cu2+设计原电池,则电极X应为_____ (填化学式),石墨电极的电极反应式为_____ 。将石墨换成铁电极后,电池总反应变为_____ 。
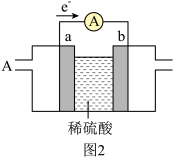
(2)燃料电池必须从电池外部源源不断地向电池提供天然气、甲烷、煤气等含氢化合物作为燃料。基于甲烷(CH4)-空气燃料电池,其工作原理如图2,a、b均为惰性电极。a为_____ 极,正极的电极反应式为_____ 。当通入4.48L(标准状况下)甲烷气体时,测得电路中转移1.1mol电子,则甲烷的利用率为_____ 。(保留小数点后1位)。
(3)在固态金属氧化物电解池中,高温共电解H2O-CO2混合气体制备H2和CO是一种新的能源利用方式,基本原理如图3所示:

已知H2O在电极附近发生电极反应H2O+2e-=H2+O2-,则CO2发生的电极反应为_____ 。当H2和CO共生成2mol时,生成标准状况下O2的体积为_____ 。
(1)若用如图1装置,依据反应Cu+2Fe3+=2Fe2++Cu2+设计原电池,则电极X应为

(2)燃料电池必须从电池外部源源不断地向电池提供天然气、甲烷、煤气等含氢化合物作为燃料。基于甲烷(CH4)-空气燃料电池,其工作原理如图2,a、b均为惰性电极。a为

(3)在固态金属氧化物电解池中,高温共电解H2O-CO2混合气体制备H2和CO是一种新的能源利用方式,基本原理如图3所示:

已知H2O在电极附近发生电极反应H2O+2e-=H2+O2-,则CO2发生的电极反应为
您最近半年使用:0次
2023-04-29更新
|
232次组卷
|
2卷引用:山东省菏泽市2022-2023学年高一下学期期中考试化学(A)试题
2 . 1905年哈伯实现了以氮气和氢气为原料合成氨气,生产的氨制造氮肥服务于农业,养活了地球三分之一的人口,哈伯也因此获得了1918年的诺贝尔化学奖。一百多年过去了,对合成氨的研究依然没有止步。
(1)已知在一定温度下进行的化学反应,反应所释放或吸收的能量称为该温度下的反应热。反应热用符号△H表示;△H =反应物断键吸收总能量-生成物成键放出总能量,若△H<0为放热反应,△H>0为吸热反应。如H2和O2反应: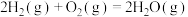 放热,且断开1 mol H-H键、1mol O=O键、1 molO-H键需吸收的能量分别为
放热,且断开1 mol H-H键、1mol O=O键、1 molO-H键需吸收的能量分别为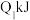 、
、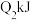 、
、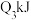 ,可推知△H数值
,可推知△H数值 ,则反应中能量变化为
,则反应中能量变化为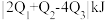 。对工业合成氨的反应如下:
。对工业合成氨的反应如下: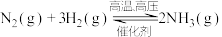 ,已知断裂1 mol N2中的共价键吸收的能量为947 kJ,断裂1 mol H2中的共价键吸收的能量为436 kJ,形成1 mol N-H键放出的能量为391 kJ,则由N2(g)和H2 (g)生成1 mol NH3(g)的能量变化为
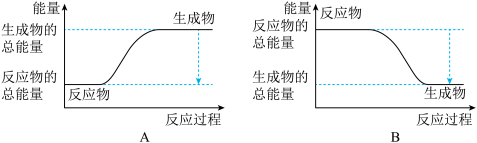
,已知断裂1 mol N2中的共价键吸收的能量为947 kJ,断裂1 mol H2中的共价键吸收的能量为436 kJ,形成1 mol N-H键放出的能量为391 kJ,则由N2(g)和H2 (g)生成1 mol NH3(g)的能量变化为_______ kJ;下图能正确表示该反应中能量变化的是_________ (填“A”或“B”)。
(2)反应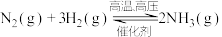 在三种不同条件下进行,N2、N2的起始浓度为0,反应物NH3的浓度(mol/L)随时间(min)的变化情况如下表所示。
在三种不同条件下进行,N2、N2的起始浓度为0,反应物NH3的浓度(mol/L)随时间(min)的变化情况如下表所示。
根据上表数据回答:实验①②中,有一个实验使用了催化剂,它是实验_______ (填序号);实验③达平衡时NH3的转化率为_______ 。在恒温恒容条件下,判断该反应达到化学平衡状态的标志是_______ (填字母)。
a.NH3的正反应速率等于逆反应速率 b.混合气体的密度不变
c.混合气体的压强不变 d.c(NH3)=c(H2)
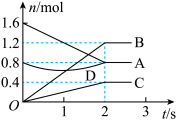
(3)某温度下,在体积为3 L的容器中,A、B、C三种气体物质物质的量随着时间变化的关系如图所示,则①该反应的化学方程式为_______ ,②反应开始至2 s时,B的平均反应速率为_______ 。
(4)氢气是未来最理想的能源。科学家最近研制出利用太阳能产生激光,并在二氧化钛(TiO2)表面作用下使海水分解得到氢气的新技术: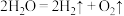 ,制得的氢气可用于制作燃料电池。试回答下列问题:
,制得的氢气可用于制作燃料电池。试回答下列问题:
①某种氢氧燃料电池是用固体金属氧化物陶瓷作电解质,A极上发生的电极反应为 ,则A极是电池的
,则A极是电池的_______ 极。
②一种人工合成汽油的方法是先将煤制成CO和H2,然后在一定条件下将CO与H2转化为碳原子数为5~8的烷烃(人工合成汽油)。若以CnH2n+2表示人工合成汽油的成分,请写出用CO与H2制取CnH2n+2的化学方程式_______ 。
(1)已知在一定温度下进行的化学反应,反应所释放或吸收的能量称为该温度下的反应热。反应热用符号△H表示;△H =反应物断键吸收总能量-生成物成键放出总能量,若△H<0为放热反应,△H>0为吸热反应。如H2和O2反应:
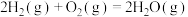 放热,且断开1 mol H-H键、1mol O=O键、1 molO-H键需吸收的能量分别为
放热,且断开1 mol H-H键、1mol O=O键、1 molO-H键需吸收的能量分别为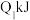 、
、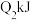 、
、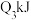 ,可推知△H数值
,可推知△H数值 ,则反应中能量变化为
,则反应中能量变化为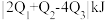 。对工业合成氨的反应如下:
。对工业合成氨的反应如下: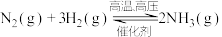 ,已知断裂1 mol N2中的共价键吸收的能量为947 kJ,断裂1 mol H2中的共价键吸收的能量为436 kJ,形成1 mol N-H键放出的能量为391 kJ,则由N2(g)和H2 (g)生成1 mol NH3(g)的能量变化为
,已知断裂1 mol N2中的共价键吸收的能量为947 kJ,断裂1 mol H2中的共价键吸收的能量为436 kJ,形成1 mol N-H键放出的能量为391 kJ,则由N2(g)和H2 (g)生成1 mol NH3(g)的能量变化为
(2)反应
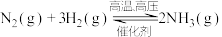 在三种不同条件下进行,N2、N2的起始浓度为0,反应物NH3的浓度(mol/L)随时间(min)的变化情况如下表所示。
在三种不同条件下进行,N2、N2的起始浓度为0,反应物NH3的浓度(mol/L)随时间(min)的变化情况如下表所示。| 实验序号 | 时间浓度温度 | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
| ① | 400℃ | 1.0 | 0.80 | 0.67 | 0.57 | 0.50 | 0.50 | 0.50 |
| ② | 400℃ | 1.0 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 | 0.50 |
| ③ | 500℃ | 1.0 | 0.40 | 0.25 | 0.15 | 0.15 | 0.15 | 0.15 |
a.NH3的正反应速率等于逆反应速率 b.混合气体的密度不变
c.混合气体的压强不变 d.c(NH3)=c(H2)
(3)某温度下,在体积为3 L的容器中,A、B、C三种气体物质物质的量随着时间变化的关系如图所示,则①该反应的化学方程式为

(4)氢气是未来最理想的能源。科学家最近研制出利用太阳能产生激光,并在二氧化钛(TiO2)表面作用下使海水分解得到氢气的新技术:
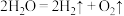 ,制得的氢气可用于制作燃料电池。试回答下列问题:
,制得的氢气可用于制作燃料电池。试回答下列问题:①某种氢氧燃料电池是用固体金属氧化物陶瓷作电解质,A极上发生的电极反应为
 ,则A极是电池的
,则A极是电池的②一种人工合成汽油的方法是先将煤制成CO和H2,然后在一定条件下将CO与H2转化为碳原子数为5~8的烷烃(人工合成汽油)。若以CnH2n+2表示人工合成汽油的成分,请写出用CO与H2制取CnH2n+2的化学方程式
您最近半年使用:0次



