1 . 某地区利用其自然资源建立的工业体系如下图所示。
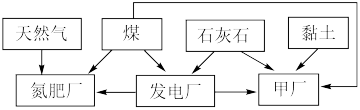
回答下列问题:
(1)“甲厂”为提高反应速率和原料的利用率,应先将石灰石进行___________ 处理。依据所使用的资源分析,“甲厂”的产品是___________ 。
(2)天然气中含有少量有害气体 ,常用NaOH溶液进行洗涤除去,反应的离子方程式为
,常用NaOH溶液进行洗涤除去,反应的离子方程式为___________ 。若改为使用三乙醇胺[N(CH2CH2OH)3]溶液洗涤,则每年节约资金可达百万元。已知在常温下三乙醇胺为液体,沸点为380℃,与 的反应为
的反应为 。解释能节约资金的原因
。解释能节约资金的原因___________ 。
(3)煤中含有一定量 。为减少大气污染,在煤燃烧发电时需加入石灰石脱硫,简称“钙基固硫”,“钙基固硫”最终得到的含硫物质的化学式为
。为减少大气污染,在煤燃烧发电时需加入石灰石脱硫,简称“钙基固硫”,“钙基固硫”最终得到的含硫物质的化学式为___________ 。后来改为在煤燃烧前,用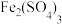 溶液溶解煤中的
溶液溶解煤中的 进行脱硫,写出反应化学方程式
进行脱硫,写出反应化学方程式___________ 。
(4)氮肥厂产生的“氨氮”废水中含有铵盐,直接排放会产生水体污染。传统的处理方法有多种。近年,电化学处理“氨氮”废水成为了研究热点,其中的一种原理如下图所示。
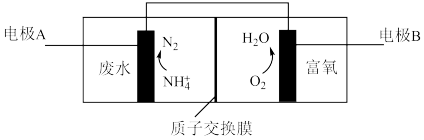
①检验废水中含有 的操作是
的操作是___________ 。
②电极B是___________ 极。
③写出电极A上发生的电极反应式___________ 。

回答下列问题:
(1)“甲厂”为提高反应速率和原料的利用率,应先将石灰石进行
(2)天然气中含有少量有害气体
 ,常用NaOH溶液进行洗涤除去,反应的离子方程式为
,常用NaOH溶液进行洗涤除去,反应的离子方程式为 的反应为
的反应为 。解释能节约资金的原因
。解释能节约资金的原因(3)煤中含有一定量
 。为减少大气污染,在煤燃烧发电时需加入石灰石脱硫,简称“钙基固硫”,“钙基固硫”最终得到的含硫物质的化学式为
。为减少大气污染,在煤燃烧发电时需加入石灰石脱硫,简称“钙基固硫”,“钙基固硫”最终得到的含硫物质的化学式为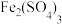 溶液溶解煤中的
溶液溶解煤中的 进行脱硫,写出反应化学方程式
进行脱硫,写出反应化学方程式(4)氮肥厂产生的“氨氮”废水中含有铵盐,直接排放会产生水体污染。传统的处理方法有多种。近年,电化学处理“氨氮”废水成为了研究热点,其中的一种原理如下图所示。

①检验废水中含有
 的操作是
的操作是②电极B是
③写出电极A上发生的电极反应式
您最近一年使用:0次
名校
解题方法
2 . 一种稳定且具有低成本效益的碱性混合多硫化物-空气氧化还原液流电池结构如图所示。下列说法正确的是
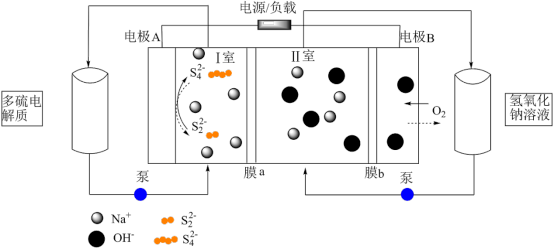

| A.膜a为阴离子膜,膜b为阳离子膜 |
B.充电时的总反应为:4OH-+2 =4 =4 +O2+2H2O +O2+2H2O |
C.放电时,左侧贮液室中含 的多硫电解质减少 的多硫电解质减少 |
| D.放电时,外电路通过2mol电子,理论上II室及右侧贮液器中的NaOH总共减少2mol |
您最近一年使用:0次
2023-03-14更新
|
1856次组卷
|
5卷引用:湖北省黄冈中学2023届高三第三次模拟考试化学试题
湖北省黄冈中学2023届高三第三次模拟考试化学试题湖北省华中师范大学第一附属中学2024届高三上学期化学独立作业(9月23日)试题四川省成都市第七中学2023届高三下学期二诊模拟考试理科综合化学试题(已下线)河南省湘豫名校2023届高三下学期第一次模拟化学试题变式题(选择题11-13)湖南省衡阳市第八中学2023-2024学年高三上学期12月月考化学试题
名校
解题方法
3 . 一种混合水性 可充电电池的能量密度较传统锂电池有明显提高,其放电时工作原理如图所示。下列叙述正确的是
可充电电池的能量密度较传统锂电池有明显提高,其放电时工作原理如图所示。下列叙述正确的是

 可充电电池的能量密度较传统锂电池有明显提高,其放电时工作原理如图所示。下列叙述正确的是
可充电电池的能量密度较传统锂电池有明显提高,其放电时工作原理如图所示。下列叙述正确的是
A.放电刚开始,电池负极材料为Zn,正极材料为 |
B.充电过程中K+通过离子交换膜移向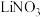 溶液 溶液 |
C.放电过程总反应: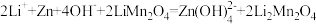 |
D.充电时电路中每通过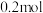 ,理论上可使 ,理论上可使 电极增重1.4g 电极增重1.4g |
您最近一年使用:0次
2022-11-05更新
|
1061次组卷
|
3卷引用:湖北省武汉市洪山区武汉西藏中学2023-2024学年高三上学期1月期末理综试题-高中化学
解题方法
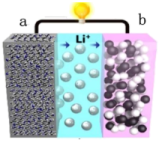
4 . 锂离子电池应用广泛,某课题组使用纳米Si-C复合颗粒直接与锂接触,形成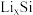 ,将锂盐溶于三乙二醇二甲醚(TEGDME)作为电解液,与
,将锂盐溶于三乙二醇二甲醚(TEGDME)作为电解液,与 电极匹配组成如图所示原电池。该电池的总反应为
电极匹配组成如图所示原电池。该电池的总反应为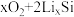
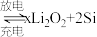 ,下列说法
,下列说法正确的是
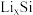 ,将锂盐溶于三乙二醇二甲醚(TEGDME)作为电解液,与
,将锂盐溶于三乙二醇二甲醚(TEGDME)作为电解液,与 电极匹配组成如图所示原电池。该电池的总反应为
电极匹配组成如图所示原电池。该电池的总反应为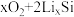
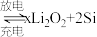 ,下列说法
,下列说法
| A.该电池放电时,a为正极 |
B.充电和放电过程,电解液中 浓度都会改变 浓度都会改变 |
C.放电时,当负极质量减少14g时,电解液中转移1mol |
D.电池充电时,阳极的电极反应为 |
您最近一年使用:0次
解题方法
5 .  电池功率大,可用于海上导航,其结构如图所示。下列说法正确的是
电池功率大,可用于海上导航,其结构如图所示。下列说法正确的是
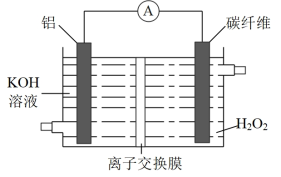
 电池功率大,可用于海上导航,其结构如图所示。下列说法正确的是
电池功率大,可用于海上导航,其结构如图所示。下列说法正确的是 
A.电池工作时, 从交换膜左移向右 从交换膜左移向右 |
| B.电子流动方向:铝电极→导线→碳纤维 |
| C.该电池能将化学能完全转化为电能 |
D.铝电极表面有大量 产生 产生 |
您最近一年使用:0次
名校
解题方法
6 . 人们应用原电池原理制作了多种电池,广泛使用于日常生活、生产和科学技术等方面,以满足不同的需要。请按要求回答下列问题:
(1)新一代锂二次电池体系和全固态锂二次电池体系是化学、物理等学科的基础理论研究与应用技术的前沿。
①Li—CuO二次电池的比能量高、工作温度宽。Li—CuO二次电池中,放电时金属锂作____ 极。比能量是指消耗单位质量的电极所释放的电量,可用来衡量电池的优劣,则Li、Na、Al分别作为电极时比能量由大到小的顺序为____ 。
②一种制备CuO的过程如图:

“酸浸反应”中,H2O2作____ (填“氧化剂”或“还原剂”)。写出“混合沉淀”过程产生Cu2(OH)2CO3反应的离子方程式:____ 。
(2)CH3OH可作为燃料使用,使用CH3OH和O2组合设计的燃料电池的结构如图所示,电池总反应为2CH3OH+3O2=2CO2+4H2O,质子(H+)交换膜左右两侧的溶液均为等浓度的稀硫酸。

①物质a为____ (填化学式);电极c上发生的电极反应为____ 。
②电极d为____ 极,电极d上发生的电极反应为____ 。
(1)新一代锂二次电池体系和全固态锂二次电池体系是化学、物理等学科的基础理论研究与应用技术的前沿。
①Li—CuO二次电池的比能量高、工作温度宽。Li—CuO二次电池中,放电时金属锂作
②一种制备CuO的过程如图:

“酸浸反应”中,H2O2作
(2)CH3OH可作为燃料使用,使用CH3OH和O2组合设计的燃料电池的结构如图所示,电池总反应为2CH3OH+3O2=2CO2+4H2O,质子(H+)交换膜左右两侧的溶液均为等浓度的稀硫酸。

①物质a为
②电极d为
您最近一年使用:0次
2022-05-03更新
|
253次组卷
|
3卷引用:湖北省黄冈市部分重点中学2021-2022学年高一下学期4月期中联考化学试题
名校
解题方法
7 . 我国科学家设计的一种甲酸(HCOOH)燃料电池如下图所示(半透膜只允许K+、H+通过),下列说法错误的是
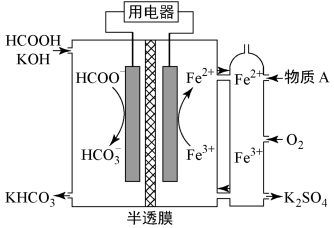

| A.物质A可以是硫酸氢钾 |
B.左侧为电池负极,HCOO-发生氧化反应生成 |
C.该燃料电池的总反应为: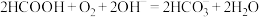 |
| D.右侧每消耗11.2 LO2(标况),左侧有1 mol K+通过半透膜移向右侧 |
您最近一年使用:0次
2022-02-05更新
|
350次组卷
|
3卷引用:湖北省恩施州高中教育联盟2022-2023学年高一下学期期末考试化学试题
解题方法
8 . I.一种利用电化学原理治污的装置如下图,其反应原理是6NO2+8NH3=7N2+12H2O
(1)A电极的电极反应式为___________ 。
(2)下列关于该电池说法正确的是___________(填序号)。
II.全钒液流电池(VFB)是目前最成熟的液流电池技术。它通过钒离子价态的相互转化实现能量的存储和释放。下图为VFB放电工作原理。
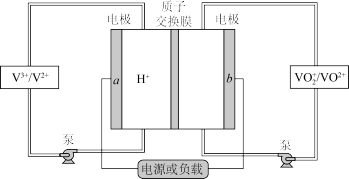
(3)电极b为___________ 极(填“正”或“负”)。充电时,该电极的反应为___________ 。
(4)若负载为如图2所示的装置,A、B、C、D均为石墨电极。
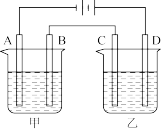
①甲槽是电极电解饱和食盐水的装置,产生40 g NaOH时,VFB电池中消耗___________ mol H+。
②乙槽为200 mLCuSO4溶液,当C电极析出0.64 g物质时,则乙槽中生成的H2SO4的物质的量为___________ mol。
③若通电一段时间后,向所得的乙槽溶液中加入0.2 mol的Cu(OH)2才能恰好恢复到电解前的浓度,则电解过程中转移的电子数为___________ (用NA表示)
(5)锂离子电池的一种工作方式为Li+在电池两极的嵌入或迁出,以石墨做正极时,充电过程中,Li+在该石墨电极上___________ (填“嵌入”或“迁出”)。

(1)A电极的电极反应式为
(2)下列关于该电池说法正确的是___________(填序号)。
| A.电子从右侧电极经过负载后流向左侧电极 |
| B.为使电池持续放电,离子交换膜需选用阴离子交换膜 |
| C.电池工作一段时间,溶液的pH不变 |
| D.当有44.8 LNO2被处理时,转移电子的物质的量为8 mol |
II.全钒液流电池(VFB)是目前最成熟的液流电池技术。它通过钒离子价态的相互转化实现能量的存储和释放。下图为VFB放电工作原理。

(3)电极b为
(4)若负载为如图2所示的装置,A、B、C、D均为石墨电极。

①甲槽是电极电解饱和食盐水的装置,产生40 g NaOH时,VFB电池中消耗
②乙槽为200 mLCuSO4溶液,当C电极析出0.64 g物质时,则乙槽中生成的H2SO4的物质的量为
③若通电一段时间后,向所得的乙槽溶液中加入0.2 mol的Cu(OH)2才能恰好恢复到电解前的浓度,则电解过程中转移的电子数为
(5)锂离子电池的一种工作方式为Li+在电池两极的嵌入或迁出,以石墨做正极时,充电过程中,Li+在该石墨电极上
您最近一年使用:0次
9 . pH计是一种采用原电池原理测量溶液pH的仪器。如图所示,以玻璃电极(在特制玻璃薄膜球内放置已知浓度的HCl溶液,并插入Ag—AgCl电极)和另一Ag—AgCl电极插入待测溶液中组成电池,pH与电池的电动势E存在关系:pH=(E-常数)/0.059。下列说法正确的是
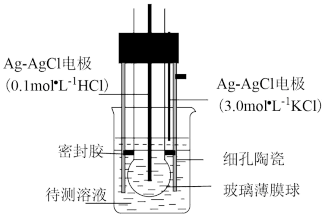

| A.如果玻璃薄膜球内电极的电势低,则该电极反应式为:AgCl(s)+e-=Ag(s)+Cl-(0.1mol·L-1) |
| B.玻璃膜内外氢离子浓度的差异不会引起电动势的变化 |
| C.分别测定含已知pH的标准溶液和未知溶液的电池的电动势,可得出未知溶液的pH |
| D.pH计工作时,电能转化为化学能 |
您最近一年使用:0次
2022-01-12更新
|
9535次组卷
|
23卷引用:湖北省武汉六中2023-2024学年高三上学期第5次月考化学试题
湖北省武汉六中2023-2024学年高三上学期第5次月考化学试题2022 年1月浙江省普通高校招生选考科目考试化学试题(已下线)卷08 电化学及其应用-【小题小卷】冲刺2022年高考化学小题限时集训(新高考专用)辽宁省实验中学2021-2022学年高一下学期期中阶段测试化学试题(已下线)2022年浙江1月高考真题变式题(21-25)(已下线)考点18 原电池 化学电源-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)第34练 原电池-2023年高考化学一轮复习小题多维练(全国通用)(已下线)第16讲 原电池 新型电源 (讲)-2023年高考化学一轮复习讲练测(新教材新高考)陕西师范大学附属中学、渭北中学等2022-2023学年高三上学期期初检测化学联考试题陕西师范大学附属中学、渭北中学等2023届高三上学期期初检测联考化学试题(已下线)易错点19 电化学基础-备战2023年高考化学考试易错题新疆石河子第一中学2022-2023学年高三10月月考化学试题山东省青岛第二中学2022-2023学年高二上学期期中考试化学试题(已下线)专题05 化学能与电能的转化(练)-2023年高考化学二轮复习讲练测(新高考专用)趋势5 新概念应用类试题(已下线)专题8 新概念应用(已下线)专题12 电化学的综合应用(已下线)专题12 电化学的综合应用微专题(14) 新型化学电源(已下线)考点19 电解池(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)考点2 原电池 新型电源(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)陕西师范大学附属中学2023-2024学年高二上学期期中考试化学试题(已下线)题型11 新型电化学装置分析-2024年高考化学二轮热点题型归纳与变式演练(新高考通用)
名校
10 . 中科院福建物构所YaobingWang团队首次构建了一种可逆水性Zn—CO2电池,实现了CO2和HCOOH之间的高效可逆转换,其反应原理如图所示:
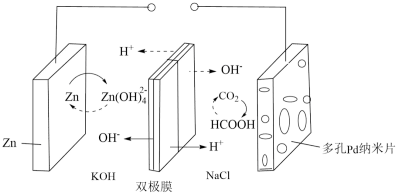
已知双极膜可将水解离为 和
和 ,并实现其定向通过。下列说法中错误的是
,并实现其定向通过。下列说法中错误的是

已知双极膜可将水解离为
 和
和 ,并实现其定向通过。下列说法中错误的是
,并实现其定向通过。下列说法中错误的是A.放电时,负极电极反应式为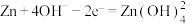 |
| B.CO2转化为HCOOH过程中,Zn电极的电势低于多孔Pd电极的 |
| C.充电过程中,甲酸在多孔Pd电极表面转化为CO2 |
| D.当外电路通过2mol电子时,双极膜中离解水的物质的量为1mol |
您最近一年使用:0次
2022-01-02更新
|
744次组卷
|
10卷引用:湖北省新高考2021-2022学年高三上学期12月质量检测巩固卷化学试题
湖北省新高考2021-2022学年高三上学期12月质量检测巩固卷化学试题(已下线)二轮拔高卷2-【赢在高考·黄金20卷】备战2022年高考化学模拟卷(湖北专用)湖南省常德市临澧县第一中学2021-2022学年高三第九次阶段性考试化学试题(已下线)一轮巩固卷2-【赢在高考·黄金20卷】备战2022年高考化学模拟卷(北京专用)(已下线)回归教材重难点03 电化学基础知识-【查漏补缺】2022年高考化学三轮冲刺过关(新高考专用)(已下线)回归教材重难点03 电化学-【查漏补缺】2022年高考化学三轮冲刺过关(全国通用)(已下线)考点18 原电池 化学电源-备战2023年高考化学一轮复习考点帮(全国通用)黑龙江省双鸭山市第一中学2021-2022学年高二下学期开学考试化学试题四川省绵阳南山中学2023-2024学年高二上学期10月月考化学试题 河南省周口市文昌中学2023-2024学年高三上学期12月月考化学试题



