名校
1 . 化学性质类似 的盐酸羟胺
的盐酸羟胺 是一种常见的还原剂和显像剂,工业上主要通过图1所示的方法制备,装置中含
是一种常见的还原剂和显像剂,工业上主要通过图1所示的方法制备,装置中含 的催化电极反应机理如图2所示。图3是用图1的电池电解处理含有
的催化电极反应机理如图2所示。图3是用图1的电池电解处理含有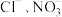 的酸性废水的装置。下列说法错误的是
的酸性废水的装置。下列说法错误的是
 的盐酸羟胺
的盐酸羟胺 是一种常见的还原剂和显像剂,工业上主要通过图1所示的方法制备,装置中含
是一种常见的还原剂和显像剂,工业上主要通过图1所示的方法制备,装置中含 的催化电极反应机理如图2所示。图3是用图1的电池电解处理含有
的催化电极反应机理如图2所示。图3是用图1的电池电解处理含有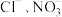 的酸性废水的装置。下列说法错误的是
的酸性废水的装置。下列说法错误的是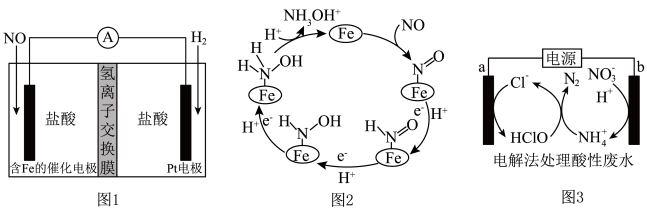
| A.图1作图3装置电源时,电极b与Pt电极相连 |
B.图1电池工作时,含 的催化电极的电极反应式为 的催化电极的电极反应式为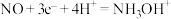 |
C.理论上,当图1电池中有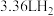 参与反应时,左室溶液质量增加 参与反应时,左室溶液质量增加 |
D.图3装置中每处理 使其转化为 使其转化为 ,酸性废水中 ,酸性废水中 减少 减少 |
您最近一年使用:0次
7日内更新
|
59次组卷
|
2卷引用:2024届青海省西宁市大通县高三下学期高考四模理科综合试卷-高中化学
2 . 一种钠离子电池的工作原理如图所示,放电时电池反应可表示为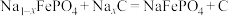 。下列说法错误的是
。下列说法错误的是
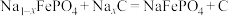 。下列说法错误的是
。下列说法错误的是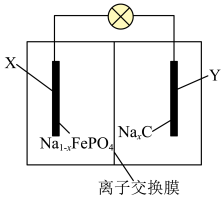
| A.离子交换膜为阳离子交换膜 |
B.放电时, 极发生氧化反应 极发生氧化反应 |
C.充电时, 极电极反应式为 极电极反应式为 |
D.充电时,每转移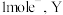 极质量减少 极质量减少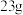 |
您最近一年使用:0次
解题方法
3 . 某大学研究团队推出一种新型Zn-NO2电池。该电池能有效地捕获NO2,将其转化为 ,再将产生的
,再将产生的 电解制氨,过程如图所示。下列说法正确的是
电解制氨,过程如图所示。下列说法正确的是
 ,再将产生的
,再将产生的 电解制氨,过程如图所示。下列说法正确的是
电解制氨,过程如图所示。下列说法正确的是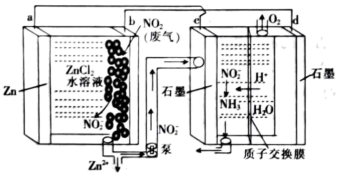
| A.d电极的电势比c电极的电势高 |
| B.Zn极为原电池正极 |
C.c极的电极反应为 -6e-+7H+=NH3+2H2O -6e-+7H+=NH3+2H2O |
| D.电路中转移0.2mole-时,理论上能得到1.12LO2 |
您最近一年使用:0次
2024-04-21更新
|
181次组卷
|
2卷引用:2024届青海省海东市高三下学期二模理科综合试卷-高中化学
名校
解题方法
4 . 自由基因为化学性质不稳定往往不能稳定存在,羟基自由基(·OH)有极强的氧化性,其氧化性仅次于氟单质。我国科学家设计的一种能将苯酚( )氧化为
)氧化为 和
和 的原电池—电解池组合装置如图所示,该装置能实现发电、环保二位一体。下列说法错误的是
的原电池—电解池组合装置如图所示,该装置能实现发电、环保二位一体。下列说法错误的是
 )氧化为
)氧化为 和
和 的原电池—电解池组合装置如图所示,该装置能实现发电、环保二位一体。下列说法错误的是
的原电池—电解池组合装置如图所示,该装置能实现发电、环保二位一体。下列说法错误的是
| A.该装置工作时,电流方向为电极b→Ⅲ室→Ⅱ室→Ⅰ室→电极a |
B.当电极a上有1mol  生成时,c极区溶液仍为中性 生成时,c极区溶液仍为中性 |
C.电极d的电极反应为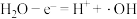 |
D.当电极b上有0.3mol  生成时,电极c、d两极共产生气体11.2L(标准状况) 生成时,电极c、d两极共产生气体11.2L(标准状况) |
您最近一年使用:0次
2024-03-22更新
|
594次组卷
|
5卷引用:2024届青海省百所名校高三下学期二模理科综合试题-高中化学
2024届青海省百所名校高三下学期二模理科综合试题-高中化学河南省新乡市2024届高三第二次模拟考试理综-化学试题吉林省部分名校2023-2024学年高二下学期期中联考化学试题湖南省衡阳市衡阳县第一中学2023-2024学年高三下学期4月月考化学试题(已下线)压轴题06?电化学原理综合分析(6大题型+方法总结+压轴题速练)-2024年高考化学压轴题专项训练(新高考通用)
解题方法
5 . 某团队报道了工作温度范围广( )的可充电氢氯电池,模拟装置如图所示。下列叙述正确的是
)的可充电氢氯电池,模拟装置如图所示。下列叙述正确的是
 )的可充电氢氯电池,模拟装置如图所示。下列叙述正确的是
)的可充电氢氯电池,模拟装置如图所示。下列叙述正确的是
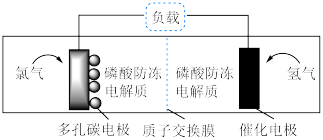
| A.放电时,多孔碳电极为负极 |
B.放电时,多孔碳电极附近电解质溶液中 减小 减小 |
C.充电时,多孔碳电极的电极反应式为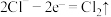 |
D.充电时,若有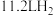 参与反应,则有 参与反应,则有 质子由质子交换膜左侧向右侧迁移 质子由质子交换膜左侧向右侧迁移 |
您最近一年使用:0次
6 . 某教授团队设计了具有Se空位的Ni3Se4电极,由此设计的某种电解池如图,在M电极可收集到NH3和少量H2,下列说法中错误的是


| A.N电极为阳极,发生氧化反应 |
B.M电极上的电极反应之一为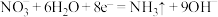 |
| C.若以铅蓄电池为电源,则M电极与Pb电极相连 |
| D.当电路中有0.4mol电子通过时,则生成的NH3在标准状况下的体积为1.12L |
您最近一年使用:0次
2023-09-09更新
|
140次组卷
|
4卷引用:青海省海东市名校2023-2024学年高三上学期9月联考化学试题
名校
7 . 某同学设计了一个燃料电池并探究氯碱工业原理和粗铜的精炼原理,装置如图所示。其中乙装置中X为阳离子交换膜。下列有关说法错误的是
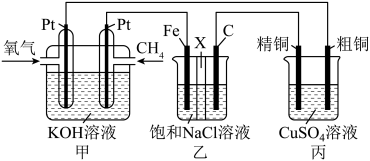

| A.通入O2的Pt极为正极,该电极反应式为O2-4e-+2H2O=4OH- |
| B.乙装置中铁电极为阴极,电极反应式为2H2O+2e-=H2↑+2OH- |
| C.反应一段时间后,乙装置中在铁电极区生成氢氧化钠溶液 |
| D.反应一段时间后,丙装置中硫酸铜溶液浓度可能减小 |
您最近一年使用:0次
2023-06-05更新
|
211次组卷
|
4卷引用:青海省西宁市大通县2023-2024学年高二上学期期末考试化学试题
名校
解题方法
8 . 电解质浓度不同形成的浓差电池,称为离子浓差电池。以浓差电池为电源,以石墨为电极将NH3转化为高纯H2的装置如图所示。下列说法正确的是
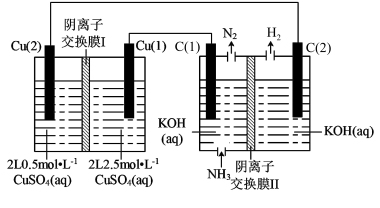

| A.Cu(1)的电势低于Cu(2)的电势 |
| B.C(1)极电极反应式为2NH3-6e-+6OH-=N2 +6H2O |
C.工作时,左池  从左侧经膜Ⅰ移向右侧,右池OH-从左侧经膜Ⅱ移向右侧 从左侧经膜Ⅰ移向右侧,右池OH-从左侧经膜Ⅱ移向右侧 |
| D.当浓差电池停止放电时,理论上可得到22.4L标准状况下的H2(忽略溶液体积变化) |
您最近一年使用:0次
2023-05-05更新
|
824次组卷
|
4卷引用:青海省玉树州2023届高三下学期第三次联考理综化学试题
青海省玉树州2023届高三下学期第三次联考理综化学试题(已下线)专题12 电化学的综合应用(已下线)专题10 电化学及其应用-2023年高考化学真题题源解密(全国通用)江苏省扬州中学2023-2024学年高二上学期10月月考化学试题
名校
9 . 银锌电池的总反应式:Zn+Ag2O+H2O=Zn(OH)2+2Ag。某学习小组以该电池为电源电解处理含Ba(OH)2的废水和含Ni2+、Cl-的酸性废水,并分别获得BaCl2溶液和单质镍。电解处理的工作原理如图所示。下列说法正确的是
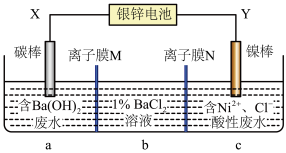

| A.X电极与银锌电池的Zn电极相连 |
| B.若去掉离子膜M,则X电极的反应式不变 |
| C.离子膜M为阳离子交换膜,离子膜N为阴离子交换膜 |
| D.电解过程中b室BaCl2浓度不变 |
您最近一年使用:0次
2023-02-17更新
|
283次组卷
|
3卷引用:青海省西宁市大通回族土族自治县2022-2023学年高三下学期开学摸底考试化学试题
解题方法
10 . 铜阳极泥是许多贵金属及硫(Te)的主要来源,某有色金属冶炼厂处理铜阳极泥得到的酸性分金液中主要含有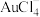 、
、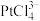 、
、 、
、 、
、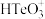 等离子,从该分金液中回收所有金属资源及硫的工艺流程如图所示:
等离子,从该分金液中回收所有金属资源及硫的工艺流程如图所示:
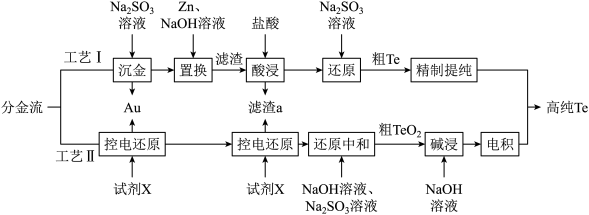
回答下列问题:
(1)Te元素的原子序数为52,则其在元素周期表中的位置为_______ 。
(2)“沉金”,时,发生反应的离子方程式为_______ 。
(3)“沉金”,及“控电还原”,所得Au中常含少量Ag。所以得Au制成的粗金板和纯金板作电极,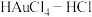 作电解液进行精炼时,粗金板表面因附着生成的AgCl发生钝化。可通过直流电叠加交流电进行不对称脉动电流电解,阳极上周期性出现正、负半周期。在正半周期,银发生极化形成钝化膜;在负半周期发生去极化,其电极反应式为
作电解液进行精炼时,粗金板表面因附着生成的AgCl发生钝化。可通过直流电叠加交流电进行不对称脉动电流电解,阳极上周期性出现正、负半周期。在正半周期,银发生极化形成钝化膜;在负半周期发生去极化,其电极反应式为_______ ;电解时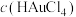 将
将_______ (填“增大”,“减小”,或“不变”)。
(4)滤渣a的主要成分为_______ (填化学式)。
(5)“控电还原”时,试剂X可选择 或
或 ,两者信息如下表所示。从价格上分析,最佳试剂为
,两者信息如下表所示。从价格上分析,最佳试剂为_______ (填化学式),按处理 年分金液的量计算,理论上每年可节约成本
年分金液的量计算,理论上每年可节约成本_______ 万元。
(6)“电积”时,阴极的电极反应式为____ ;“电积”后的电解液可用于工艺I的_____ 工序。
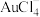 、
、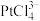 、
、 、
、 、
、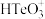 等离子,从该分金液中回收所有金属资源及硫的工艺流程如图所示:
等离子,从该分金液中回收所有金属资源及硫的工艺流程如图所示:
回答下列问题:
(1)Te元素的原子序数为52,则其在元素周期表中的位置为
(2)“沉金”,时,发生反应的离子方程式为
(3)“沉金”,及“控电还原”,所得Au中常含少量Ag。所以得Au制成的粗金板和纯金板作电极,
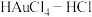 作电解液进行精炼时,粗金板表面因附着生成的AgCl发生钝化。可通过直流电叠加交流电进行不对称脉动电流电解,阳极上周期性出现正、负半周期。在正半周期,银发生极化形成钝化膜;在负半周期发生去极化,其电极反应式为
作电解液进行精炼时,粗金板表面因附着生成的AgCl发生钝化。可通过直流电叠加交流电进行不对称脉动电流电解,阳极上周期性出现正、负半周期。在正半周期,银发生极化形成钝化膜;在负半周期发生去极化,其电极反应式为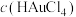 将
将(4)滤渣a的主要成分为
(5)“控电还原”时,试剂X可选择
 或
或 ,两者信息如下表所示。从价格上分析,最佳试剂为
,两者信息如下表所示。从价格上分析,最佳试剂为 年分金液的量计算,理论上每年可节约成本
年分金液的量计算,理论上每年可节约成本| 消耗物料 | 消耗量/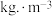 | 单价/元 |
 | 22.0 | 2.7 |
 | 13.0 | 4.2 |
您最近一年使用:0次



