解题方法
1 . Ⅰ.二氧化硫可用于“接触法制硫酸”,核心反应是2SO2+O2 2SO3,因SO2在催化剂表面与O2接触而得名,反应过程示意图如下:
2SO3,因SO2在催化剂表面与O2接触而得名,反应过程示意图如下:
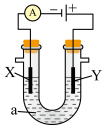
Ⅱ.也可以用电化学原理,使用SO2制备硫酸,同时精制粗铜,装置如图所示。电极为多孔的材料,能吸附气体,同时也能使气体与电解质溶液充分接触,质子交换膜只允许H+通过。___________ ,与___________ (填“精铜”或“粗铜”)连接;
(3)假设粗铜中含有铁、锌杂质,工作一段时间后CuSO4溶液中的Cu2+浓度___________ (填“不变”或“增大”“减小”)。
 2SO3,因SO2在催化剂表面与O2接触而得名,反应过程示意图如下:
2SO3,因SO2在催化剂表面与O2接触而得名,反应过程示意图如下: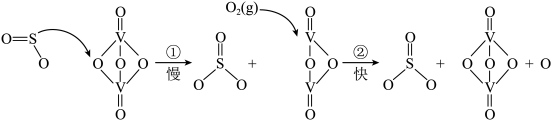
| A.SO2和SO3都属于酸性氧化物,通到BaCl2溶液中都会产生白色沉淀 |
| B.增大O2的浓度可以明显提高SO3的生成速率 |
| C.图示过程中既有V-O键的断裂又有V-O键的形成 |
| D.V2O5的作用是降低该反应的活化能,提高SO2的平衡转化率 |
Ⅱ.也可以用电化学原理,使用SO2制备硫酸,同时精制粗铜,装置如图所示。电极为多孔的材料,能吸附气体,同时也能使气体与电解质溶液充分接触,质子交换膜只允许H+通过。
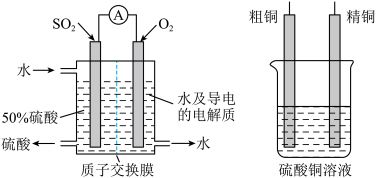
(3)假设粗铜中含有铁、锌杂质,工作一段时间后CuSO4溶液中的Cu2+浓度
您最近一年使用:0次
解题方法
2 . 以电池级碳酸锂为基础原料,可制备钴酸锂(LiCoO2)离子电池,之所以能够实现电能与化学能的互相转换,是通过锂离子与电子在正负极活性物质之间的嵌入和脱出实现的。 LiCoO2+6C(石墨),以下说法错误的是
LiCoO2+6C(石墨),以下说法错误的是
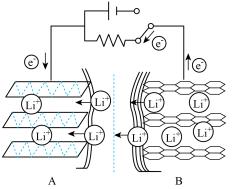
 LiCoO2+6C(石墨),以下说法错误的是
LiCoO2+6C(石墨),以下说法错误的是| A.放电时,正极的电极方程式是Li1-xCoO2+xLi++xe-=LiCoO2 |
| B.隔膜是正离子交换膜 |
| C.充电时,锂离子的移动方向是A→B |
| D.充电时,若转移1mole-,石墨电极将增重7xg |
您最近一年使用:0次
3 . 电解尿素( )是一种低能耗制氢气的方法,工作原理如图:
)是一种低能耗制氢气的方法,工作原理如图:
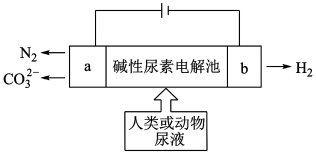
(1)溶液中 的移动方向为
的移动方向为___________ 。
A.a→b B.b→a
(2)写出b电极的电极方程式___________ 。
(3)已知尿素中C元素为+4价,一段时间后在a电极收集到标况下4.48L气体,则整个电路中转移的电子数为___________ 个。
(4)___________ 极的材料可用铁棒,
A.a B.b
且铁棒能够较长时间保持光亮不生锈,该防腐原理称为___________ 。
(5)若将电路中的电源换成导线,此时铁棒会逐渐被腐蚀,写出腐蚀过程中另一电极材料(石墨)上发生的电极方程式:___________ 。
(6)与铵态氮肥相比,写出施用尿素的两个优点:___________ 。
 )是一种低能耗制氢气的方法,工作原理如图:
)是一种低能耗制氢气的方法,工作原理如图:
(1)溶液中
 的移动方向为
的移动方向为A.a→b B.b→a
(2)写出b电极的电极方程式
(3)已知尿素中C元素为+4价,一段时间后在a电极收集到标况下4.48L气体,则整个电路中转移的电子数为
(4)
A.a B.b
且铁棒能够较长时间保持光亮不生锈,该防腐原理称为
(5)若将电路中的电源换成导线,此时铁棒会逐渐被腐蚀,写出腐蚀过程中另一电极材料(石墨)上发生的电极方程式:
(6)与铵态氮肥相比,写出施用尿素的两个优点:
您最近一年使用:0次
名校
解题方法
4 . Ⅰ.完成下列问题
(1)理论上不能设计为原电池的化学反应是___________ 。
a.
b.
c.
d.
(2) 电池比能量高,可用于汽车、航天等领域。电池反应式为:
电池比能量高,可用于汽车、航天等领域。电池反应式为: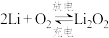 ,放电时,下列说法正确的是
,放电时,下列说法正确的是___________ 。
a.电能转化成化学能 b. 在正极发生氧化反应
在正极发生氧化反应
c.正离子由负极移向正极 d. 在负极失去电子
在负极失去电子
(3)下列关于金属腐蚀与防护的说法不正确的是___________ 。

a.图①,放置于干燥空气中的铁钉不易生锈
b.图②,若断开电源,钢闸门将发生吸氧腐蚀
c.图②,若将钢闸门与电源的正极相连,可防止钢闸门腐蚀
d.图③,若金属 比
比 活泼,可防止输水管腐蚀
活泼,可防止输水管腐蚀
Ⅱ.某实验小组为探究 与
与 能否发生氧化还原反应,设计如下双液原电池(盐桥中为饱和
能否发生氧化还原反应,设计如下双液原电池(盐桥中为饱和 溶液的琼脂)。
溶液的琼脂)。

(4)该装置石墨棒上发生的电极反应式为___________ ,盐桥中 向
向___________ 烧杯移动。(填“甲”或“乙”)
Ⅲ.某同学设计一个燃料电池(如图所示),目的是探究氯碱工业原理和粗铜的精炼原理,其中乙装置中X为阳离子交换膜。

根据要求回答相关问题:
(5)写出氢气所在电极的电极反应式___________ 。
(6)石墨电极为___________ (填“阳极”或“阴极”),反应一段时间后,在乙装置中滴入酚酞溶液,___________ (填“铁极”或“石墨极”)区的溶液先变红。
(7)如果粗铜中含有锌、银等杂质,丙装置中反应一段时间,硫酸铜溶液浓度将___________ (填“增大”“减小”或“不变”)。当甲装置消耗标准状况下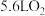 时,丙装置中纯铜电极增重
时,丙装置中纯铜电极增重___________ g。
(1)理论上不能设计为原电池的化学反应是
a.

b.

c.

d.

(2)
 电池比能量高,可用于汽车、航天等领域。电池反应式为:
电池比能量高,可用于汽车、航天等领域。电池反应式为: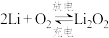 ,放电时,下列说法正确的是
,放电时,下列说法正确的是a.电能转化成化学能 b.
 在正极发生氧化反应
在正极发生氧化反应c.正离子由负极移向正极 d.
 在负极失去电子
在负极失去电子(3)下列关于金属腐蚀与防护的说法不正确的是

a.图①,放置于干燥空气中的铁钉不易生锈
b.图②,若断开电源,钢闸门将发生吸氧腐蚀
c.图②,若将钢闸门与电源的正极相连,可防止钢闸门腐蚀
d.图③,若金属
 比
比 活泼,可防止输水管腐蚀
活泼,可防止输水管腐蚀Ⅱ.某实验小组为探究
 与
与 能否发生氧化还原反应,设计如下双液原电池(盐桥中为饱和
能否发生氧化还原反应,设计如下双液原电池(盐桥中为饱和 溶液的琼脂)。
溶液的琼脂)。
(4)该装置石墨棒上发生的电极反应式为
 向
向Ⅲ.某同学设计一个燃料电池(如图所示),目的是探究氯碱工业原理和粗铜的精炼原理,其中乙装置中X为阳离子交换膜。

根据要求回答相关问题:
(5)写出氢气所在电极的电极反应式
(6)石墨电极为
(7)如果粗铜中含有锌、银等杂质,丙装置中反应一段时间,硫酸铜溶液浓度将
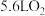 时,丙装置中纯铜电极增重
时,丙装置中纯铜电极增重
您最近一年使用:0次
名校
5 . 甲、乙两池电极材料都是铁棒与碳棒(如图)。请回答下列问题:

(1)若两池中均盛放CuSO4溶液,反应一段时间后:
①有红色物质析出的是:甲池中的___________ 棒;乙池中的___________ 棒。
②在乙池中阳极的电极反应式是___________ 。
(2)若两池中均盛放饱和NaCl溶液。
①写出甲池中正极的电极反应式___________ 。
②写出乙池中的总反应的离子方程式___________ 。
③据资料显示电解氯化钠稀溶液可制备“84消毒液”(主要成分为NaClO),通电时氯气被溶液完全吸收,若所得消毒液仅含一种溶质,写出该电解的化学方程式___________ 。

(1)若两池中均盛放CuSO4溶液,反应一段时间后:
①有红色物质析出的是:甲池中的
②在乙池中阳极的电极反应式是
(2)若两池中均盛放饱和NaCl溶液。
①写出甲池中正极的电极反应式
②写出乙池中的总反应的离子方程式
③据资料显示电解氯化钠稀溶液可制备“84消毒液”(主要成分为NaClO),通电时氯气被溶液完全吸收,若所得消毒液仅含一种溶质,写出该电解的化学方程式
您最近一年使用:0次
名校
解题方法
6 . 电化学在生活中的应用广泛,请根据电化学原理回答下列问题。
(1)如图中,电流表指针发生偏转,Zn作负极,则A电极上发生的电极反应式为___________ ;若A也为金属,则金属活动性Zn___________ A(填>,<或=)。反应进行一段时间后溶液酸性将___________ (填“增强”或“减弱”或“基本不变”)。

(2)C2H5OH可作为燃料使用,用C2H5OH和O2组合形成的质子交换膜燃料电池如下图。电池总反应为C2H5OH+3O2=3H2O+2CO2,则d电极是___________ (填“正极”或“负极”),c电极的电极反应式为___________ 。

(3)某原电池装置初始状态如下图所示,电池总反应为2Ag+Cl2=2AgCl。当电路中转移amole-时,交换膜左侧溶液中约减少___________ mol离子。交换膜右侧溶液中c(HCl)___________ (填“>”、“<”或“=”)lmol/L忽略溶液体积变化和Cl2溶于水)。

(4)如下图所示,以石墨为电极电解氯化钠溶液,X为___________ 极。实验开始时,同时在两边各滴入几滴酚酞溶液,则电解时在X极附近观察到的现象是___________ 。若将X电极材料换为Cu,则X电极上的电极反应式将___________ (填“发生变化”或“不变”)。向电解所得溶液中加入通入过量二氧化碳的离子方程式为:___________ 。
(1)如图中,电流表指针发生偏转,Zn作负极,则A电极上发生的电极反应式为

(2)C2H5OH可作为燃料使用,用C2H5OH和O2组合形成的质子交换膜燃料电池如下图。电池总反应为C2H5OH+3O2=3H2O+2CO2,则d电极是

(3)某原电池装置初始状态如下图所示,电池总反应为2Ag+Cl2=2AgCl。当电路中转移amole-时,交换膜左侧溶液中约减少

(4)如下图所示,以石墨为电极电解氯化钠溶液,X为

您最近一年使用:0次
名校
7 . Ⅰ.氢能的利用包括氢的制备、储存和应用三个环节。氢气制取是氢能利用经济性考量的重要环节。
(1)氯碱工业可获得纯度较高的副产物氢气;请写出“氯碱工业”对应离子方程式:___________ 。
(2)粒径在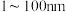 的纳米铝粉常温下能与水反应释氢;向水中加入下列物质,不能加快纳米铝粉释氢速率的是___________。
的纳米铝粉常温下能与水反应释氢;向水中加入下列物质,不能加快纳米铝粉释氢速率的是___________。
Ⅱ.甲烷重整是工业常用的制氢方法,包含水蒸气重整和氧化重整两种方法,原理如下:
水蒸气重整:

氧化重整:

(3)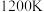 、
、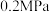 条件下进行水蒸气重整,起始
条件下进行水蒸气重整,起始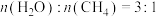 ,达到平衡时
,达到平衡时 的物质的量分数为0.3,
的物质的量分数为0.3, 的转化率为
的转化率为___________ 。
(4)理论上,按照甲烷、水蒸气、氧气体积比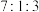 进料,可以将甲烷水蒸气重整和甲烷氧化重整两种方法结合,实现反应器中能量自给(不需要补充热量)。
进料,可以将甲烷水蒸气重整和甲烷氧化重整两种方法结合,实现反应器中能量自给(不需要补充热量)。
①甲烷氧化重整反应的焓变
___________ 。
②实际生产中,甲烷、水蒸气、氧气按约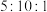 体积比进料。增加水蒸气有两个作用:一是
体积比进料。增加水蒸气有两个作用:一是___________ ,二是水蒸气还能发生___________ (用化学方程式表示)反应,从而获得更多的氢气。
Ⅲ.在新能源体系下,氢能被视为与电能互补的优质二次能源。氢燃料电池能量转换率远高于氢气直接燃烧。
(5)碱性氢氧燃料电池工作时,负极反应式为:___________ 。
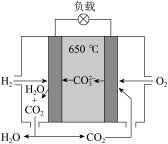
(6)氢氧熔融碳酸盐燃料电池是一种以熔融态碳酸盐为电解质的电池,其工作原理如图,有关该电池说法正确的是___________。
(1)氯碱工业可获得纯度较高的副产物氢气;请写出“氯碱工业”对应离子方程式:
(2)粒径在
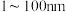 的纳米铝粉常温下能与水反应释氢;向水中加入下列物质,不能加快纳米铝粉释氢速率的是___________。
的纳米铝粉常温下能与水反应释氢;向水中加入下列物质,不能加快纳米铝粉释氢速率的是___________。A. | B. | C. | D. |
Ⅱ.甲烷重整是工业常用的制氢方法,包含水蒸气重整和氧化重整两种方法,原理如下:
水蒸气重整:


氧化重整:


(3)
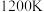 、
、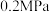 条件下进行水蒸气重整,起始
条件下进行水蒸气重整,起始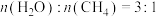 ,达到平衡时
,达到平衡时 的物质的量分数为0.3,
的物质的量分数为0.3, 的转化率为
的转化率为(4)理论上,按照甲烷、水蒸气、氧气体积比
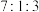 进料,可以将甲烷水蒸气重整和甲烷氧化重整两种方法结合,实现反应器中能量自给(不需要补充热量)。
进料,可以将甲烷水蒸气重整和甲烷氧化重整两种方法结合,实现反应器中能量自给(不需要补充热量)。①甲烷氧化重整反应的焓变

②实际生产中,甲烷、水蒸气、氧气按约
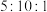 体积比进料。增加水蒸气有两个作用:一是
体积比进料。增加水蒸气有两个作用:一是Ⅲ.在新能源体系下,氢能被视为与电能互补的优质二次能源。氢燃料电池能量转换率远高于氢气直接燃烧。
(5)碱性氢氧燃料电池工作时,负极反应式为:
(6)氢氧熔融碳酸盐燃料电池是一种以熔融态碳酸盐为电解质的电池,其工作原理如图,有关该电池说法正确的是___________。

| A.电池工作时,熔融碳酸盐只起到导电的作用 |
B.该电池可利用工厂中排出的 ,减少温室气体的排放 ,减少温室气体的排放 |
| C.电子流向:氢电极-负载-氧电极-熔融碳酸盐-氢电极 |
D.电池工作时,外电路中流过 电子,消耗 电子,消耗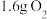 |
您最近一年使用:0次
名校
8 . 用 燃料电池连接成如下装置。
燃料电池连接成如下装置。
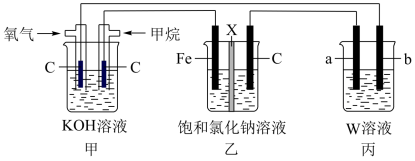
(1)乙池中X为阳离子交换膜,石墨电极(C)作______ 极,写出乙池总反应的离子方程式______ 。
(2)若将乙装置中两电极用导线直接相连,则铁发生______ 腐蚀,写出碳棒的电极反应式:______ 。若将乙装置中两电极连接电源的正负两极,铁连接电源的______ 极(填“正”或“负”)可防止铁腐蚀,该种防护方法叫______ 。
(3)若乙池中X为钠离子交换膜(只允许钠离子通过),则当甲池中消耗标准状况下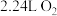 时,乙装置中阳极室溶液质量减少
时,乙装置中阳极室溶液质量减少______ 克。
(4)若丙中要实现铁上镀银,b电极材料为______ 。
 燃料电池连接成如下装置。
燃料电池连接成如下装置。
(1)乙池中X为阳离子交换膜,石墨电极(C)作
(2)若将乙装置中两电极用导线直接相连,则铁发生
(3)若乙池中X为钠离子交换膜(只允许钠离子通过),则当甲池中消耗标准状况下
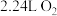 时,乙装置中阳极室溶液质量减少
时,乙装置中阳极室溶液质量减少(4)若丙中要实现铁上镀银,b电极材料为
您最近一年使用:0次
9 . 电化学原理在工农业生产中有重要应用。已知N2H4是一种重要的清洁高能燃料,根据如图所示装置完成(1)-(4)小题。(C1~C6均为石墨电极,假设各装置在工作过程中溶液体积不变):

(1)甲装置C2电极为______ 极(填“正”“负”“阳”或“阴”),C1电极上的电极反应式为______ 。
(2)若乙装置中溶液体积为400mL,开始时溶液pH为6,当电极上通过0.04mol电子时,溶液pH约为______ 。
(3)丙装置用于处理含高浓度硫酸钠的废水,同时获得硫酸、烧碱及氢气,膜X为______ 交换膜(填“正离子”“负离子”或“质子”),当电极上通过0.04mol电子时,中间硫酸钠废水的质量改变______ g(假定水分子不能通过膜X和膜Y)。
(4)电解一段时间后,丁装置的电解质溶液中能观察到的现象是______ ,丁装置中电解反应的总化学方程式为______ 。

(1)甲装置C2电极为
(2)若乙装置中溶液体积为400mL,开始时溶液pH为6,当电极上通过0.04mol电子时,溶液pH约为
(3)丙装置用于处理含高浓度硫酸钠的废水,同时获得硫酸、烧碱及氢气,膜X为
(4)电解一段时间后,丁装置的电解质溶液中能观察到的现象是
您最近一年使用:0次
名校
10 . 某同学设计了如下燃料电池,并探究氯碱工业原理的相关问题(其中乙装置中为正离子交换膜)。

(1)乙中石墨电极(C)作___________ 极。若丙中W为 溶液,且滴有酚酞,当实验开始后观察到的现象是
溶液,且滴有酚酞,当实验开始后观察到的现象是_______________________ 。
(2)若消耗2.24L(标况)氧气,则乙装置中铁电极上生成的气体体积(标况)为___________ L。
(3)若丙中以 溶液为电解质溶液进行粗铜(含Al、Zn、Ag、Pt、Au等杂质)的电解精炼,下列说法正确的是 。
溶液为电解质溶液进行粗铜(含Al、Zn、Ag、Pt、Au等杂质)的电解精炼,下列说法正确的是 。
(4)若丙中以稀 为电解质溶液,电极材料b为铝,则能使铝表面生成一层致密的氧化膜。则该电极反应式为
为电解质溶液,电极材料b为铝,则能使铝表面生成一层致密的氧化膜。则该电极反应式为___________________ 。
(5)假设乙装置中氯化钠溶液足够多,且装置中X为正离子交换膜,则反应后左侧溶液质量将___________ (填“增大”“减小”或“不变”)。

(1)乙中石墨电极(C)作
 溶液,且滴有酚酞,当实验开始后观察到的现象是
溶液,且滴有酚酞,当实验开始后观察到的现象是(2)若消耗2.24L(标况)氧气,则乙装置中铁电极上生成的气体体积(标况)为
(3)若丙中以
 溶液为电解质溶液进行粗铜(含Al、Zn、Ag、Pt、Au等杂质)的电解精炼,下列说法正确的是 。
溶液为电解质溶液进行粗铜(含Al、Zn、Ag、Pt、Au等杂质)的电解精炼,下列说法正确的是 。| A.b电极为粗铜 | B.粗铜接电源正极,发生还原反应 |
C. 溶液的浓度保持不变 溶液的浓度保持不变 | D.利用阳极泥可回收Ag、Pt、Au等金属 |
(4)若丙中以稀
 为电解质溶液,电极材料b为铝,则能使铝表面生成一层致密的氧化膜。则该电极反应式为
为电解质溶液,电极材料b为铝,则能使铝表面生成一层致密的氧化膜。则该电极反应式为(5)假设乙装置中氯化钠溶液足够多,且装置中X为正离子交换膜,则反应后左侧溶液质量将
您最近一年使用:0次



