名校
1 . 如图为元素周期表的一部分,列出了前四周期10种主族元素在周期表中的位置。
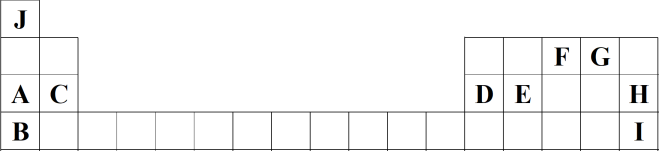
请回答下列问题:
(1)元素E的原子结构示意图为___________ ,I在元素周期表中的位置为___________ ,C与I形成的化合物的电子式为___________ 。
(2)G与J形成原子数之比为 的化合物P,P是日常生活中最常见的物质,P分子的结构式为
的化合物P,P是日常生活中最常见的物质,P分子的结构式为___________ ,空间构型为___________ ;元素K与G同主族且位于G的下一周期,P的沸点比元素K的氢化物的沸点高,原因是___________ 。
(3)已知木炭可在G的单质中完全燃烧形成化合物Q,用电子式表示Q的形成过程:___________ 。
(4)元素D的最高价氧化物对应的水化物与氢氧化钠反应的离子方程式为___________ 。
(5)J、F、G、K可以形成原子个数之比为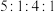 的化合物M,M的化学式为
的化合物M,M的化学式为___________ ;M中含有的化学键类型为___________ 。
(6)下图是依据各种元素(原子或离子)的性质对比关系而绘制出来的,其中描述正确的是___________。

请回答下列问题:
(1)元素E的原子结构示意图为
(2)G与J形成原子数之比为
 的化合物P,P是日常生活中最常见的物质,P分子的结构式为
的化合物P,P是日常生活中最常见的物质,P分子的结构式为(3)已知木炭可在G的单质中完全燃烧形成化合物Q,用电子式表示Q的形成过程:
(4)元素D的最高价氧化物对应的水化物与氢氧化钠反应的离子方程式为
(5)J、F、G、K可以形成原子个数之比为
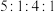 的化合物M,M的化学式为
的化合物M,M的化学式为(6)下图是依据各种元素(原子或离子)的性质对比关系而绘制出来的,其中描述正确的是___________。
A.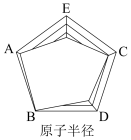 | B.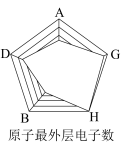 | C.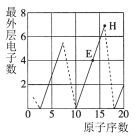 | D.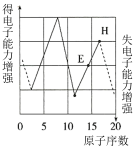 |
您最近一年使用:0次
21-22高一上·湖南怀化·期末
2 . 下表是元素周期表的一部分。表中所列字母分别代表一种元素。
回答下列问题:
(1)j在元素周期表中的位置是______ 。
(2)e、h、m形成的简单离子其半径由大到小的顺序为________ 。(填写离子符号)
(3)n与g形成的化合物为______ (填写化学式,下同),将该化合物进行焰色反应,火焰呈______ 色。
(4)k、1形成的最高价氧化物的水化物,酸性由强到弱的顺序为______ 。
(5)g的最高价氧化物对应的水化物与i的最高价氧化物对应的水化物反应的离子方程式为______ 。
(6)某同学欲探究元素性质递变规律与原子结构的关系,进行如下实验:
(实验操作)取已除去氧化膜且面积相等的镁条和铝条,分别投入2mL1mol/L盐酸中;
(实验现象)镁与酸反应比铝更剧烈;
(实验结论)①金属性:Mg_____ Al(选填“>”或“<”);
(查阅资料)原子半径(nm)Mg:0.160 Al:0.143;
(思考)②利用元素周期律对上述实验结论进行解释______ 。
| a | b | |||||||
| c | d | e | f | |||||
| g | h | i | j | k | l | m | ||
| n |
(1)j在元素周期表中的位置是
(2)e、h、m形成的简单离子其半径由大到小的顺序为
(3)n与g形成的化合物为
(4)k、1形成的最高价氧化物的水化物,酸性由强到弱的顺序为
(5)g的最高价氧化物对应的水化物与i的最高价氧化物对应的水化物反应的离子方程式为
(6)某同学欲探究元素性质递变规律与原子结构的关系,进行如下实验:
(实验操作)取已除去氧化膜且面积相等的镁条和铝条,分别投入2mL1mol/L盐酸中;
(实验现象)镁与酸反应比铝更剧烈;
(实验结论)①金属性:Mg
(查阅资料)原子半径(nm)Mg:0.160 Al:0.143;
(思考)②利用元素周期律对上述实验结论进行解释
您最近一年使用:0次
2022-01-14更新
|
783次组卷
|
4卷引用:第四章 物质结构 元素周期律(B卷)-2021-2022学年高一化学优选好题单元专题双测卷(人教版2019必修第一册)
(已下线)第四章 物质结构 元素周期律(B卷)-2021-2022学年高一化学优选好题单元专题双测卷(人教版2019必修第一册)湖南省怀化市2021-2022学年高一上学期期末考试化学试题湖北省孝感市新高考联考协作体2022-2023学年高二上学期9月联考化学试题(已下线)【2023】【高一下】【其他】【杭高卷四-期中复习卷】【高中化学】【刘尼尼收集】



