名校
1 . A、B、C、D、E五种原子序数均小于18的元素,且原子序数依次增大,其中B与C的电子层数相同,D与E的电子层数相同,A与D的最外层电子数相同,C与E的最外层电子数相同,E元素的原子最外层电子数是电子层数的2倍,D与其他具有相同电子层数的原子相比半径最大。又知由B元素组成的单质是空气中的主要成分。
(1)B的元素名称是_______ ,该元素的原子结构示意图为_______ ,核外有___ 个未成对电子,用电子式表示B的简单氢化物的形成过程_________ 。
(2)C、D、E三种元素形成的简单离子的半径由大到小的顺序是________ (用离子符号表示)。
(3)请在以上五种元素中任意选择几种元素,画出由这几种元素组成的离子化合物的电子式(画出1种即可)_____ 。
(4)以下说法正确的是________ 。
①B的氧化物均为酸性氧化物
②A和C形成的化合物中既可能存在极性共价键,也可能存在非极性共价键
③由A、B、C形成的化合物中不可能存在离子键
④D2E的熔沸点较高,硬度较大
(1)B的元素名称是
(2)C、D、E三种元素形成的简单离子的半径由大到小的顺序是
(3)请在以上五种元素中任意选择几种元素,画出由这几种元素组成的离子化合物的电子式(画出1种即可)
(4)以下说法正确的是
①B的氧化物均为酸性氧化物
②A和C形成的化合物中既可能存在极性共价键,也可能存在非极性共价键
③由A、B、C形成的化合物中不可能存在离子键
④D2E的熔沸点较高,硬度较大
您最近一年使用:0次
2024-01-21更新
|
131次组卷
|
2卷引用:上海市宜川中学2023-2024学年高三上学期期末考试化学试题
名校
解题方法
2 . 四种短周期元素的性质或结构信息如表。请根据信息回答下列问题。
(1)写出A元素在周期表中的位置___________ ;元素B与C形成的化合物的电子式___________ ;D元素形成的单质的结构式___________ 。
(2)比较上述各元素形成的离子的半径大小___________ (用离子符号表示)。
(3)C的一种氧化物可做潜艇中的供氧剂,写出该氧化物与 反应的方程式
反应的方程式___________ 。
(4)A、C两元素金属性较强的是(写元素符号)___________ ;试举一个实例证明该结论___________ ;请从原子结构角度解释这两种元素金属性强弱关系___________ 。
(5)写出B的最高价氧化物对应水化物与D的气态氢化物反应的离子反应方程式___________ 。
| 元素 | A | B | C | D |
| 性质结构信息 | 地壳中含量最多的金属元素;其氧化物具有两性。 | 单质为淡黄色固体;一种单质相对分子质量为256,易溶于 。 。 | 原子半径是短周期主族元素中最大。 | 其氧化物是汽车尾气的主要有害成分之一;该元素的气态氢化物的水溶液呈碱性。 |
(2)比较上述各元素形成的离子的半径大小
(3)C的一种氧化物可做潜艇中的供氧剂,写出该氧化物与
 反应的方程式
反应的方程式(4)A、C两元素金属性较强的是(写元素符号)
(5)写出B的最高价氧化物对应水化物与D的气态氢化物反应的离子反应方程式
您最近一年使用:0次
名校
解题方法
3 . 随原子序数递增,八种短周期元素(用字母x等表示)原子半径的相对大小、最高正价或最低负价的变化如下图所示。
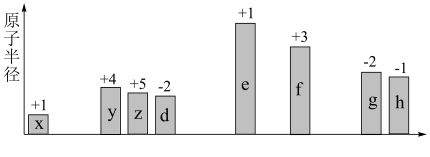
根据判断出的元素回答问题:
(1)f在周期表中的位置是_______ 。
(2)x、d、e三种元素的原子可构成一种碱性物质,该物质的电子式是_______ 。
(3)比较d、e常见离子的半径由大到小顺序是:_______ 。
(4)d、g非金属性较强的是_______ ,写一条能加以证明的化学方程式:_______ 。

根据判断出的元素回答问题:
(1)f在周期表中的位置是
(2)x、d、e三种元素的原子可构成一种碱性物质,该物质的电子式是
(3)比较d、e常见离子的半径由大到小顺序是:
(4)d、g非金属性较强的是
您最近一年使用:0次
名校
4 . 下表是元素周期表的一部分,请参照元素①—⑥的位置回答下列问题:

(1)元素①的一种核素中,含有 1 个质子和 1 个中子,表示该核素组成的符号是_______ 。
(2)⑤的原子结构示意图是_______ 。
(3)上述元素中,原子半径最大的是_______ (写元素符号)。
(4)下列说法正确的是_______ (填序号)。
a.②、③组成的化合物只有一种
b.②的气态氢化物稳定性高于⑤
c.⑥在化合物中呈现的最高化合价为+7 价
(5)金属性: ③_______ ④( 填“>”或“<”),列举一条能证明该结论的实验事实:____ 。
(6)写出⑤的最高价氧化物对应水化物与Cu反应的化学方程式_______ 。写出⑥的单质置换出溴单质反应的离子方程式_______ 。

(1)元素①的一种核素中,含有 1 个质子和 1 个中子,表示该核素组成的符号是
(2)⑤的原子结构示意图是
(3)上述元素中,原子半径最大的是
(4)下列说法正确的是
a.②、③组成的化合物只有一种
b.②的气态氢化物稳定性高于⑤
c.⑥在化合物中呈现的最高化合价为+7 价
(5)金属性: ③
(6)写出⑤的最高价氧化物对应水化物与Cu反应的化学方程式
您最近一年使用:0次
5 . 已知A、B、C、D、E、F、G是七种原子序数依次增大的短周期元素,它们的原子结构特征或有关物质的性质等如下表所示。
完成下列问题:
(1)元素F在元素周期表中的位置是_______ 。这七种元素中,不属于主族元素的元素的名称是_______ 。
(2)在E、F、G三种元素中,原子半径最小的是_______ (填元素符号),其离子的电子式是_______ 。
(3)元素A与G可形成化合物AG4,在该化合物中含有的化学键类型为_______ ,分子的空间结构为_______ 。A与氧元素可形成化合物AO2,该化合物分子的结构式为_______ 。
(4)元素B能与氢元素形成化合物BH3,在通常状况下,BH3的水溶液呈_______ (填“酸”、“碱”或“中”)性,原因为_______ (用方程式表示)。B和G的气态氢化物相互反应的化学方程式为_______ 。
| 元素 | 原子结构特征或有关物质的性质 |
| A | 原子的最外层电子数是其内层电子数的2倍 |
| B | 其单质是空气中含量最多的物质 |
| C | 原子的最外层电子数是其电子层数的4倍 |
| D | 位于第IIA族,其原子半径比E的大 |
| E | 是金属元素,其氧化物和氢氧化物都有两性,且与D在同一周期 |
| F | 原子序数16,其单质在通常状况下为固体 |
| G | 原子的最外层电子数比其次外层电子数少1个 |
(1)元素F在元素周期表中的位置是
(2)在E、F、G三种元素中,原子半径最小的是
(3)元素A与G可形成化合物AG4,在该化合物中含有的化学键类型为
(4)元素B能与氢元素形成化合物BH3,在通常状况下,BH3的水溶液呈
您最近一年使用:0次
名校
解题方法
6 . 短周期主族元素W、X、Y、Z的原子序数依次增大,四种元素形成的某种化合物(如图所示)是一种优良的防龋齿剂(用于制含氟牙膏),其中Z元素的内层电子数之和为最外层电子数的2倍。下列说法错误的是
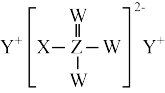
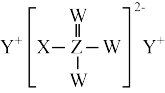
| A.Z的最高价氧化物对应的水化物为弱酸 | B.W、Y形成的化合物在熔融状态下能够导电 |
| C.X、Y形成的化合物为强电解质 | D.X、W、Z对应的单质熔沸点:X>W>Z |
您最近一年使用:0次
名校
7 . 已知X、Y、Z、W、M均为短周期主族元素。25℃时,各元素最高价氧化物对应水化物溶液(浓度均为0.01mol/L)的pH和原子半径的关系见下图。下列判断错误的是


| A.非金属性:W>Z | B.最高正价:Y<Z |
| C.单质熔点:X<Y | D.简单离子半径:X>M |
您最近一年使用:0次
2020-12-29更新
|
312次组卷
|
3卷引用:上海市黄浦区格致中学2020-2021学年高二上学期期末化学试题
名校
解题方法
8 . Q、R、X、Y、Z的电子层数均不大于3,且核电核数依次增大;Q+离子中只有质子,Z+离子的最内层电子数是最外层的 ;R、X、Y三种元素的原子核外电子层数相同,R某种单质的熔点很高;Y原子的最外层电子数是电子层数的3倍。
;R、X、Y三种元素的原子核外电子层数相同,R某种单质的熔点很高;Y原子的最外层电子数是电子层数的3倍。
(1)X的元素符号为_______ ,Z+离子的结构示意图为_____ 。
(2)Q与R、X、Y形成的化合物中,属于非极性分子的是______ (填分子式),其分子的空间形状为_______ 。
(3)Q2Y的稳定性比H2S_______ (填“大”“小”),说明理由_______ 。
 ;R、X、Y三种元素的原子核外电子层数相同,R某种单质的熔点很高;Y原子的最外层电子数是电子层数的3倍。
;R、X、Y三种元素的原子核外电子层数相同,R某种单质的熔点很高;Y原子的最外层电子数是电子层数的3倍。(1)X的元素符号为
(2)Q与R、X、Y形成的化合物中,属于非极性分子的是
(3)Q2Y的稳定性比H2S
您最近一年使用:0次
名校
解题方法
9 . 有四种短周期元素,它们的结构、性质等信息如下表所述:
完成下列填空:
(1)A的原子结构示意图是________ 。
(2)元素B在周期表中的位置是_______ ;从原子结构角度分析比较A和B的金属性强弱:_____ 。
(3)单质C的结构式是______ ,其化学性质稳定的原因是________ 。
(4)A、B的最高价氧化物对应的水化物相互反应的离子方程式为______ 。
(5)C、D的氢化物相互反应后,将产物溶于水,水溶液呈______ 性(选填“酸”、“碱”或“中”),将溶液中所有离子的浓度由大到小排序:_____ 。
| 元素 | 结构、性质等信息 |
| A | 是短周期中(除稀有气体外)原子半径最大的元素,该元素的某种合金是原子反应堆的导热剂 |
| B | 与A同周期,其最高价氧化物的水化物呈两性 |
| C | 元素的气态氢化物极易溶于水,可用作制冷剂 |
| D | 是海水中除氢、氧元素外含量最多的元素,其单质或化合物是自来水生产过程中常用的消毒杀菌剂 |
(1)A的原子结构示意图是
(2)元素B在周期表中的位置是
(3)单质C的结构式是
(4)A、B的最高价氧化物对应的水化物相互反应的离子方程式为
(5)C、D的氢化物相互反应后,将产物溶于水,水溶液呈
您最近一年使用:0次
2020-08-17更新
|
118次组卷
|
2卷引用:上海市金山中学2019-2020学年高一上学期期末考试化学试题
10-11高三上·上海嘉定·期末
10 . A、B、M、X、Y、Z是短周期元素,且原子序数依次增大。已知它们的部分化合物的性质如下:
(1)M原子核外电子占据的轨道有______ 个,B的最简氢化物的电子式:_____________
(2)M、X、Z三种元素简单离子的半径由大到小的顺序是:__________________ (用离子符号和“﹥”表示)
(3) B的最简氢化物与Z的氢化物相遇时现象为__________________________
(4)推测A和Y组成的化合物的熔点是______________ (填“高“或“低”),理由是______________________________________________________________ 。
(5)A元素的氢化物有多种,1molA的某种氢化物分子中含有14mol电子。已知在常温常压下1g该氢化物在足量氧气中充分燃烧生成液态水时放出的热量为50KJ,请写出该反应的热化学方程式:_______________________________________________________ 。
| A的最简氢化物 | B的最简氢化物 | M的最简氢化物 | X的氧化物 | Y的最简氢化物分子构型 | Z的最高价氧化物 |
| 含氢量最高的有机物 | 水溶液呈碱性 | 水溶液呈酸性 | 两性氧化物 | 正四面体 | 对应水化物为最强酸 |
(2)M、X、Z三种元素简单离子的半径由大到小的顺序是:
(3) B的最简氢化物与Z的氢化物相遇时现象为
(4)推测A和Y组成的化合物的熔点是
(5)A元素的氢化物有多种,1molA的某种氢化物分子中含有14mol电子。已知在常温常压下1g该氢化物在足量氧气中充分燃烧生成液态水时放出的热量为50KJ,请写出该反应的热化学方程式:
您最近一年使用:0次



