名校
1 . A、B、C、D、E、F 均为短周期元素,且原子序数依次增大,A 是原子半径最小的元素,B 的最高价氧化物的水化物可与其氢化物反应形成盐类物质甲;A 与 D 可以按照原子个数比 4∶1 形成化合物乙,且乙分子中含有 18 个电子,E 与 B 同主族,C 的阳离子与 F 的阴离子相差一个电子层,且可形成离子个数比为 2∶1 的离子化合物丙。
(1)E 在周期表中的位置为_________ 。
(2)下列说法正确的有_____ 。
①化合物乙分子中只含有极性共价键
②C、D、E、F 原子半径由大到小的顺序为 C>D>E>F
③B、E 形成的氢化物中,B 的氢化物更稳定,沸点也最高
④化合物甲和化合物丙都既含有离子键也含有共价键
(3)将 F 燃烧的产物通入 BaCl2和 HNO3的混合溶液中,生成白色沉淀并放出无色气体, 请用一个离子方程式表示该反应________
(4)写出一个由以上元素构成的 10 电子与 18 电子分子反应的化学方程式______
(5)A 与 B 可形成一种二元化合物 X,其中 A 元素质量分数为 2.33%.据研究 X 显弱酸性。X 电离的阴离子结构与二氧化碳相似,则该阴离子的电子式为_____
(6)F 的某种氧化物是大气污染物之一,也是某工业生产中的主要尾气之一。某校兴趣小组欲采用下列方案测定此工业尾气中的 F 的氧化物的含量。
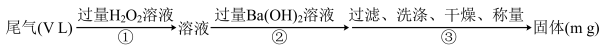
通过的尾气体积为 VL(已换算成标准状况)时,该尾气中 F 的氧化物含量(体积分数)为____ (用含有 V、m 的代数式表示)
(1)E 在周期表中的位置为
(2)下列说法正确的有
①化合物乙分子中只含有极性共价键
②C、D、E、F 原子半径由大到小的顺序为 C>D>E>F
③B、E 形成的氢化物中,B 的氢化物更稳定,沸点也最高
④化合物甲和化合物丙都既含有离子键也含有共价键
(3)将 F 燃烧的产物通入 BaCl2和 HNO3的混合溶液中,生成白色沉淀并放出无色气体, 请用一个离子方程式表示该反应
(4)写出一个由以上元素构成的 10 电子与 18 电子分子反应的化学方程式
(5)A 与 B 可形成一种二元化合物 X,其中 A 元素质量分数为 2.33%.据研究 X 显弱酸性。X 电离的阴离子结构与二氧化碳相似,则该阴离子的电子式为
(6)F 的某种氧化物是大气污染物之一,也是某工业生产中的主要尾气之一。某校兴趣小组欲采用下列方案测定此工业尾气中的 F 的氧化物的含量。
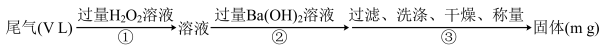
通过的尾气体积为 VL(已换算成标准状况)时,该尾气中 F 的氧化物含量(体积分数)为

您最近一年使用:0次
9-10高一下·福建福州·期末
2 . X、Y、Z、W、Q是原子序数依次增大的短周期主族元素,X、W在周期表中的相对位置如下表;X元素最低负化合价的绝对值与其原子最外层电子数相等;Z是地壳中含量最多的金属元素。
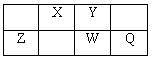
(1)元素Q在周期表中位于第_____ 族,Z的离子结构示意图为_____ 。
(2)Z、W、Q的原子半径由大到小的顺序为___________ 。(用元素符号表示其原子)。
(3)X和氢组成的化合物分子中有6个原子,其结构简式为______ ,写出该物质与水加成的化学方程式________________ 。
(4)Y的最简单气态氢化物甲的水溶液显碱性
①用电离方程式表示氢化物甲的水溶液中的显碱性的原因___________ ,
②在微电子工业中,甲的水溶液可作刻蚀剂H2O2的清除剂,所发生反应的产物不污染环境,其化学方程式为_______________________ 。该反应的氧化剂是____________ 当有1mol甲参加反应时,电子转移_____ mol。
(5)Q和Y形成的一种二元化合物具有色温效应,其相对分子质量在170~190之间,且Q的质量分数约为69.6%,则该化合物的分子式为_______ 。

(1)元素Q在周期表中位于第
(2)Z、W、Q的原子半径由大到小的顺序为
(3)X和氢组成的化合物分子中有6个原子,其结构简式为
(4)Y的最简单气态氢化物甲的水溶液显碱性
①用电离方程式表示氢化物甲的水溶液中的显碱性的原因
②在微电子工业中,甲的水溶液可作刻蚀剂H2O2的清除剂,所发生反应的产物不污染环境,其化学方程式为
(5)Q和Y形成的一种二元化合物具有色温效应,其相对分子质量在170~190之间,且Q的质量分数约为69.6%,则该化合物的分子式为
您最近一年使用:0次
解题方法
3 . 短周期主族元素W、X、Y、Z、Q原子序数依次增大,W原子没有中子,X元素为地壳中含量最多的元素,Y、Z、Q同周期,且Y、Z、Q最外层电子数之和为14,Y与W同主族,X与Z同主族,Q的单质是黄绿色气体,下列结论不正确的是
| A.原子半径大小顺序为:Y>Z>Q>X>W |
| B.X、Y形成的化合物中一定有离子键,可能还有共价键 |
| C.简单氢化物的稳定性:X>Z |
| D.氧化物对应的水化物酸性:Z<Q |
您最近一年使用:0次
解题方法
4 . 根据提供条件推断元素,并按要求填空:
(1)原子核外有3个电子层,其最外层电子数为7,最高价氧化物化学式____ ,最高价氧化物对应水化物化学式____ ,其单质与氢气反应的化学方程式为____ 。
(2)第三周期元素,其最外层电子数与电子层数相同。该元素最高价氧化物的化学式____ ,最高价氧化物对应水化物与氢氧化钠溶液反应的化学方程式为____ 。
(3)原子序数依次递增的同周期4种元素,它们氢化物的质子数与电子数都与Ar相同,这些氢化物的化学式分别为____ 、____ 、____ 、____ 。
(4)某元素的最高正价与最低负价的代数和为4,且最高价氧化物中含氧元素质量分数为60%。则该元素最高价氧化物的化学式为____ 。
(1)原子核外有3个电子层,其最外层电子数为7,最高价氧化物化学式
(2)第三周期元素,其最外层电子数与电子层数相同。该元素最高价氧化物的化学式
(3)原子序数依次递增的同周期4种元素,它们氢化物的质子数与电子数都与Ar相同,这些氢化物的化学式分别为
(4)某元素的最高正价与最低负价的代数和为4,且最高价氧化物中含氧元素质量分数为60%。则该元素最高价氧化物的化学式为
您最近一年使用:0次
2021高一·全国·专题练习
5 . 有A、B、C、D、E五种元素,它们的原子序数按E、C、D、A、B依次增大,E原子最外层有4个电子,A-和B+的核外电子排布相同,D的氢化物的化学式为H2D,D的最高价氧化物中D的质量分数为40%,且D原子核内质子数和中子数相等,C的原子序数比D少9,比B少12,其气态氢化物中氢的质量分数为17.65%。
(1)写出这五种元素的元素符号:
A___________ 、B___________ 、C___________ 、D___________ 、E___________ 。
(2)画出A-、B+的结构示意图___________ 、___________
(3)写出E的最高价氧化物与过量的B的最高价氧化物对应水化物反应的离子方程式:______ 。
(1)写出这五种元素的元素符号:
A
(2)画出A-、B+的结构示意图
(3)写出E的最高价氧化物与过量的B的最高价氧化物对应水化物反应的离子方程式:
您最近一年使用:0次
解题方法
6 . 有A、B、C、D四种元素,它们的核电荷数依次增大,已知:
①A原子最外层电子数是次外层电子数的两倍,D原子M层上的电子比K层多5个。
②B的阴离子与跟氖原子的电子层结构相同,0℃、101.3kPa时B可形成B2气体,经测定0.2mol B2气体为6.4g.
③C与B构成的CB2中,C的质量分数为50%,在C原子核中,质子数与中子数相同。
回答:
(1)写出A元素的名称是______ 、B的元素符号是____ .
(2)写出下列微粒的结构示意图或电子式:
①A的原子结构示意图_________ ;②B的阴离子的电子式_________ ;
③C的离子的结构示意图__________ ;④D的阴离子的电子式__________ 。
①A原子最外层电子数是次外层电子数的两倍,D原子M层上的电子比K层多5个。
②B的阴离子与跟氖原子的电子层结构相同,0℃、101.3kPa时B可形成B2气体,经测定0.2mol B2气体为6.4g.
③C与B构成的CB2中,C的质量分数为50%,在C原子核中,质子数与中子数相同。
回答:
(1)写出A元素的名称是
(2)写出下列微粒的结构示意图或电子式:
①A的原子结构示意图
③C的离子的结构示意图
您最近一年使用:0次
2020-11-17更新
|
101次组卷
|
2卷引用:上海市部分重点高中2020-2021学年高一上学期10月阶段性测试化学试题
名校
7 . X、Y、Z、W是原子序数依次增大的四种短周期元素,X是非金属性最强的元素,Y是地壳中含量最高的金属元素,Z原子的核外电子数是X最外层电子数的2倍,W的单质是制作黑火药的原料之一, 下列结论正确的是
| A.工业上通过电解法获取Y的单质 |
| B.简单氢化物的沸点: X<W |
| C.简单离子半径大小: X>Y>W |
| D.最高价氧化物水化物的酸性: Z>W |
您最近一年使用:0次
8 . 根据提供条件推断元素,并按要求填空:
(1)原子核外有3个电子层,其最外层电子数为7,最高价氧化物化学式________ ,最高价氧化物对应水化物化学式______ ,其最高价氧化物对应水化物与NaOH反应的化学方程式为_________ 。
(2)第三周期元素,其最外层电子数与电子层数相同。该元素最高价氧化物的化学式为________ ,最高价氧化物对应水化物与氢氧化钠反应的化学方程式为_______ 。
(3)原子序数依次递增的同周期4种元素,它们氢化物的质子数与电子数都与Ar相同,这些氢化物的化学式分别为____________ 、__________ 、_________ 、______ 。
(4)某元素的最高正价与最低负价的代数和为4,且最高价氧化物中含氧元素质量分数为60%。则该元素最高价氧化物的化学式为__________ ,该氧化物属________ (填“离子”或“共价”)化合物。
(1)原子核外有3个电子层,其最外层电子数为7,最高价氧化物化学式
(2)第三周期元素,其最外层电子数与电子层数相同。该元素最高价氧化物的化学式为
(3)原子序数依次递增的同周期4种元素,它们氢化物的质子数与电子数都与Ar相同,这些氢化物的化学式分别为
(4)某元素的最高正价与最低负价的代数和为4,且最高价氧化物中含氧元素质量分数为60%。则该元素最高价氧化物的化学式为
您最近一年使用:0次
2020-04-01更新
|
39次组卷
|
2卷引用:江西省赣州市南康区2019-2020学年第二学期线上教学检测试高一化学试卷
名校
解题方法
9 . 短周期主族元素A,B,C,D,E,F的原子序数依次增大,它们的原子核外电子层数之和为13。B原子的最外层电子数是次外层电子数的2倍,C,D是空气中含量最多的两种元素,D,E两种元素的单质反应可以生成两种不同的离子化合物;F为同周期半径最小的元素。试回答以下问题:
(1)D在周期表中的位置是___ ,写出实验室制备单质F的离子方程式___ 。
(2)化合物甲、乙由A、B、D、E中的三种或四种组成,且甲、乙的水溶液均呈碱性。则甲、乙反应的离子方程式为:___ 。
(3)由C,D,E,F形成的简单离子的离子半径由大到小的顺序是__ (用元素离子符号表示)。
(4)元素B和F的非金属性强弱,B的非金属性___ 于F(填“强”或“弱”),并用化学方程式证明上述结论__ 。
II.以CA3代替氢气研发燃料电池是当前科研的一个热点。
(5)CA3燃料电池使用的电解质溶液是2mol/L的KOH溶液,电池反应为: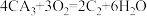 .该电池负极的电极反应式为
.该电池负极的电极反应式为___ ;每消耗3.4gCA3转移的电子数目为___ 。
(1)D在周期表中的位置是
(2)化合物甲、乙由A、B、D、E中的三种或四种组成,且甲、乙的水溶液均呈碱性。则甲、乙反应的离子方程式为:
(3)由C,D,E,F形成的简单离子的离子半径由大到小的顺序是
(4)元素B和F的非金属性强弱,B的非金属性
II.以CA3代替氢气研发燃料电池是当前科研的一个热点。
(5)CA3燃料电池使用的电解质溶液是2mol/L的KOH溶液,电池反应为:
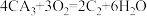 .该电池负极的电极反应式为
.该电池负极的电极反应式为
您最近一年使用:0次
2021-05-27更新
|
252次组卷
|
2卷引用:黑龙江省大庆市铁人中学2020-2021学年高一下学期期中考试化学试题
10 . 现有A、B、C、D、E、F六种短周期元素,其相关性质信息如下。请回答下列问题:
(1)元素D在元素周期表中的位置为_______ ,其原子的结构示意图为_______ 。
(2)A、C、D对应的简单离子的半径由大到小的排序是_______ (用离子符号表示)。
(3)B的最简单氢化物的稳定性_______ (填“>”、“<”或“=”) 的稳定性。
的稳定性。
(4) 溶液中存在的化学键类型有
溶液中存在的化学键类型有_______ (填“离子键”、“共价键”或“离子键和共价键”)。A的最高价氧化物的水化物与 溶液反应的离子方程式为
溶液反应的离子方程式为_______ 。
(5)用电子式表示化合物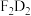 的形成过程
的形成过程_______ 。
(6)已知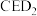 是一种强氧化性漂白剂,它在碱性环境中稳定存在。在碱性条件下,
是一种强氧化性漂白剂,它在碱性环境中稳定存在。在碱性条件下,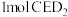 和
和 恰好完全反应,该反应的离子方程式为
恰好完全反应,该反应的离子方程式为_______ 。
| 元素 | 特征 | 元素 | 特征 |
| A | 常见金属,其最高价氧化物对应的水化物可以溶于强碱 | D | 在地壳中含量最多 |
| B | 常见化肥的主要元素,单质常温下呈气态 | E | 单质为黄绿色有毒气体 |
| C | 在短周期主族元素中,原子半径最大 | F | 原子的核外电子只有1个 |
(2)A、C、D对应的简单离子的半径由大到小的排序是
(3)B的最简单氢化物的稳定性
 的稳定性。
的稳定性。(4)
 溶液中存在的化学键类型有
溶液中存在的化学键类型有 溶液反应的离子方程式为
溶液反应的离子方程式为(5)用电子式表示化合物
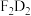 的形成过程
的形成过程(6)已知
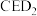 是一种强氧化性漂白剂,它在碱性环境中稳定存在。在碱性条件下,
是一种强氧化性漂白剂,它在碱性环境中稳定存在。在碱性条件下,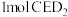 和
和 恰好完全反应,该反应的离子方程式为
恰好完全反应,该反应的离子方程式为
您最近一年使用:0次



