解题方法
1 . 下列有关物质的性质与用途具有对应关系的是
A. 能溶于水,可用于制备 能溶于水,可用于制备 | B. 受热易分解,可用来制造抗酸药物 受热易分解,可用来制造抗酸药物 |
C.浓硫酸具有脱水性,可用于干燥 | D.铁粉能与 反应,可用作食品保存的脱氧剂 反应,可用作食品保存的脱氧剂 |
您最近一年使用:0次
名校
解题方法
2 . 下表列出了3种燃煤烟气脱硫方法的原理。
(1)如果不对燃煤烟气脱硫,易形成硫酸型酸雨,酸雨一般指的是pH小于___________ 的降雨。
(2)方法Ⅰ中氨水吸收燃煤烟气中 的化学反应为:
的化学反应为: 、
、___________ 。
(3)能提高燃煤烟气中 去除率的措施有___________(只有一个选项符合题意,填字母)。
去除率的措施有___________(只有一个选项符合题意,填字母)。
(4)采用方法Ⅰ脱硫,并不需要预先除去燃煤烟气中大量的 ,原因是
,原因是___________ (用离子方程式表示)。
(5)方法Ⅱ中CO将 还原为S时,自身转化为
还原为S时,自身转化为___________ (填化学式)。
(6)对方法Ⅲ 吸收 后的溶液加热可使吸收液再生,其反应属于基本反应类型中的
后的溶液加热可使吸收液再生,其反应属于基本反应类型中的___________ 反应。
(7)下图所示的是验证二氧化硫性质的微型实验,a、b、c、d是浸有相关溶液的棉球。将浓硫酸滴入装有亚硫酸钠固体的培养皿中。关于此实验的“现象”“解释或结论”以及对应关系均正确的是___________。
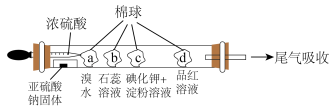
| 方法Ⅰ | 用氨水将 转化为 转化为 ,再氧化成 ,再氧化成 |
| 方法Ⅱ | 用生物质热解气(主要成分CO、 、 、 )将 )将 在高温下还原成单质硫 在高温下还原成单质硫 |
| 方法Ⅲ | 用 溶液吸收 溶液吸收 ,再经电解转化为 ,再经电解转化为 |
(2)方法Ⅰ中氨水吸收燃煤烟气中
 的化学反应为:
的化学反应为: 、
、(3)能提高燃煤烟气中
 去除率的措施有___________(只有一个选项符合题意,填字母)。
去除率的措施有___________(只有一个选项符合题意,填字母)。| A.增大氨水浓度 | B.升高反应温度 |
| C.使燃煤烟气快速通过氨水 | D.通入空气使 转化为 转化为 |
 ,原因是
,原因是(5)方法Ⅱ中CO将
 还原为S时,自身转化为
还原为S时,自身转化为(6)对方法Ⅲ 吸收
 后的溶液加热可使吸收液再生,其反应属于基本反应类型中的
后的溶液加热可使吸收液再生,其反应属于基本反应类型中的(7)下图所示的是验证二氧化硫性质的微型实验,a、b、c、d是浸有相关溶液的棉球。将浓硫酸滴入装有亚硫酸钠固体的培养皿中。关于此实验的“现象”“解释或结论”以及对应关系均正确的是___________。

| 选项 | 现象 | 解释或结论 |
| A | a处黄色褪去 | 非金属性:Br>S |
| B | b处变为红色 |  与水反应生成酸性物质 与水反应生成酸性物质 |
| C | c处变为蓝色 |  具有一定的氧化性 具有一定的氧化性 |
| D | d处红色先褪去后恢复 |  具有漂白性且漂白性不稳定 具有漂白性且漂白性不稳定 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
解题方法
3 . 下图是元素①~⑤在元素周期表中的位置。
(1)⑤在周期表中的位置是第_______ 周期第_______ 族,其最高价氧化物对应的水化物与②的最高价氧化物对应的水化物反应的离子方程式是_______ 。
(2)③的一种核素的中子数是9,表示该核素的符号是_______ 。
(3)非金属性:④_______ ⑤(填“>”或“<”),从原子结构角度解释其原因:_______ 。
(4)②、⑤两种元素形成的化合物有重要的用途,用电子式表示它的形成过程_______ 。
(5)下列关于①的说法正确的是_______ (填字母)。
a.原子结构示意图为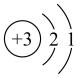
b.其单质可以和水反应生成
c.在同主族的元素中,①的金属性最强
(6)为研究②单质(X)的性质,进行如下实验:
下列说法中,正确的是_______(填字母)。
| ① | ③ | ④ | |||||
| ② | ⑤ | ||||||
(1)⑤在周期表中的位置是第
(2)③的一种核素的中子数是9,表示该核素的符号是
(3)非金属性:④
(4)②、⑤两种元素形成的化合物有重要的用途,用电子式表示它的形成过程
(5)下列关于①的说法正确的是
a.原子结构示意图为

b.其单质可以和水反应生成

c.在同主族的元素中,①的金属性最强
(6)为研究②单质(X)的性质,进行如下实验:
| 实验 | ||
| 装置 | 液体a | 现象 |
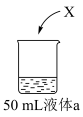 | 蒸馏水 | Ⅰ.X浮在液面上,剧烈反应,产生少量白雾 |
 盐酸 盐酸 | Ⅱ.X浮在液面上,反应比Ⅰ中剧烈,产生白雾 | |
| 浓盐酸 | Ⅲ.X浮在液面上,反应比Ⅰ中缓慢,产生大量白雾,烧杯底部有白色固体 | |
| A.Ⅰ中现象说明X与水反应放热 |
B.Ⅱ中反应的离子方程式为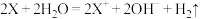 |
| C.Ⅲ中白雾比Ⅱ中多,说明Ⅲ中反应放热比Ⅱ中更多 |
D.推测Ⅲ中反应缓慢可能与 以及生成的白色固体有关 以及生成的白色固体有关 |
您最近一年使用:0次
解题方法
4 . 卤族元素的单质及其化合物有重要的用途。实验室用以下装置制取氯气,并探究相关物质的化学性质。
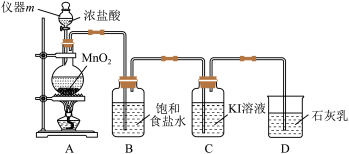
(1)仪器m的名称是___________ ,制取 的离子方程式为
的离子方程式为___________ ,HCl的下列性质中,由氯元素表现出来的性质是___________ 。
a.酸性 b.氧化性 c.还原性 d.挥发性
(2)装置B的作用是除去混在 中的
中的___________ 杂质。
(3)尾气处理装置D可模拟制备___________ (填一种化工产品的名称)。
(4)①实验开始后,装置C中的溶液迅速出现棕色。此时,若生成 物质的量为
物质的量为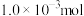 ,则理论上装置A中发生反应的HCl有
,则理论上装置A中发生反应的HCl有___________ mol。
②继续通气一段时间,装置C溶液先变深棕褐色,后变浅,当褪至无色时立即结束实验。据文献报道,碘元素生成碘酸( ,中强酸),
,中强酸), 和
和 在溶液中反应生成碘酸的化学方程式为:
在溶液中反应生成碘酸的化学方程式为:___________ 。某小组设计实验探究碘酸的一种化学性质,请补全实验方案(见如表)。
限选试剂: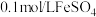 溶液(浸有铁粉)、
溶液(浸有铁粉)、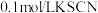 溶液、石蕊试液、
溶液、石蕊试液、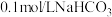 ;溶液、
;溶液、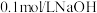 溶液。
溶液。

(1)仪器m的名称是
 的离子方程式为
的离子方程式为a.酸性 b.氧化性 c.还原性 d.挥发性
(2)装置B的作用是除去混在
 中的
中的(3)尾气处理装置D可模拟制备
(4)①实验开始后,装置C中的溶液迅速出现棕色。此时,若生成
 物质的量为
物质的量为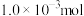 ,则理论上装置A中发生反应的HCl有
,则理论上装置A中发生反应的HCl有②继续通气一段时间,装置C溶液先变深棕褐色,后变浅,当褪至无色时立即结束实验。据文献报道,碘元素生成碘酸(
 ,中强酸),
,中强酸), 和
和 在溶液中反应生成碘酸的化学方程式为:
在溶液中反应生成碘酸的化学方程式为:限选试剂:
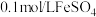 溶液(浸有铁粉)、
溶液(浸有铁粉)、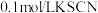 溶液、石蕊试液、
溶液、石蕊试液、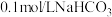 ;溶液、
;溶液、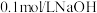 溶液。
溶液。| 操作 | 预期现象 | 结论 |
实验结束后,取少量装置C的溶液到试管中,除去过剩 和HClO后, 和HClO后, |
您最近一年使用:0次
2023-04-11更新
|
231次组卷
|
2卷引用:广东省广州市第四中学2022-2023学年高一上学期期末考试化学试题
5 .  是一种常见试剂,在实验室、工业生产上有广泛用途。
是一种常见试剂,在实验室、工业生产上有广泛用途。
I. 不稳定、易分解,
不稳定、易分解,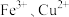 等对其分解起催化作用,为比较
等对其分解起催化作用,为比较 和
和 对
对 分解的催化效果,某化学研究小组同学分别设计了如图甲、乙两种实验装置。
分解的催化效果,某化学研究小组同学分别设计了如图甲、乙两种实验装置。
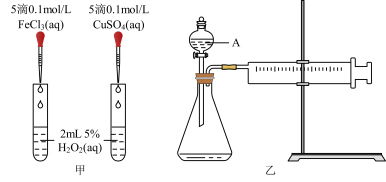
(1)若利用图甲装置,可通过观察___________ 现象,从而定性比较得出结论。
(2)有同学提出将 改为
改为___________  更为合理,其理由是
更为合理,其理由是___________ 。
(3)若利用乙实验可进行定量分析,实验时均以生成 气体为准,其他可能影响实验的因素均已忽略,实验中还需要测量的数据是
气体为准,其他可能影响实验的因素均已忽略,实验中还需要测量的数据是___________ 。
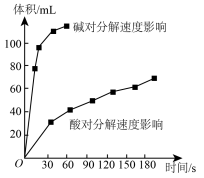
(4)如图为某小组研究的酸、碱对 分解的影响。该小组提出可以用
分解的影响。该小组提出可以用 固体与
固体与 溶液反应制
溶液反应制 ,反应的化学方程式为
,反应的化学方程式为___________ ,支持这一方案的理由是___________ 。
Ⅱ.实验室用 快速制氧气,其分解速率受多种因素影响。实验测得
快速制氧气,其分解速率受多种因素影响。实验测得 时不同条件下
时不同条件下 浓度随时间的变化如甲、乙、丙、丁四图所示:
浓度随时间的变化如甲、乙、丙、丁四图所示:
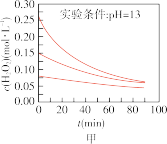
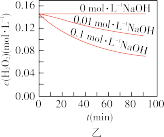

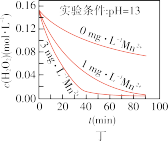
(5)下列说法正确的是:___________(填字母序号)
(6)催化剂 在反应中,改变了
在反应中,改变了___________ (填字母序号)
A.反应速率 B.反应限度 C.反应焓变 D.反应路径 E.反应活化能 F.活化分子百分数
 是一种常见试剂,在实验室、工业生产上有广泛用途。
是一种常见试剂,在实验室、工业生产上有广泛用途。I.
 不稳定、易分解,
不稳定、易分解,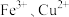 等对其分解起催化作用,为比较
等对其分解起催化作用,为比较 和
和 对
对 分解的催化效果,某化学研究小组同学分别设计了如图甲、乙两种实验装置。
分解的催化效果,某化学研究小组同学分别设计了如图甲、乙两种实验装置。
(1)若利用图甲装置,可通过观察
(2)有同学提出将
 改为
改为 更为合理,其理由是
更为合理,其理由是(3)若利用乙实验可进行定量分析,实验时均以生成
 气体为准,其他可能影响实验的因素均已忽略,实验中还需要测量的数据是
气体为准,其他可能影响实验的因素均已忽略,实验中还需要测量的数据是(4)如图为某小组研究的酸、碱对
 分解的影响。该小组提出可以用
分解的影响。该小组提出可以用 固体与
固体与 溶液反应制
溶液反应制 ,反应的化学方程式为
,反应的化学方程式为
Ⅱ.实验室用
 快速制氧气,其分解速率受多种因素影响。实验测得
快速制氧气,其分解速率受多种因素影响。实验测得 时不同条件下
时不同条件下 浓度随时间的变化如甲、乙、丙、丁四图所示:
浓度随时间的变化如甲、乙、丙、丁四图所示:



(5)下列说法正确的是:___________(填字母序号)
A.图甲表明,其他条件相同时, 浓度越小,其分解越慢 浓度越小,其分解越慢 |
B.图乙表明,其他条件相同时,溶液碱性越弱, 分解越快 分解越快 |
C.图丙表明,少量 存在时,溶液碱性越强, 存在时,溶液碱性越强, 分解越快 分解越快 |
D.图丁表明,碱性溶液中, 浓度越大,对 浓度越大,对 分解速率的影响越大 分解速率的影响越大 |
 在反应中,改变了
在反应中,改变了A.反应速率 B.反应限度 C.反应焓变 D.反应路径 E.反应活化能 F.活化分子百分数
您最近一年使用:0次
6 .  用途广泛,某兴趣小组探究其性质。
用途广泛,某兴趣小组探究其性质。_______ ,该装置内制取 的化学方程式为
的化学方程式为_______ 。
(2)欲用以上装置验证 的氧化性、还原性和漂白性,F中应盛放的试剂是_______。
的氧化性、还原性和漂白性,F中应盛放的试剂是_______。
(3)NaOH溶液的作用是_______ 。
(4)该小组同学对品红溶液褪色的原因进一步探究。
提出猜想:导致品红溶液褪色的原因是 、
、 、
、 、
、 中的一种或几种粒子与品红发生了反应。
中的一种或几种粒子与品红发生了反应。
实验设计及测定数据:
相同条件下, 与品红反应的速率比
与品红反应的速率比 快得多,则①的操作为
快得多,则①的操作为_______ 。
实验结论:通过以上实验,证明了品红溶液褪色_______  直接所致(填“是”、“不是”),亚硫酸电离产生的
直接所致(填“是”、“不是”),亚硫酸电离产生的 、
、 能使品红溶液褪色。
能使品红溶液褪色。
(5)国家规定葡萄酒中 的最大含量为
的最大含量为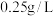 。该兴趣小组测某白葡萄酒中
。该兴趣小组测某白葡萄酒中 含量:测得100mL白葡萄酒,与
含量:测得100mL白葡萄酒,与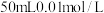 碘水恰好反应,则该葡萄酒中
碘水恰好反应,则该葡萄酒中 的含量为
的含量为_______ g/L(已知 )。若用酸性
)。若用酸性 溶液测定,测量结果会明显偏大,原因是
溶液测定,测量结果会明显偏大,原因是 溶液除了与
溶液除了与 反应,还会与葡萄酒中的
反应,还会与葡萄酒中的_______ 发生反应。
 用途广泛,某兴趣小组探究其性质。
用途广泛,某兴趣小组探究其性质。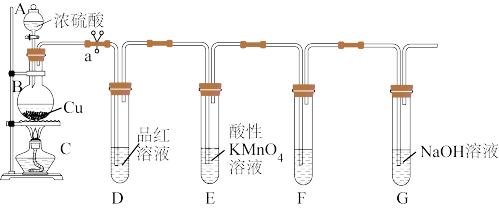
 的化学方程式为
的化学方程式为(2)欲用以上装置验证
 的氧化性、还原性和漂白性,F中应盛放的试剂是_______。
的氧化性、还原性和漂白性,F中应盛放的试剂是_______。| A.碘水 | B.石蕊溶液 | C. 溶液 溶液 | D.饱和NaCl溶液 |
(4)该小组同学对品红溶液褪色的原因进一步探究。
提出猜想:导致品红溶液褪色的原因是
 、
、 、
、 、
、 中的一种或几种粒子与品红发生了反应。
中的一种或几种粒子与品红发生了反应。实验设计及测定数据:
| 编号 | 操作 | 品红褪色需要的时间 |
| 1 | 向品红的乙醇溶液中通入 | 30min仍未褪色 |
| 2 | 向5mL饱和 溶液( 溶液( 约为 约为 )中加入2mL品红溶液 )中加入2mL品红溶液 | 2min开始褪色,4min完全褪色 |
| 3 | 向 的 的 溶液中加入2mL品红溶液 溶液中加入2mL品红溶液 | 约2min完全褪色 |
| 4 | ① |
 与品红反应的速率比
与品红反应的速率比 快得多,则①的操作为
快得多,则①的操作为实验结论:通过以上实验,证明了品红溶液褪色
 直接所致(填“是”、“不是”),亚硫酸电离产生的
直接所致(填“是”、“不是”),亚硫酸电离产生的 、
、 能使品红溶液褪色。
能使品红溶液褪色。(5)国家规定葡萄酒中
 的最大含量为
的最大含量为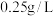 。该兴趣小组测某白葡萄酒中
。该兴趣小组测某白葡萄酒中 含量:测得100mL白葡萄酒,与
含量:测得100mL白葡萄酒,与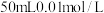 碘水恰好反应,则该葡萄酒中
碘水恰好反应,则该葡萄酒中 的含量为
的含量为 )。若用酸性
)。若用酸性 溶液测定,测量结果会明显偏大,原因是
溶液测定,测量结果会明显偏大,原因是 溶液除了与
溶液除了与 反应,还会与葡萄酒中的
反应,还会与葡萄酒中的
您最近一年使用:0次
2022-07-05更新
|
353次组卷
|
2卷引用:广东省东莞市2021-2022学年高一下学期期末教学质量检查化学试题
7 . 氯元素是非常重要的非金属元素,某化学活动社团为了探究氯气的制法、性质和用途,设计了如下实验装置。请按要求回答问题:
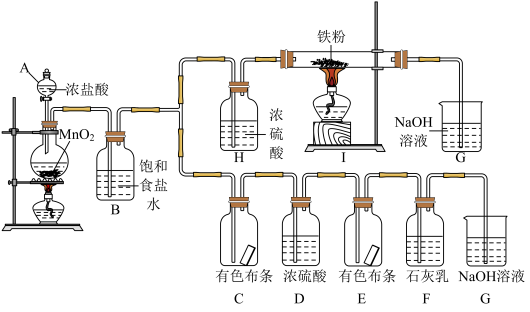
(1)仪器A的名称为_______ ,氯气的颜色_______ ,B中饱和食盐水的作用是_______ ,H中使用浓硫酸的目的是_______ 。
(2)写出在I中发生反应的化学方程式_______ ,G中发生反应的离子方程式_______ 。
(3)C中有色布条_______ (填“褪色”或“不褪色”),氯气通入F中可实现工业制取_______ 。

(1)仪器A的名称为
(2)写出在I中发生反应的化学方程式
(3)C中有色布条
您最近一年使用:0次
解题方法
8 . 绿矾是含有一定量结晶水的硫酸亚铁,在工农业生产中具有重要的用途。某化学兴趣小组对绿矾的一些性质进行探究.请回答下列问题:
(1)取一定量绿矾配制成 溶液,若绿矾失去部分结晶水,会导致配制的溶液浓度
溶液,若绿矾失去部分结晶水,会导致配制的溶液浓度_______ (填“偏大”“偏小”或“不变”)
(2)甲组同学取2mL绿矾溶液,加入几滴新制氯水,再加入1滴KSCN溶液,溶液变红,说明 可将
可将 氧化;绿矾溶液与新制氯水反应的离子方程式为
氧化;绿矾溶液与新制氯水反应的离子方程式为_______
(3)乙组同学认为甲组同学的实验不够严谨,该组同学在2mL绿矾溶液中先加入0.5mL煤油,再于液面下依次加入几滴新制氯水和1滴KSCN溶液,溶液变红,煤油的作用是_______
(4)硫酸亚铁加热至高温会分解,生成三种氧化物。为探究硫酸亚铁的分解产物,将无水硫酸亚铁装入反应管A并连接如图所示的装置,打开 和
和 ,缓缓通入
,缓缓通入 ,加热.实验后反应管A中残留的固体为红色粉末
,加热.实验后反应管A中残留的固体为红色粉末
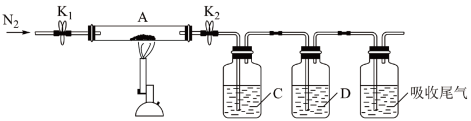
①装置C、D中的溶液依次为_______ 、_______ (填标号)。装置C、D可观察到的实验现象分别为_______ 、_______
a.品红 b.NaOH c. d.
d. e.浓硫酸
e.浓硫酸
②写出硫酸亚铁高温分解的化学方程式_______
(1)取一定量绿矾配制成
 溶液,若绿矾失去部分结晶水,会导致配制的溶液浓度
溶液,若绿矾失去部分结晶水,会导致配制的溶液浓度(2)甲组同学取2mL绿矾溶液,加入几滴新制氯水,再加入1滴KSCN溶液,溶液变红,说明
 可将
可将 氧化;绿矾溶液与新制氯水反应的离子方程式为
氧化;绿矾溶液与新制氯水反应的离子方程式为(3)乙组同学认为甲组同学的实验不够严谨,该组同学在2mL绿矾溶液中先加入0.5mL煤油,再于液面下依次加入几滴新制氯水和1滴KSCN溶液,溶液变红,煤油的作用是
(4)硫酸亚铁加热至高温会分解,生成三种氧化物。为探究硫酸亚铁的分解产物,将无水硫酸亚铁装入反应管A并连接如图所示的装置,打开
 和
和 ,缓缓通入
,缓缓通入 ,加热.实验后反应管A中残留的固体为红色粉末
,加热.实验后反应管A中残留的固体为红色粉末
①装置C、D中的溶液依次为
a.品红 b.NaOH c.
 d.
d. e.浓硫酸
e.浓硫酸②写出硫酸亚铁高温分解的化学方程式
您最近一年使用:0次
9 . 工业上氯气用途非常广泛,回答下列问题:
(1)实验室制取氯气的化学方程式为__________________ 。
(2)下表是某同学研究氯水性质实验片断的活动记录。
(3)防止氯气污染空气,实验室常用NaOH溶液来吸收尾气,写出离子方程式__________________ 。
(4)验证氯元素的非金属性比硫元素的非金属性强。某同学设计实验如右图所示:

①装置A中盛放的试剂是______ 装置A中发生反应的离子方程式为__________________ 。
a. 溶液 b.
溶液 b. 溶液 c.
溶液 c. 溶液
溶液
②下列不能用于说明氯元素比硫元素非金属性强的依据是______ 。(填序号)
a.HCl酸性强于
b.HCl稳定性强于
c. 可以氧化S生成
可以氧化S生成
(5)若装置A中加入淀粉碘化钾溶液,通入少量氯气后,观察到装置A中溶液______ ,即可证明非金属性:Cl>I。从原子结构角度解释原因:同主族元素从上到下_______ 。
(6)右下图是用强光照射密闭广口瓶中新制氯水时,用数字化传感器采集的图象,下列纵坐标代表的物理量与图象相符的是______ 。

a.溶液颜色的变化 b.瓶中氧气的体积分数
c.溶液的导电能力 d.溶液的漂白能力
(1)实验室制取氯气的化学方程式为
(2)下表是某同学研究氯水性质实验片断的活动记录。
实验内容 | 实验现象 | 解释原因(文字或反应) |
| 观察氯水颜色 | ① | 氯水中含有氯气分子 |
向氯水中滴入 溶液 溶液 | 有无色气体生成 | ② |
| 用玻璃棒蘸取氯水,点在品红试纸上 | 红色褪去 | ③ |
(4)验证氯元素的非金属性比硫元素的非金属性强。某同学设计实验如右图所示:

①装置A中盛放的试剂是
a.
 溶液 b.
溶液 b. 溶液 c.
溶液 c. 溶液
溶液②下列不能用于说明氯元素比硫元素非金属性强的依据是
a.HCl酸性强于

b.HCl稳定性强于

c.
 可以氧化S生成
可以氧化S生成
(5)若装置A中加入淀粉碘化钾溶液,通入少量氯气后,观察到装置A中溶液
(6)右下图是用强光照射密闭广口瓶中新制氯水时,用数字化传感器采集的图象,下列纵坐标代表的物理量与图象相符的是

a.溶液颜色的变化 b.瓶中氧气的体积分数
c.溶液的导电能力 d.溶液的漂白能力
您最近一年使用:0次
2022-09-06更新
|
444次组卷
|
3卷引用:天津市河西区2021-2022学年高一上学期期末质量调查化学试题
天津市河西区2021-2022学年高一上学期期末质量调查化学试题天津市河西区微山路中学2022-2023学年高一上学期期末考试化学试题(已下线)专题09 元素周期律-【好题汇编】备战2023-2024学年高一化学上学期期末真题分类汇编(天津专用)
解题方法
10 . “分类”是一种思想方法,利用分类对物质性质进行探究是科学探究的重要方法,某学习兴趣小组为探究物质的性质向实验室提供了如下实验试剂清单:
利用上述试剂,小组同学完成以下实验,回答下列问题:
(1)生活中常作为食品抗氧化剂的是___________ (填序号);常温下,实验室用②和④制备 ,选择②而不选择①的原因
,选择②而不选择①的原因___________ 。
(2)纳米级碳酸钙在造纸业中有重要用途,查阅资料后,小组同学采用将 和
和 混合通入⑤中的方法制备,证明所得分散系中的碳酸钙为纳米级碳酸钙的操作方法是
混合通入⑤中的方法制备,证明所得分散系中的碳酸钙为纳米级碳酸钙的操作方法是___________ 。
(3)实验中需用⑦配制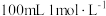 烧碱溶液,下列操作不正确的是___________。
烧碱溶液,下列操作不正确的是___________。
(4)取适量⑨于试管中,滴入少量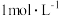 烧碱溶液,反应的现象为
烧碱溶液,反应的现象为___________ ;试剂⑨保存不当易变质,证明⑨是否完全变质可选择的试剂为___________ (填试剂序号)
| 组别 | 一 | 二 | 三 | 四 |
| 试剂及编号 | ①铁粉 | ④浓硝酸 | ⑤澄清石灰水 | ⑧酸性 溶液 溶液 |
| ②铜粉 | ⑥氨水 | ⑨ 溶液 溶液 | ||
| ③氯水 | ⑦ 固体 固体 | ⑩ 溶液 溶液 |
(1)生活中常作为食品抗氧化剂的是
 ,选择②而不选择①的原因
,选择②而不选择①的原因(2)纳米级碳酸钙在造纸业中有重要用途,查阅资料后,小组同学采用将
 和
和 混合通入⑤中的方法制备,证明所得分散系中的碳酸钙为纳米级碳酸钙的操作方法是
混合通入⑤中的方法制备,证明所得分散系中的碳酸钙为纳米级碳酸钙的操作方法是(3)实验中需用⑦配制
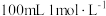 烧碱溶液,下列操作不正确的是___________。
烧碱溶液,下列操作不正确的是___________。A.用托盘天平在滤纸上称量 固体 固体 |
| B.将固体溶解后,溶液冷却至室温转移到容量瓶中 |
| C.转移溶液时,玻璃棒下端紧贴容量瓶刻线下内壁 |
| D.定容时用玻璃棒引流加入蒸馏水至凹液面最低端与刻线相平齐 |
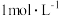 烧碱溶液,反应的现象为
烧碱溶液,反应的现象为
您最近一年使用:0次



