1 . 硫代硫酸钠( Na2S2O3)俗称海波,广泛应用于照相定影及纺织业等领域。某实验小组制备硫代硫酸钠并探究其性质。
Ⅰ.硫代硫酸钠的制备
实验小组设计如下装置制备硫代硫酸钠

信息:Na2S2O3,中S元素的化合价分别为-2和+6
(1)仪器a的名称是___________ 。B中发生的化学反应方程式为___________ (该反应理论上钠元素的利用率为100%)。
Ⅱ.产品纯度的测定
①溶液配制:准确称取该硫代硫酸钠样品8. 000 g,配制成50. 00 mL溶液。
②滴定:向锥形瓶中加入20. 00 mL 0.10 mol·L-1KIO3溶液,加入过量KI溶液和H2SO4溶液,然后加入淀粉作指示剂,用硫代硫酸钠样品溶液滴定碘单质,发生反应: I2+2 =2I-+
=2I-+ 
(2)生成碘单质的离子方程式为___________ 。滴定终点现象为___________ , 消耗样品溶液25. 00 mL,则样品纯度为___________ %。
Ⅲ.硫代硫酸钠性质的探究
①取Na2S2O3晶体,溶解,配成0. 20 mol·L-1溶液。
②取4mL溶液,向其中加入1.0mL饱和氯水(pH=2.4),溶液立即出现浑浊,经检验浑浊物为S。
实验小组研究S产生的原因,提出了以下假设:
假设1:氧化剂氧化:Cl2、HClO等含氯的氧化性微粒氧化了-2价硫元素。
假设2:___________ ( 不考虑空气中氧气氧化)。

设计实验方案:
(3)假设2是___________ 。
(4)第②组实验中胶头滴管加入的试剂是___________ 。
(5)依据现象,S产生的主要原因是___________ 。
(6)结合Ⅱ、Ⅲ分析纯度较低的原因是___________ 。
Ⅰ.硫代硫酸钠的制备
实验小组设计如下装置制备硫代硫酸钠

信息:Na2S2O3,中S元素的化合价分别为-2和+6
(1)仪器a的名称是
Ⅱ.产品纯度的测定
①溶液配制:准确称取该硫代硫酸钠样品8. 000 g,配制成50. 00 mL溶液。
②滴定:向锥形瓶中加入20. 00 mL 0.10 mol·L-1KIO3溶液,加入过量KI溶液和H2SO4溶液,然后加入淀粉作指示剂,用硫代硫酸钠样品溶液滴定碘单质,发生反应: I2+2
 =2I-+
=2I-+ 
(2)生成碘单质的离子方程式为
Ⅲ.硫代硫酸钠性质的探究
①取Na2S2O3晶体,溶解,配成0. 20 mol·L-1溶液。
②取4mL溶液,向其中加入1.0mL饱和氯水(pH=2.4),溶液立即出现浑浊,经检验浑浊物为S。
实验小组研究S产生的原因,提出了以下假设:
假设1:氧化剂氧化:Cl2、HClO等含氯的氧化性微粒氧化了-2价硫元素。
假设2:___________ ( 不考虑空气中氧气氧化)。

设计实验方案:
| 胶头滴管 | 现象 | |
| 第①组 | 1.0 mL饱和氯水 | 立即出现浑浊 |
| 第②组 | ___________ | 一段时间后出现浑浊,且浑浊度比①组小 |
(4)第②组实验中胶头滴管加入的试剂是
(5)依据现象,S产生的主要原因是
(6)结合Ⅱ、Ⅲ分析纯度较低的原因是
您最近一年使用:0次
2022·新疆·三模
解题方法
2 . 硫脲 [ ]是一种有机含硫化合物,用于制造药物、染料、树脂等。某实验小组用
]是一种有机含硫化合物,用于制造药物、染料、树脂等。某实验小组用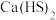 与
与 (石灰氮)合成硫脲并探究其性质。
(石灰氮)合成硫脲并探究其性质。
已知:①硫脲为白色晶体,易溶于水。在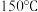 时转变成
时转变成 。
。
②酸性: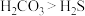 。
。
回答下列问题:
(1)制备 溶液,所用装置如图:
溶液,所用装置如图:

①使装置a中反应发生的操作为_______ :装置b中盛放的试剂是_______ 。
②装置c中的长直导管的作用是_______ 。为了利于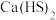 的生成,三颈烧瓶中通入
的生成,三颈烧瓶中通入
_______ (填“能”或“不能”)过量。
③装置d的作用是_______ 。
(2)制备硫脲:将 与
与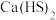 溶液混合,加热至
溶液混合,加热至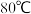 时,可合成硫脲,同时生成一种常见的碱。合适的加热方式是
时,可合成硫脲,同时生成一种常见的碱。合适的加热方式是_______ ;该反应的化学方程式为_______ 。
(3)探究硫脲的性质:
①取少量硫脲溶于水并加热,设计实验验证有 生成。
生成。
方法1:加入浓 溶液,有
溶液,有 放出。检验该气体的方法为
放出。检验该气体的方法为_______ 。
方法2:加入某种试剂,溶液变红色。该试剂所含的阳离子是_______ (填离子符号)。
②可用酸性 溶液滴定硫脲,已知
溶液滴定硫脲,已知 被还原为
被还原为 ,
, 被氧化为
被氧化为 、
、 及
及 ,该反应中还原剂与氧化剂的物质的量之比为
,该反应中还原剂与氧化剂的物质的量之比为_______ 。
 ]是一种有机含硫化合物,用于制造药物、染料、树脂等。某实验小组用
]是一种有机含硫化合物,用于制造药物、染料、树脂等。某实验小组用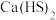 与
与 (石灰氮)合成硫脲并探究其性质。
(石灰氮)合成硫脲并探究其性质。已知:①硫脲为白色晶体,易溶于水。在
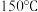 时转变成
时转变成 。
。②酸性:
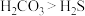 。
。回答下列问题:
(1)制备
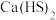 溶液,所用装置如图:
溶液,所用装置如图:
①使装置a中反应发生的操作为
②装置c中的长直导管的作用是
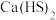 的生成,三颈烧瓶中通入
的生成,三颈烧瓶中通入
③装置d的作用是
(2)制备硫脲:将
 与
与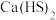 溶液混合,加热至
溶液混合,加热至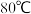 时,可合成硫脲,同时生成一种常见的碱。合适的加热方式是
时,可合成硫脲,同时生成一种常见的碱。合适的加热方式是(3)探究硫脲的性质:
①取少量硫脲溶于水并加热,设计实验验证有
 生成。
生成。方法1:加入浓
 溶液,有
溶液,有 放出。检验该气体的方法为
放出。检验该气体的方法为方法2:加入某种试剂,溶液变红色。该试剂所含的阳离子是
②可用酸性
 溶液滴定硫脲,已知
溶液滴定硫脲,已知 被还原为
被还原为 ,
, 被氧化为
被氧化为 、
、 及
及 ,该反应中还原剂与氧化剂的物质的量之比为
,该反应中还原剂与氧化剂的物质的量之比为
您最近一年使用:0次
解题方法
3 . 我国是钢铁生产大国,也是铁矿石消费大国。某铁矿石主要成分为FeS2和FeCO3,实验室为测定FeS2和FeCO3的物质的量之比,利用如图所示装置进行实验。(已知:硫酸铜溶液与H2S反应生成CuS黑色沉淀),实验步骤如下:

I.按图示连接仪器,检查装置气密性后加入药品;
II.打开K1、K2,通入一段时间氮气,关闭K1、K2,取下干燥管E称其质量( m1 )后再连接好装置;
III.打开K1和分液漏斗活塞,向三颈烧瓶中慢慢滴加足量已经除去O2的稀硫酸(其他杂质与稀硫酸不反应,且无还原性物质) ,待反应完成后,打开K2通入一段时间氮气;
IV.关闭K1、K2,取下三颈烧瓶过滤、洗涤,将滤液与洗涤液合并成100 mL溶液备用;
V.取下干燥管E并称其质量(m2);
VI.取IV中所得溶液25.00mL于锥形瓶中,用0.200mol·L-1酸性KMnO4溶液滴定。
回答下列问题:
(1)装置A中盛稀硫酸的仪器的名称为___________ ;若撤去装置F,则测得的FeCO3的含量会___________ (填“偏大”“偏小”或“无影响”)。
(2)步骤III中反应完成后,打开K2通入一段时间氮气的目的是___________ 。
(3)实验过程中发现装置B中有黑色沉淀生成,写出装置A中FeS2与稀硫酸反应的化学方程式:________ 。
(4)C装置的作用是___________ 。
(5)步骤VI中发生反应的离子方程式为___________ ,到达滴定终点的现象是___________ 。
(6)若上述实验中m2-m1=2.2 g,步骤VI消耗0. 200 mol·L-1酸性KMnO4溶液20. 00 mL,则该矿石样品中n( FeS2) :n( FeCO3)=___________ 。

I.按图示连接仪器,检查装置气密性后加入药品;
II.打开K1、K2,通入一段时间氮气,关闭K1、K2,取下干燥管E称其质量( m1 )后再连接好装置;
III.打开K1和分液漏斗活塞,向三颈烧瓶中慢慢滴加足量已经除去O2的稀硫酸(其他杂质与稀硫酸不反应,且无还原性物质) ,待反应完成后,打开K2通入一段时间氮气;
IV.关闭K1、K2,取下三颈烧瓶过滤、洗涤,将滤液与洗涤液合并成100 mL溶液备用;
V.取下干燥管E并称其质量(m2);
VI.取IV中所得溶液25.00mL于锥形瓶中,用0.200mol·L-1酸性KMnO4溶液滴定。
回答下列问题:
(1)装置A中盛稀硫酸的仪器的名称为
(2)步骤III中反应完成后,打开K2通入一段时间氮气的目的是
(3)实验过程中发现装置B中有黑色沉淀生成,写出装置A中FeS2与稀硫酸反应的化学方程式:
(4)C装置的作用是
(5)步骤VI中发生反应的离子方程式为
(6)若上述实验中m2-m1=2.2 g,步骤VI消耗0. 200 mol·L-1酸性KMnO4溶液20. 00 mL,则该矿石样品中n( FeS2) :n( FeCO3)=
您最近一年使用:0次
4 . 某学习小组研究溶液中Fe2+的稳定性,进行如下实验,观察,记录结果。
【实验I】
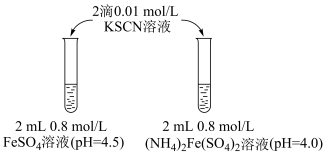
(1)上述(NH4)2Fe(SO4)2溶液pH小于FeSO4的原因是___________ (用化学用语表示)。溶液的稳定性:FeSO4___________ (NH4)2Fe(SO4)2(填“>”或“<”)。
(2)甲同学提出实验I中两溶液的稳定性差异可能是(NH4)2Fe(SO4)2溶液中的 保护了Fe2+,因为
保护了Fe2+,因为 具有还原性。进行实验II,否定了该观点,补全该实验。
具有还原性。进行实验II,否定了该观点,补全该实验。
【实验II】:
(3)乙同学提出实验I中两溶液的稳定性差异是溶液酸性不同导致,进行实验III:分别配制0.80mol•L-1pH为1、2、3、4的FeSO4溶液,观察,发现pH=1的FeSO4溶液长时间无明显变化,pH越大,FeSO4溶液变黄的时间越短。资料显示:亚铁盐溶液中存在反应4Fe2++O2+10H2O⇌4Fe(OH)3+8H+。由实验III,乙同学可得出的结论是___________ ,原因是___________ 。
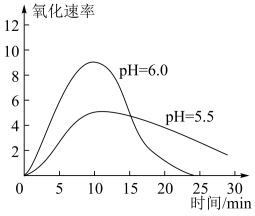
(4)进一步研究在水溶液中Fe2+的氧化机理。测定同浓度FeSO4溶液在不同pH条件下,Fe2+的氧化速率与时间的关系如图(实验过程中溶液温度几乎无变化)。反应初期,氧化速率都逐渐增大的原因可能是___________ 。
(5)综合以上实验,增强Fe2+稳定性的措施有___________ (写两点)
【实验I】

| 物质 | 0min | 1min | 1h | 5h |
| FeSO4 | 淡黄色 | 桔红色 | 红色 | 深红色 |
| (NH4)2Fe(SO4)2 | 几乎无色 | 淡黄色 | 黄色 | 桔红色 |
(2)甲同学提出实验I中两溶液的稳定性差异可能是(NH4)2Fe(SO4)2溶液中的
 保护了Fe2+,因为
保护了Fe2+,因为 具有还原性。进行实验II,否定了该观点,补全该实验。
具有还原性。进行实验II,否定了该观点,补全该实验。【实验II】:
| 操作 | 现象 |
| 取 | 与实验I中(NH4)2Fe(SO4)2溶液现象相同。 |
(4)进一步研究在水溶液中Fe2+的氧化机理。测定同浓度FeSO4溶液在不同pH条件下,Fe2+的氧化速率与时间的关系如图(实验过程中溶液温度几乎无变化)。反应初期,氧化速率都逐渐增大的原因可能是

(5)综合以上实验,增强Fe2+稳定性的措施有
您最近一年使用:0次
2021-12-02更新
|
196次组卷
|
4卷引用:新疆霍城县江苏中学2019届高三第二次模拟考试化学试题
5 . (1)科学家经过研究发现中国霾接近中性,其主要原因如图所示:
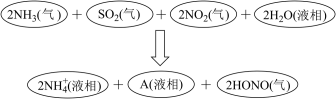
请判断A是__ (填化学符号)。
(2)为探究本地区雾霾中的可溶性颗粒的成分,某化学研究性小组进行了实验探究。
[查阅资料]雾霾颗粒样品中可能含有SO 、CO
、CO 、SO
、SO 、HCO
、HCO 、NO
、NO 、Cl-、Br-及一种常见阳离子,现进行如图实验:
、Cl-、Br-及一种常见阳离子,现进行如图实验:
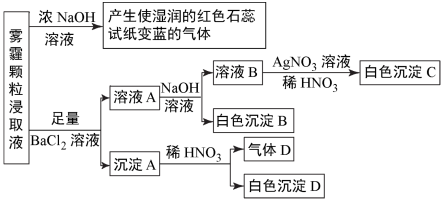
请回答下列问题:
①根据上述实验,雾霾浸取液中一定含有的离子是__ ,肯定没有的离子是__ 。
②若气体D遇空气会变成红棕色,则沉淀A中一定含有__ (填化学式)。
(3)当前频繁出现的雾霾天气与汽车尾气的排放有一定的关系。通过NOx传感器可监测NOx的含量,其工作原理示意图如图:
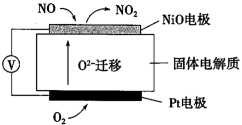
①Pt电极上发生的是___ 反应(填“氧化”或“还原”)。
②写出Pt电极的电极反应式___ 。
③写出NiO电极的电极反应式__ 。

请判断A是
(2)为探究本地区雾霾中的可溶性颗粒的成分,某化学研究性小组进行了实验探究。
[查阅资料]雾霾颗粒样品中可能含有SO
 、CO
、CO 、SO
、SO 、HCO
、HCO 、NO
、NO 、Cl-、Br-及一种常见阳离子,现进行如图实验:
、Cl-、Br-及一种常见阳离子,现进行如图实验:
请回答下列问题:
①根据上述实验,雾霾浸取液中一定含有的离子是
②若气体D遇空气会变成红棕色,则沉淀A中一定含有
(3)当前频繁出现的雾霾天气与汽车尾气的排放有一定的关系。通过NOx传感器可监测NOx的含量,其工作原理示意图如图:

①Pt电极上发生的是
②写出Pt电极的电极反应式
③写出NiO电极的电极反应式
您最近一年使用:0次
2011·新疆乌鲁木齐·三模
解题方法
6 . (Ⅰ)某化学兴趣小组的同学得上用下图所示实验装置进行实验(图中a、b、c表示止水夹)。
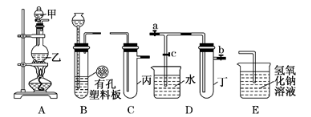
(1)请利用上述装置设计一个简单的实验验证Cl-和Br-的还原性强弱。
①选择合理的装置连接:___________ →____________ →__________ (填字母编号)。
②选择所需的试剂:__________ (填字母编号)。
a.固体氯化钠 b.固体二氧化锰 c.浓硫酸
d.浓盐酸 e.稀盐酸 f.溴化钠溶液
③实验现象及结论:_________ 。
(Ⅱ)电极材料由Ni(OH)2、碳粉、氧化铁等涂覆在铝箔上制成。由于电池使用后电极材料对环境有危害,某兴趣小组对该电池电极材料进行资源回收并制备NiSO4·7H2O晶体,设计实验流程如下: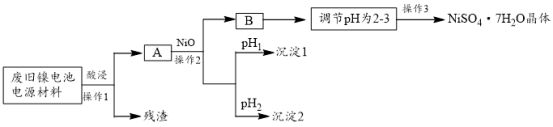
已知:①NiSO4易溶于水,Fe3+不能氧化Ni2+
②某温度下一些金属氢氧化物的KSP及析出理论pH如下表所示:
回答下列问题:
(1)根据上表数据判断操作2依次析出的沉淀1是_______ 沉淀2是________ (填化学式),pH1___________ pH2(填“>”、“<”或“=”);
(2)操作1和操作2所用到的仪器除铁架台(带铁圈)、酒精灯、烧杯、玻璃棒外还需要的主要仪器为___________ 。
(3)“调节pH为2-3”的目的是_______ ;
(4)NiSO4在强碱溶溶中用NaClO氧化,可制得碱性镍镉电池电极材料—NiOOH。该反应的离子方程式是______________ 。

(1)请利用上述装置设计一个简单的实验验证Cl-和Br-的还原性强弱。
①选择合理的装置连接:
②选择所需的试剂:
a.固体氯化钠 b.固体二氧化锰 c.浓硫酸
d.浓盐酸 e.稀盐酸 f.溴化钠溶液
③实验现象及结论:
(Ⅱ)电极材料由Ni(OH)2、碳粉、氧化铁等涂覆在铝箔上制成。由于电池使用后电极材料对环境有危害,某兴趣小组对该电池电极材料进行资源回收并制备NiSO4·7H2O晶体,设计实验流程如下:

已知:①NiSO4易溶于水,Fe3+不能氧化Ni2+
②某温度下一些金属氢氧化物的KSP及析出理论pH如下表所示:
| M(OH)n | Ksp | pH | |
| 开始沉淀 | 沉淀完全 | ||
| Al(OH)3 | 1.9×10-23 | 3.43 | 4.19 |
| Fe(OH)3 | 3.8×10-38 | 2.53 | 2.94 |
| Ni(OH)2 | 1.6×10-14 | 7.60 | 9.75 |
回答下列问题:
(1)根据上表数据判断操作2依次析出的沉淀1是
(2)操作1和操作2所用到的仪器除铁架台(带铁圈)、酒精灯、烧杯、玻璃棒外还需要的主要仪器为
(3)“调节pH为2-3”的目的是
(4)NiSO4在强碱溶溶中用NaClO氧化,可制得碱性镍镉电池电极材料—NiOOH。该反应的离子方程式是
您最近一年使用:0次



