22-23高一下·全国·单元测试
解题方法
1 . 合理施用农药
(1)农药的发展:早期_______ 有除虫菊、烟草等植物和波尔多液、石灰硫黄合剂等无机物。现在人们研制出了有机氯农药、有机磷农药、氨基甲酸酯和_______ 等有机合成农药。
(2)农药的发展方向:_______ 、_______ 和_______ 。
(3)不合理施用农药的危害
①农药可能会破坏害虫与天敌之间的生态平衡,一些害虫还会产生_______ 。
②蜜蜂等传粉昆虫对农药很_______ ,大量用药如不注意就会引起这些昆虫的大量死亡。
③农药施用方法、用量和时机不当,会造成土壤和作物的农药残留_______ ,以及大气、地表水和地下水的污染。
(1)农药的发展:早期
(2)农药的发展方向:
(3)不合理施用农药的危害
①农药可能会破坏害虫与天敌之间的生态平衡,一些害虫还会产生
②蜜蜂等传粉昆虫对农药很
③农药施用方法、用量和时机不当,会造成土壤和作物的农药残留
您最近一年使用:0次
22-23高一下·全国·单元测试
2 . 合理施用化肥
(1)考虑因素:除了要考虑土壤_______ 、作物营养状况等因素,还必须根据化肥本身的性质进行科学施用。
(2)过量施用化肥的危害
①很多化肥易溶于水,过量施用不仅会造成浪费,部分化肥随着雨水流入河流和湖泊,造成_______ ,产生_______ 等污染现象。
②不合理施用化肥还会影响土壤的_______ 和土壤_______ 。
(1)考虑因素:除了要考虑土壤
(2)过量施用化肥的危害
①很多化肥易溶于水,过量施用不仅会造成浪费,部分化肥随着雨水流入河流和湖泊,造成
②不合理施用化肥还会影响土壤的
您最近一年使用:0次
名校
解题方法
3 . 根据表中信息,使用尿素的注意事项是___________ 。(写2点)
尿素的某些性质如下表所示。
尿素的某些性质如下表所示。
| 熔点 | 沸点 | 溶解度(20℃) | 光稳定性 |
| 132.7℃ | 196.6℃ |  水 水 | 见光易分解 |
您最近一年使用:0次
4 . 下面是制备硫酸的工业流程:_______ ;每轮反应后进行热交换降温的目的是_______ 。

您最近一年使用:0次
解题方法
5 . 元素的价类二维图是我们学习元素及其化合物相关知识的重要模型和工具,它指的是以元素的化合价为纵坐标,以物质的类别为横坐标所绘制的二维平面图像。下图是钠的价类二维图:

请回答以下问题:
(1)钠是一种活泼性很强的金属,下列各项中属于保存金属钠的正确方法是___________。(填序号)
(2)二维图中缺失的①中有一种是淡黄色固体且具有强氧化性,写出其与水反应的化学方程式___________ 。
(3)现代工业常以氯化钠为原料制备纯碱,部分工艺流程如图:

已知 在低温下溶解度较小。
在低温下溶解度较小。
①反应Ⅰ的化学方程式为___________ 。
②加热 与
与 的固体混合物,使碳酸氢钠完全分解,混合物质量减少了
的固体混合物,使碳酸氢钠完全分解,混合物质量减少了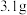 ,则原混合物中碳酸钠的质量是
,则原混合物中碳酸钠的质量是___________ g。

请回答以下问题:
(1)钠是一种活泼性很强的金属,下列各项中属于保存金属钠的正确方法是___________。(填序号)
| A.放在细沙中 | B.放在水中 | C.放在煤油中 | D.放在细口瓶中 |
(2)二维图中缺失的①中有一种是淡黄色固体且具有强氧化性,写出其与水反应的化学方程式
(3)现代工业常以氯化钠为原料制备纯碱,部分工艺流程如图:

已知
 在低温下溶解度较小。
在低温下溶解度较小。①反应Ⅰ的化学方程式为
②加热
 与
与 的固体混合物,使碳酸氢钠完全分解,混合物质量减少了
的固体混合物,使碳酸氢钠完全分解,混合物质量减少了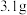 ,则原混合物中碳酸钠的质量是
,则原混合物中碳酸钠的质量是
您最近一年使用:0次
名校
6 . 现有下列物质:① ②
② 溶液 ③
溶液 ③ 固体 ④
固体 ④ ⑤饱和
⑤饱和 溶液 ⑥
溶液 ⑥ ⑦熔融
⑦熔融 ,回答下列问题:
,回答下列问题:
(1)上述物质中,属于电解质的是_______ 。
(2)熔融 的电离方程式为
的电离方程式为_______ 。
(3)①与②反应的化学方程式为_______ 。
(4)碳酸钠可用于海水提溴,涉及的反应为: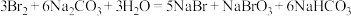 。
。
ⅰ)该反应的离子方程式为_______ 。
ⅱ)当 参与反应时,转移电子的物质的量为
参与反应时,转移电子的物质的量为_______ 。
(5)④⑤⑥是侯氏制碱的原料,三者反应的化学方程式为_______ 。
 ②
② 溶液 ③
溶液 ③ 固体 ④
固体 ④ ⑤饱和
⑤饱和 溶液 ⑥
溶液 ⑥ ⑦熔融
⑦熔融 ,回答下列问题:
,回答下列问题:(1)上述物质中,属于电解质的是
(2)熔融
 的电离方程式为
的电离方程式为(3)①与②反应的化学方程式为
(4)碳酸钠可用于海水提溴,涉及的反应为:
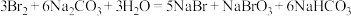 。
。ⅰ)该反应的离子方程式为
ⅱ)当
 参与反应时,转移电子的物质的量为
参与反应时,转移电子的物质的量为(5)④⑤⑥是侯氏制碱的原料,三者反应的化学方程式为
您最近一年使用:0次
2024-01-19更新
|
57次组卷
|
2卷引用:海南省琼海市嘉积中学2023-2024学年高一上学期第三次月考化学科试题
7 . 碳酸钠是一种重要的无机化工原料,主要用于玻璃制品和陶瓷釉的生产,还广泛用于生活洗涤、酸类中和以及食品加工等。工业制碱法大致经历了如图所示的三个阶段。

I.路布兰是开创化学工业的先驱者,路布兰制碱法是化工史上的一个里程碑。路布兰制碱法的原理如下:
①
②
③
请回答下列问题:
(1)反应①属于___________ (填四大基本反应类型),反应②中的氧化产物为___________ (填化学式)。
(2)路布兰制碱法的缺点有___________ (写出一点即可)。
II.1861年,比利时人欧内斯特·索尔维发明了以食盐、石灰石、氨气为原料制取碳酸钠的索尔维制碱法(又称氨碱法),其工业生产的简单流程如下图所示。
请回答下列问题:
(3)上述流程涉及的物质中,属于碱性氧化物的是___________ (填化学式)。
(4)往饱和 溶液中持续通入
溶液中持续通入 ,观察到的现象为
,观察到的现象为___________ 。
III.1943年左右我国著名科学家侯德榜先生克服重重困难,把合成氨工业和氨碱法制碱工业结合起来,发明了联合制碱法,也被人们称为“侯氏制碱法”,该方法大大提高了原料的利用率,其流程如图所示。

请回答下列问题:
(5)往饱和食盐水中通入 和
和 获得
获得 固体和母液a,通过
固体和母液a,通过___________ 操作分离 固体和母液a,
固体和母液a, 固体制备纯碱的化学方程式为
固体制备纯碱的化学方程式为___________ 。
(6)相比索尔维制碱法,侯氏制碱法的优点有___________ (填标号)。
a.用等量的食盐可以生产更多的纯碱,同时得到氮肥氯化铵,NaCl的利用率高
b.不产生用途不大且难处理的 ,对环境更加友好
,对环境更加友好
c.侯氏制碱法无须加热
d.侯氏制碱法中 可以循环使用,后续无须补充
可以循环使用,后续无须补充

I.路布兰是开创化学工业的先驱者,路布兰制碱法是化工史上的一个里程碑。路布兰制碱法的原理如下:
①

②

③

请回答下列问题:
(1)反应①属于
(2)路布兰制碱法的缺点有
II.1861年,比利时人欧内斯特·索尔维发明了以食盐、石灰石、氨气为原料制取碳酸钠的索尔维制碱法(又称氨碱法),其工业生产的简单流程如下图所示。

请回答下列问题:
(3)上述流程涉及的物质中,属于碱性氧化物的是
(4)往饱和
 溶液中持续通入
溶液中持续通入 ,观察到的现象为
,观察到的现象为III.1943年左右我国著名科学家侯德榜先生克服重重困难,把合成氨工业和氨碱法制碱工业结合起来,发明了联合制碱法,也被人们称为“侯氏制碱法”,该方法大大提高了原料的利用率,其流程如图所示。

请回答下列问题:
(5)往饱和食盐水中通入
 和
和 获得
获得 固体和母液a,通过
固体和母液a,通过 固体和母液a,
固体和母液a, 固体制备纯碱的化学方程式为
固体制备纯碱的化学方程式为(6)相比索尔维制碱法,侯氏制碱法的优点有
a.用等量的食盐可以生产更多的纯碱,同时得到氮肥氯化铵,NaCl的利用率高
b.不产生用途不大且难处理的
 ,对环境更加友好
,对环境更加友好 c.侯氏制碱法无须加热
d.侯氏制碱法中
 可以循环使用,后续无须补充
可以循环使用,后续无须补充
您最近一年使用:0次
名校
解题方法
8 . 纯碱是重要的基本化工原料.工业上获得纯碱的方法(氨碱法)主要是将 ①、
①、 ②通入
②通入 ③饱和溶液中,使溶解度小的
③饱和溶液中,使溶解度小的 ④从溶液中析出,加热
④从溶液中析出,加热 晶体即可获得
晶体即可获得 ⑤,我国化学家侯德榜于1943年创立了著名的侯氏制碱法,此法将
⑤,我国化学家侯德榜于1943年创立了著名的侯氏制碱法,此法将 ⑥与
⑥与 ⑦合成氨法、氨碱法联合起来,同时得到了纯碱和
⑦合成氨法、氨碱法联合起来,同时得到了纯碱和 ⑧两种产品,大大缩短了生产流程,降低了成本,实现了中国人自己制碱的梦想。
⑧两种产品,大大缩短了生产流程,降低了成本,实现了中国人自己制碱的梦想。
(1)属于酸性氧化物的是____________ (填序号,下同),在水溶液中可以全部电离的物质是____________ ,属于非金属单质的是____________ 。
(2)实验室在模拟上述反应过程时,先制得饱和食盐水,然后先通入____________ 气体,当达到一定浓度后,再通入____________ ,一段时间以后,便可观察到有白色晶体析出。
写出发生反应的总方程式____________________________________
 ①、
①、 ②通入
②通入 ③饱和溶液中,使溶解度小的
③饱和溶液中,使溶解度小的 ④从溶液中析出,加热
④从溶液中析出,加热 晶体即可获得
晶体即可获得 ⑤,我国化学家侯德榜于1943年创立了著名的侯氏制碱法,此法将
⑤,我国化学家侯德榜于1943年创立了著名的侯氏制碱法,此法将 ⑥与
⑥与 ⑦合成氨法、氨碱法联合起来,同时得到了纯碱和
⑦合成氨法、氨碱法联合起来,同时得到了纯碱和 ⑧两种产品,大大缩短了生产流程,降低了成本,实现了中国人自己制碱的梦想。
⑧两种产品,大大缩短了生产流程,降低了成本,实现了中国人自己制碱的梦想。(1)属于酸性氧化物的是
(2)实验室在模拟上述反应过程时,先制得饱和食盐水,然后先通入
写出发生反应的总方程式
您最近一年使用:0次
名校
解题方法
9 . 分类法是常用的科学研究方法,通过对物质进行分类,我们可以更方便的认识物质变化的规律。
I.完成下列问题
(1)某同学在学习了物质分类和转化之后,对该侯氏制碱法反应原理进行了如下解读:CO2属于___________ (填具体物质类型,NH3·H2O属于碱,它们反应可生成了一种酸式盐,其化学式为___________ ,在一定温度下,该体系中各物质的溶解度如表所示,其中溶解度最小的溶质(即___________ 会析出,也即生成了沉淀反应得以发生),侯氏制碱法的反应原理是否属于离子反应,若是,请写出相应的离子方程式___________ 。若否,请在横线上写“否”。
(2)根据各物质的溶解度随温度变化的曲线,欲使 发生,应选择的温度可以是___________(填选项字母)。
发生,应选择的温度可以是___________(填选项字母)。

Ⅱ.完成下列问题
(3)下列物质中:①固体氯化钠;②CO2;③蔗糖晶体;④乙醇;⑤NaHSO4溶液;⑥CuSO4·5H2O;⑦盐酸;⑧Ba(OH)2溶液;⑨熔融氢氧化钠;⑩固体BaSO4。
属于混合物的是___________ (填写相应序号,下同);属于电解质的是___________ 可以导电的是___________ 。
Ⅲ.胶体属于分散系的一种,制备Fe(OH)3胶体的操作方法如下,回答下列问题:
制备Fe(OH)3胶体:向煮沸的蒸馏水中逐滴加入饱和的FeCl3溶液,继续煮沸至溶液呈红褐色,停止加热,可制得Fe(OH)3胶体。
(4)制备Fe(OH)3胶体的离子方程式为___________ 。
(5)如何用实验证明上述所制备的液体是胶体,___________ 。
I.完成下列问题
(1)某同学在学习了物质分类和转化之后,对该侯氏制碱法反应原理进行了如下解读:CO2属于
| 溶解度/g | HCO | Cl- | CO |
| Na+ | 9.6 | 36.0 | 21.8 |
| NH4+ | 21.7 | 372 | 100 |
(2)根据各物质的溶解度随温度变化的曲线,欲使
 发生,应选择的温度可以是___________(填选项字母)。
发生,应选择的温度可以是___________(填选项字母)。
| A.0-10℃ | B.10-20℃ | C.15-45℃ | D.70-80℃ |
Ⅱ.完成下列问题
(3)下列物质中:①固体氯化钠;②CO2;③蔗糖晶体;④乙醇;⑤NaHSO4溶液;⑥CuSO4·5H2O;⑦盐酸;⑧Ba(OH)2溶液;⑨熔融氢氧化钠;⑩固体BaSO4。
属于混合物的是
Ⅲ.胶体属于分散系的一种,制备Fe(OH)3胶体的操作方法如下,回答下列问题:
制备Fe(OH)3胶体:向煮沸的蒸馏水中逐滴加入饱和的FeCl3溶液,继续煮沸至溶液呈红褐色,停止加热,可制得Fe(OH)3胶体。
(4)制备Fe(OH)3胶体的离子方程式为
(5)如何用实验证明上述所制备的液体是胶体,
您最近一年使用:0次
名校
解题方法
10 . Ⅰ.现代工业常以氯化钠为原料制备纯碱,部分工艺流程如图:
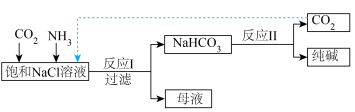
已知 在低温下溶解度较小。
在低温下溶解度较小。
(1)母液中主要含有NaCl、 和
和______ 。
(2)设计 循环的目的是
循环的目的是______ .
(3)可以利用加热的方法来鉴别碳酸钠和碳酸氢钠,反应的化学方程式为______ 。
Ⅱ.是一种重要的供氧剂。
(4)取一定量 ,加入足量的水,反应的化学方程式为
,加入足量的水,反应的化学方程式为______ .
(5)收集并测量生成 的体积,发现体积小于理论计算值。
的体积,发现体积小于理论计算值。
某小组研究产生这一差异的原因,进行如下探究。
查阅资料:
a.过氧化钠与水反应的过程中还可能存在以下两个复分解反应:
ⅰ.
ⅱ.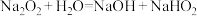
b.与 类似,
类似,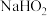 也能在
也能在 催化的条件下分解生成
催化的条件下分解生成 。
。
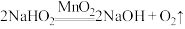
依据资料设计如下实验:取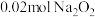 与足量水反应,140s时不再产生气泡,180s时向所得溶液中加入少量
与足量水反应,140s时不再产生气泡,180s时向所得溶液中加入少量 ,立即产生无色气体。过程中溶液的体积始终约为40mL。反应过程中pH变化如图所示。已知:溶液中
,立即产生无色气体。过程中溶液的体积始终约为40mL。反应过程中pH变化如图所示。已知:溶液中 越大,溶液pH越大。
越大,溶液pH越大。

数据分析:
①小组同学根据pH的变化判断反应过程中一定发生反应______ (填“ⅰ”或“ⅱ”),理由是______ 。
②根据140s~180s的pH计算出溶液的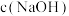 为
为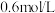 ,则此时段内溶液中
,则此时段内溶液中 为
为______ mol。

已知
 在低温下溶解度较小。
在低温下溶解度较小。(1)母液中主要含有NaCl、
 和
和(2)设计
 循环的目的是
循环的目的是(3)可以利用加热的方法来鉴别碳酸钠和碳酸氢钠,反应的化学方程式为
Ⅱ.是一种重要的供氧剂。
(4)取一定量
 ,加入足量的水,反应的化学方程式为
,加入足量的水,反应的化学方程式为(5)收集并测量生成
 的体积,发现体积小于理论计算值。
的体积,发现体积小于理论计算值。某小组研究产生这一差异的原因,进行如下探究。
查阅资料:
a.过氧化钠与水反应的过程中还可能存在以下两个复分解反应:
ⅰ.

ⅱ.
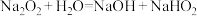
b.与
 类似,
类似,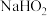 也能在
也能在 催化的条件下分解生成
催化的条件下分解生成 。
。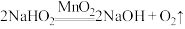
依据资料设计如下实验:取
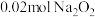 与足量水反应,140s时不再产生气泡,180s时向所得溶液中加入少量
与足量水反应,140s时不再产生气泡,180s时向所得溶液中加入少量 ,立即产生无色气体。过程中溶液的体积始终约为40mL。反应过程中pH变化如图所示。已知:溶液中
,立即产生无色气体。过程中溶液的体积始终约为40mL。反应过程中pH变化如图所示。已知:溶液中 越大,溶液pH越大。
越大,溶液pH越大。
数据分析:
①小组同学根据pH的变化判断反应过程中一定发生反应
②根据140s~180s的pH计算出溶液的
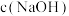 为
为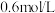 ,则此时段内溶液中
,则此时段内溶液中 为
为
您最近一年使用:0次



