人教版高中化学必修1化学第二章《化学物质及其变化》测试卷
全国
高一
单元测试
2020-02-08
254次
整体难度:
适中
考查范围:
认识化学科学、化学实验基础、化学反应原理、常见无机物及其应用
一、单选题 添加题型下试题
| A.Fe3+>HClO>Cl2>Fe2+>Cu2+ |
| B.HClO>Cl2>Fe3+>Cu2+>Fe2+ |
| C.Cl2>HClO>Fe3+>Cu2+>Fe2+ |
| D.HClO>Fe3+>Cl2>Cu2+>Fe2+ |
【知识点】 氧化性、还原性强弱的比较解读
| A.氯化钠溶液均一、稳定、透明,不是分散系 |
| B.“冰水混合物”是一种分散系 |
| C.分散系有的是纯净物,有的是混合物 |
| D.分散系都是混合物,按分散质和分散剂所处的状态,分散系的组合可能有9种方式 |
【知识点】 分散系
| A.S+O2=SO2 | B.Na2CO3+CO2+H2O=2NaHCO3 |
| C.NH4HCO3=NH3↑+CO2↑+H2O | D.CO2+C=2CO |
| A.磷酸钠 | B.硫酸铝 | C.氯化钡 | D.硫酸钾 |
【知识点】 化学物质的分类方法
①金属单质 ②碱性氧化物 ③非金属单质 ④酸性氧化物 ⑤酸 ⑥碱
| A.①②③ | B.①④⑥ | C.②⑤⑥ | D.全部 |
| A.Cl2是氧化剂,NaOH是还原剂 |
| B.被氧化的氯原子和被还原的氯原子的质量之比为5∶1 |
| C.Cl2既是氧化剂又是还原剂 |
| D.氧化剂的得电子数与还原剂的失电子数之比为5∶1 |
| A.①②③④ | B.①②③④⑦ | C.①②④⑦ | D.①②③④⑤⑥⑦ |
【知识点】 氧化还原反应基本概念
| A.NaOH | B.Na2CO3 | C.BaCl2 | D.Ba(OH)2 |
【知识点】 化学反应原理综合考查解读
A.过量的二氧化碳通入氢氧化钠溶液中:CO2+OH-=== +H2O +H2O |
| B.澄清石灰水中通入少量二氧化碳:Ca2++2OH-+CO2===CaCO3↓+H2O |
C.碳酸氢钙溶液和足量氢氧化钠溶液混合: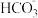 +OH-=== +OH-=== +H2O +H2O |
D.碳酸钙和盐酸反应: +2H+===CO2↑+H2O +2H+===CO2↑+H2O |
【知识点】 离子方程式的正误判断解读
| A.NO2→HNO3+NO | B. →NH3 →NH3 |
| C.NH3→NO | D.P2O5→H3PO4 |
【知识点】 氧化还原反应的几组概念解读 氧化还原反应的规律解读
| A.产物中n[Cu(NO3)2]:n[CuSO4]=1:1 |
| B.参加反应的n(Cu2S):n(HNO3)=1:5 |
| C.反应中Cu2S既作氧化剂,又作还原剂 |
| D.1mol Cu2S参加反应时有8mol电子转移 |
②Se+2H2SO4(浓)=2SO2↑+SeO2+2H2O。下列叙述正确的是
| A.反应①中Se是氧化产物,I2是还原产物 |
| B.反应②中浓H2SO4是氧化剂,SeO2是还原产物 |
| C.反应①中每有1.0mol I2生成,转移电子数目为4NA |
| D.SeO2、H2SO4(浓)、I2的氧化性由强到弱的顺序是H2SO4(浓)>SeO2>I2 |
【知识点】 氧化性、还原性强弱的比较解读
| A.硫酸、Na2CO3•10H2O、Ca(OH)2 |
| B.水、空气、纯碱 |
| C.氧化铁、胆矾、生石灰 |
| D.硝酸、食盐水、烧碱 |
【知识点】 无机物质的分类
| A.鉴别氢氧化铝胶体(无色)和食盐水,可以不用任何试剂 |
| B.鉴别白糖水和食盐溶液,可以不用任何试剂 |
| C.鉴别粉笔末与水、豆油与水组成的浊液,可以不用任何试剂 |
| D.鉴别氯化钠溶液与硫酸铜两种溶液,可以不用任何试剂 |
二、填空题 添加题型下试题
(1)二氧化硫与水反应可生成亚硫酸,那么二氧化硫是电解质还是非电解质?
(2)工业尾气中的二氧化硫常用氢氧化钠溶液吸收,生成亚硫酸钠或亚硫酸氢钠:
①亚硫酸钠溶于水的电离方程式是
②亚硫酸氢钠溶于水的电离方程式是
(3)二氧化硫在催化剂的作用下可被氧气氧化成三氧化硫,三氧化硫与水反应生成硫酸:
①三氧化硫是电解质还是非电解质?
②氧气属于电解质或非电解质吗?
(4)三氧化硫与氢氧化钠溶液反应可生成硫酸氢钠:
①硫酸氢钠溶于水的电离方程式是
②硫酸氢钠是酸类物质吗?
【知识点】 电解质、非电解质概念解读
三、计算题 添加题型下试题
(1)反应中
(2)用“双线桥”标出电子转移的方向和数目。
(3)反应产物中,氧化产物与还原产物的物质的量之比为
四、解答题 添加题型下试题

实验记录如下:
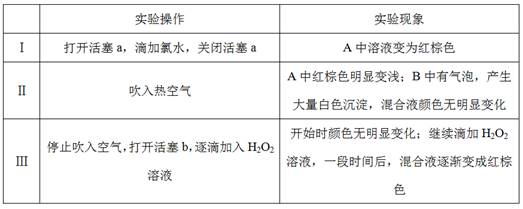
请回答下列问题:
(1)A中反应的离子方程式是
(2)实验操作Ⅱ吹入热空气的目的是
(3)装置C的作用是
(4)实验操作Ⅲ,混合液逐渐变成红棕色,其对应的离子方程式
(5)由上述实验得出的结论是
(6)实验反思:
①有同学认为实验操作Ⅱ吹入的热空气,会干扰(5)中结论的得出,你认为是否干扰,理由是
②实验操作Ⅲ,开始时颜色无明显变化的原因是(写出一条即可):
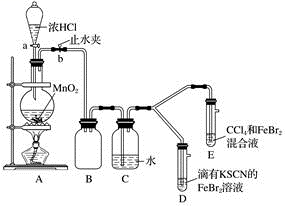
(1)①装置A中发生反应的离子方程式是
②整套实验装置存在一处明显的不足,请指出
(2)用改正后的装置进行实验,实验过程如下:
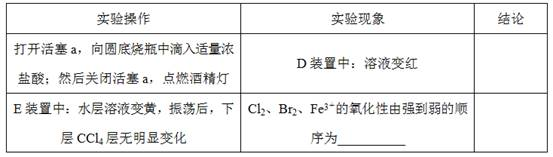
(3)因忙于观察和记录,没有及时停止反应,D、E中均发生了新的变化。D装置中:红色慢慢褪去。E装置中:CCl4层先由无色变为橙色,后颜色逐渐加深,直至变成红色。
为探究上述实验现象的本质,小组同学查得资料如下:
i.Fe3+3SCN-
 Fe(SCN)3是一个可逆反应。
Fe(SCN)3是一个可逆反应。ii.(SCN)2性质与卤素单质类似、氧化性:Cl2>(SCN)2。
iii.Cl2和Br2反应生辰BrCl,BrCl呈红色(略带黄色),沸点约5℃,它与水能发生水解反应,且该反应为非氧化还原反应。
iv.AgClO、AgBrO均可溶于水。
①用平衡移动原理(结合上述资料)解释Cl2过量时D中溶液红色褪去的原因
②探究E中颜色变化的原因,设计实验如下:
用分液漏斗分离出E的下层溶液,蒸馏、收集红色物质,取少量,加入AgNO3溶液,结果观察到仅有白色沉淀产生。请结合上述资料用两步方程式(离子或化学方程式不限定)解释仅产生白色沉淀的原因:
五、 添加题型下试题
(1)若将饱和FeCl3溶液分别滴入下列物质中,能形成胶体的是
A.冷水 B.沸水 C.NaOH浓溶液 D.NaCl浓溶液
(2)现有甲、乙、丙三名同学进行Fe(OH)3胶体的制备:
①甲同学的操作:取一小烧杯,加入25 mL蒸馏水加热至沸腾,向沸水中逐滴加入1~2 mL FeCl3饱和溶液,继续煮沸至混合液呈红褐色,停止加热。请评价该操作是否正确
②乙直接加热饱和FeCl3溶液,请评价是否正确
③丙向沸水中滴加饱和FeCl3溶液,为了使反应进行充分,煮沸10分钟,请评价是否正确
(3)写出制备Fe(OH)3胶体的化学方程式:
(4)Fe(OH)3胶体稳定存在的主要原因是
A.胶体粒子直径小于1nm B.胶体粒子带正电荷
C.胶体粒子作布朗运动 D.胶体粒子能透过滤纸
(5)Fe(OH)3胶体区别于FeCl3溶液最本质的特征是
A.Fe(OH)3胶体粒子的直径在1~100 nm之间
B.Fe(OH)3胶体具有丁达尔效应
C.Fe(OH)3胶体是均一的分散系
D.Fe(OH)3胶体的分散质能透过滤纸
(6)若取少量制得的胶体加入试管中,加入硫酸铵溶液,现象是
【知识点】 胶体的制备解读 物质性质实验方案的设计解读
六、填空题 添加题型下试题
(1)用氢气还原氧化铜。
(2)加热氯酸钾分解制取氧气。
七、计算题 添加题型下试题
(1)参加反应的HNO3和作为氧化剂的HNO3的个数比为
(2)若有64 g Cu被氧化,则被还原的HNO3的质量是
【知识点】 氧化还原反应有关计算
(1)参加反应的HCl的物质的量
(2)反应中被氧化的HCl的物质的量
(3)并用双线桥标出电子转移的方向和数目
试卷分析
试卷题型(共 24题)
试卷难度
知识点分析
细目表分析 导出
| 题号 | 难度系数 | 详细知识点 | 备注 |
| 一、单选题 | |||
| 1 | 0.85 | 氧化性、还原性强弱的比较 | |
| 2 | 0.94 | 分散系 | |
| 3 | 0.65 | 分类方法的应用 四种基本反应类型 | |
| 4 | 0.85 | 化学物质的分类方法 | |
| 5 | 0.65 | 分类方法的应用 | |
| 6 | 0.65 | 物质的转化 酸、碱、盐、氧化物的概念及其相互联系 常见无机物的制备 | |
| 7 | 0.65 | 氧化还原反应的几组概念 氧化还原反应的应用 与氧化剂、还原剂有关的计算 | |
| 8 | 0.65 | 氧化还原反应基本概念 | |
| 9 | 0.85 | 化学反应原理综合考查 | |
| 10 | 0.65 | 离子方程式的正误判断 | |
| 11 | 0.65 | 氧化还原反应的几组概念 氧化还原反应的规律 | |
| 12 | 0.65 | 氧化还原反应方程式的配平 与氧化剂、还原剂有关的计算 基于氧化还原反应守恒规律的计算 | |
| 13 | 0.65 | 氧化性、还原性强弱的比较 | |
| 14 | 0.94 | 无机物质的分类 | |
| 15 | 0.85 | 胶体的性质和应用 无机物的检验 | |
| 二、填空题 | |||
| 16 | 0.65 | 电解质与非电解质 电离方程式 | |
| 17 | 0.94 | 电解质、非电解质概念 | |
| 22 | 0.85 | 氧化还原反应定义、本质及特征 单线桥、双线桥分析氧化还原反应 | |
| 三、计算题 | |||
| 18 | 0.65 | 氧化还原反应的几组概念 单线桥、双线桥分析氧化还原反应 | |
| 23 | 0.85 | 氧化还原反应有关计算 | |
| 24 | 0.85 | 单线桥、双线桥分析氧化还原反应 氧化还原反应有关计算 氧化还原反应的规律 | |
| 四、解答题 | |||
| 19 | 0.65 | 氯气与还原性化合物的反应 溴、碘的性质 物质性质实验方案的设计 | 实验探究题 |
| 20 | 0.65 | 氧化性、还原性强弱的比较 化学实验探究 化学实验方案的设计与评价 物质性质的探究 | 实验探究题 |
| 五、 | |||
| 21 | 0.65 | 胶体的制备 物质性质实验方案的设计 | |



