名校
解题方法
1 . 氯气常用于自来熟的杀菌消毒,实验室常用MnO2和浓盐酸共热制备氯气。
(1)写出该反应的离子方程式:_______ ,其中氧化剂和还原剂的物质的量之比为_______ 。
(2)若 和
和 盐酸混合后缓缓加热,反应完全后向留下的溶液中加入足量AgNO3溶液,生成AgCl沉淀物质的量为_______。(不考虑盐酸的挥发)
盐酸混合后缓缓加热,反应完全后向留下的溶液中加入足量AgNO3溶液,生成AgCl沉淀物质的量为_______。(不考虑盐酸的挥发)
(3)若改用漂白粉与浓盐酸反应制备氯气,反应的化学方程式为 。据此回答下列问题:装置如图所示,同时验证氯气性质(其中夹持装置已省略)
。据此回答下列问题:装置如图所示,同时验证氯气性质(其中夹持装置已省略)
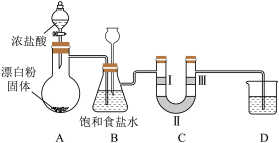
①从反应条件看,MnO2和Ca(ClO)2的氧化能力不同,氧化能力较强的是_______ 。
②装置B除了用于除去挥发的HCl,也是安全瓶,目的是监测实验进行时装置C中是否发生堵塞,请写出装置C中发生堵塞时装置B中的实验现象:_______ 。
③装置C的作用是验证氯气是否具有漂白性,则装置C中Ⅰ、Ⅱ、Ⅲ处依次应放入的物质是_______ (填序号)。
④装置D的烧杯内是NaOH溶液,其作用是_______ ,发生的反应的离子方程式:_______ 。
(4)用氯气对自来水消毒易产生致癌物质,二氧化氯是一种更为高效氨气的消毒剂。 在杀菌消毒的过程中会生成副产物亚氯酸盐(
在杀菌消毒的过程中会生成副产物亚氯酸盐( ),需要将其转化为
),需要将其转化为 除去,下列试剂能实现其转化过程的是_______(填序号)。
除去,下列试剂能实现其转化过程的是_______(填序号)。
(1)写出该反应的离子方程式:
(2)若
 和
和 盐酸混合后缓缓加热,反应完全后向留下的溶液中加入足量AgNO3溶液,生成AgCl沉淀物质的量为_______。(不考虑盐酸的挥发)
盐酸混合后缓缓加热,反应完全后向留下的溶液中加入足量AgNO3溶液,生成AgCl沉淀物质的量为_______。(不考虑盐酸的挥发)| A.等于0.15mol | B.小于0.15mol |
| C.大于0.15mol,小于0.3mol | D.以上结论都不正确 |
(3)若改用漂白粉与浓盐酸反应制备氯气,反应的化学方程式为
 。据此回答下列问题:装置如图所示,同时验证氯气性质(其中夹持装置已省略)
。据此回答下列问题:装置如图所示,同时验证氯气性质(其中夹持装置已省略)
①从反应条件看,MnO2和Ca(ClO)2的氧化能力不同,氧化能力较强的是
②装置B除了用于除去挥发的HCl,也是安全瓶,目的是监测实验进行时装置C中是否发生堵塞,请写出装置C中发生堵塞时装置B中的实验现象:
③装置C的作用是验证氯气是否具有漂白性,则装置C中Ⅰ、Ⅱ、Ⅲ处依次应放入的物质是
| 序号 | Ⅰ | Ⅱ | Ⅲ |
| a | 干燥的有色布条 | 碱石灰 | 湿润的有色布条 |
| b | 干燥的有色布条 | 无水硫酸铜 | 湿润的有色布条 |
| c | 湿润的有色布条 | 浓硫酸 | 干燥的有色布条 |
| d | 湿润的有色布条 | 无水氯化钙 | 干燥的有色布条 |
(4)用氯气对自来水消毒易产生致癌物质,二氧化氯是一种更为高效氨气的消毒剂。
 在杀菌消毒的过程中会生成副产物亚氯酸盐(
在杀菌消毒的过程中会生成副产物亚氯酸盐( ),需要将其转化为
),需要将其转化为 除去,下列试剂能实现其转化过程的是_______(填序号)。
除去,下列试剂能实现其转化过程的是_______(填序号)。A. | B. | C.KI | D. |
您最近一年使用:0次
名校
解题方法
2 . 室温下进行下列实验,根据实验操作和现象所得到的结论不正确的是
| 选项 | 实验操作和现象 | 实验目的或结论 |
| A | 向PbO2中滴加浓盐酸,出现黄绿色气体 | PbO2具有氧化性 |
| B | 向溶有SO2的BaCl2溶液中通入气体X,出现白色沉淀 | 气体X一定具有强氧化性 |
| C | 向FeSO4溶液中先加入KSCN溶液,无现象,再加入H2O2溶液,溶液变成血红色 | Fe2+具有还原性 |
| D | 向KI溶液中滴加几滴NaNO2溶液,再滴加淀粉溶液后变蓝色 |  的氧化性比I2的强 的氧化性比I2的强 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2022-08-26更新
|
345次组卷
|
5卷引用:新疆乌鲁木齐市新疆生产建设兵团第二中学2023-2024学年高一上学期期末考试化学试卷
名校
解题方法
3 . 下列方案设计、现象和结论都正确的是
| 目的 | 方案设计 | 现象和结论 | |
| A | 探究钠在氧气中燃烧所得固体成分 | 取少量加热后的固体粉末,加入少量蒸馏水 | 若有气泡产生,则证明燃烧后的固体粉末为Na2O2 |
| B | 比较KMnO4、Cl2 和Fe3+的氧化性 | 向酸性 KMnO4 溶液中滴入 FeCl2溶液,紫红色溶液变浅并伴有黄绿色气体产生 | 氧化性强弱:KMnO4>Cl2>Fe3+ |
| C | 制备 Fe(OH)3胶体 | 向沸水中滴加5~6滴FeCl3饱和溶液,继续煮沸至液体呈红褐色,停止加热。用红色激光笔照射液体 | 若产生一条光亮的“通路”,则得到Fe(OH)3 胶体 |
| D | 检验某溶液中是否存在K+ | 用玻璃棒蘸取待测液放在酒精灯外焰上灼烧,观察火焰的颜色 | 若看到火焰为黄色,则一定不存在 K+ |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2023-11-27更新
|
210次组卷
|
2卷引用:新疆乌鲁木齐八一中学2023-2024学年高一上学期1月月考化学试卷
名校
解题方法
4 . 高铁酸钠( )是一种新型绿色消毒剂,主要用于饮用水处理,工业上有多种制备高铁酸钠的方法,其中一种方法的化学反应原理可用离子方程式表示为
)是一种新型绿色消毒剂,主要用于饮用水处理,工业上有多种制备高铁酸钠的方法,其中一种方法的化学反应原理可用离子方程式表示为
 。回答下列问题:
。回答下列问题:
(1)上述反应中的
_______ ,
_______ 。
(2)写出方程式,并用单线桥表示出电子转移方向_______ 。
(3)亚硝酸钠( )是一种工业盐,某化学兴趣小组设计实验探究
)是一种工业盐,某化学兴趣小组设计实验探究 的性质。请完善表格中的实验现象和结论(已知
的性质。请完善表格中的实验现象和结论(已知 遇淀粉变蓝)。
遇淀粉变蓝)。
通过上述实验可知, 、
、 、
、 的氧化性由强到弱的顺序为
的氧化性由强到弱的顺序为_______ 。
 )是一种新型绿色消毒剂,主要用于饮用水处理,工业上有多种制备高铁酸钠的方法,其中一种方法的化学反应原理可用离子方程式表示为
)是一种新型绿色消毒剂,主要用于饮用水处理,工业上有多种制备高铁酸钠的方法,其中一种方法的化学反应原理可用离子方程式表示为
 。回答下列问题:
。回答下列问题:(1)上述反应中的


(2)写出方程式,并用单线桥表示出电子转移方向
(3)亚硝酸钠(
 )是一种工业盐,某化学兴趣小组设计实验探究
)是一种工业盐,某化学兴趣小组设计实验探究 的性质。请完善表格中的实验现象和结论(已知
的性质。请完善表格中的实验现象和结论(已知 遇淀粉变蓝)。
遇淀粉变蓝)。| 实验 | 实验操作及现象或结果 | 结论 |
| ① | 取5  溶液于试管中,加入少量 溶液于试管中,加入少量 溶液,充分反应后,再滴加淀粉溶液,溶液变蓝 溶液,充分反应后,再滴加淀粉溶液,溶液变蓝 |  具有 具有 |
| ② | 取2  溶液(先酸化好)于试管中,滴加足量的 溶液(先酸化好)于试管中,滴加足量的 溶液,可观察到的实验现象为 溶液,可观察到的实验现象为 |  具有还原性 具有还原性 |
| ③ |  固体与70%硫酸反应生成了 固体与70%硫酸反应生成了 和 和 两种气体 两种气体 |  具有 具有 |
 、
、 、
、 的氧化性由强到弱的顺序为
的氧化性由强到弱的顺序为
您最近一年使用:0次
5 . 实验小组制备高铁酸钾( )并探究其性质。
)并探究其性质。
资料: 为紫色固体,微溶于KOH溶液;具有强氧化性,在酸性或中性溶液中快速产生
为紫色固体,微溶于KOH溶液;具有强氧化性,在酸性或中性溶液中快速产生 ,在碱性溶液中较稳定。
,在碱性溶液中较稳定。
(1)制备 (夹持装置略)
(夹持装置略)
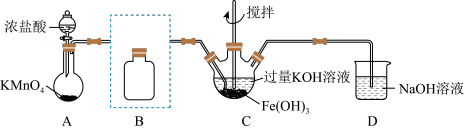
①A为氯气发生装置。A中反应离子方程式是_______
②除杂装置B的作用是:_______ 所用试剂为_______
③C中得到紫色固体和溶液。C中 发生的反应有:
发生的反应有: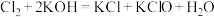 ,
, 。
。
(2)探究 的性质
的性质
①取C中紫色溶液,加入稀硫酸,产生黄绿色气体,得溶液a,经检验气体中含有 ,为证明是否
,为证明是否 氧化了
氧化了 而产生
而产生 ,设计以下方案:
,设计以下方案:
i.由方案Ⅰ中溶液变红可知a中含有 离子,但
离子,但 不一定是
不一定是 将
将 还原产生的,还可能由
还原产生的,还可能由_______ 产生(用离子方程式表示)。
ⅱ.方案Ⅱ可证明 氧化了
氧化了 ,用KOH溶液洗涤的目的是
,用KOH溶液洗涤的目的是_______ 。
②根据 的制备实验得出:氧化性
的制备实验得出:氧化性
_______  (填“>”或“<”),而方案Ⅱ实验表明,
(填“>”或“<”),而方案Ⅱ实验表明, 和
和 的氧化性强弱关系相反,原因是
的氧化性强弱关系相反,原因是_______ 。
 )并探究其性质。
)并探究其性质。资料:
 为紫色固体,微溶于KOH溶液;具有强氧化性,在酸性或中性溶液中快速产生
为紫色固体,微溶于KOH溶液;具有强氧化性,在酸性或中性溶液中快速产生 ,在碱性溶液中较稳定。
,在碱性溶液中较稳定。(1)制备
 (夹持装置略)
(夹持装置略)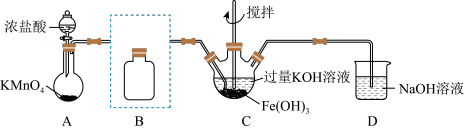
①A为氯气发生装置。A中反应离子方程式是
②除杂装置B的作用是:
③C中得到紫色固体和溶液。C中
 发生的反应有:
发生的反应有: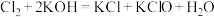 ,
, 。
。(2)探究
 的性质
的性质①取C中紫色溶液,加入稀硫酸,产生黄绿色气体,得溶液a,经检验气体中含有
 ,为证明是否
,为证明是否 氧化了
氧化了 而产生
而产生 ,设计以下方案:
,设计以下方案:| 方案Ⅰ | 取少量a,滴加KSCN溶液至过量,溶液呈红色 |
| 方案Ⅱ | 用KOH溶液充分洗涤C中所得固体,再用KOH溶液将 溶出,得到紫色|溶液b,取少量b,滴加盐酸,有 溶出,得到紫色|溶液b,取少量b,滴加盐酸,有 产生。 产生。 |
 离子,但
离子,但 不一定是
不一定是 将
将 还原产生的,还可能由
还原产生的,还可能由ⅱ.方案Ⅱ可证明
 氧化了
氧化了 ,用KOH溶液洗涤的目的是
,用KOH溶液洗涤的目的是②根据
 的制备实验得出:氧化性
的制备实验得出:氧化性
 (填“>”或“<”),而方案Ⅱ实验表明,
(填“>”或“<”),而方案Ⅱ实验表明, 和
和 的氧化性强弱关系相反,原因是
的氧化性强弱关系相反,原因是
您最近一年使用:0次
名校
6 . 已知无水 遇潮湿空气即产生大量白雾,实验室可用如图所示装置制备无水
遇潮湿空气即产生大量白雾,实验室可用如图所示装置制备无水 。请回答:
。请回答:
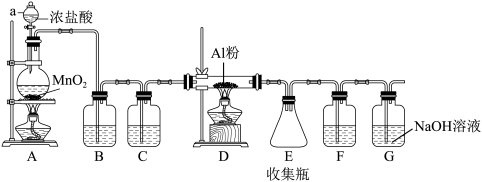
(1)仪器a的名称是___________ 。
(2)装置A中发生反应的化学方程式___________ 。
(3)装置B盛放的试剂是___________ ,它的作用除降低氯气在水中的溶解量外还可以___________ 。
(4)装置G的作用是___________ 。
(5)已知无水 遇潮湿空气,能发生复分解反应,产生大量的酸雾,请写出该反应的化学方程式
遇潮湿空气,能发生复分解反应,产生大量的酸雾,请写出该反应的化学方程式___________ 。
(6)已知氯酸钾和浓盐酸在不加热的条件下可以制备 ,比较
,比较 和
和 氧化性的强弱
氧化性的强弱
___________  (填“>”或“<”)。
(填“>”或“<”)。
 遇潮湿空气即产生大量白雾,实验室可用如图所示装置制备无水
遇潮湿空气即产生大量白雾,实验室可用如图所示装置制备无水 。请回答:
。请回答:
(1)仪器a的名称是
(2)装置A中发生反应的化学方程式
(3)装置B盛放的试剂是
(4)装置G的作用是
(5)已知无水
 遇潮湿空气,能发生复分解反应,产生大量的酸雾,请写出该反应的化学方程式
遇潮湿空气,能发生复分解反应,产生大量的酸雾,请写出该反应的化学方程式(6)已知氯酸钾和浓盐酸在不加热的条件下可以制备
 ,比较
,比较 和
和 氧化性的强弱
氧化性的强弱
 (填“>”或“<”)。
(填“>”或“<”)。
您最近一年使用:0次
2022-03-08更新
|
55次组卷
|
2卷引用:新疆乌苏市第一中学2021-2022学年高一下学期开学考试化学(A)试题
名校
解题方法
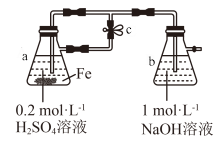
7 . 下列关于 、
、 性质实验的说法错误的是
性质实验的说法错误的是
 、
、 性质实验的说法错误的是
性质实验的说法错误的是
A.用上图装置可以制备 沉淀 沉淀 |
B. 溶液中滴加KI溶液,会有碘单质生成 溶液中滴加KI溶液,会有碘单质生成 |
| C.配制溶液所用的蒸馏水通常要煮沸 |
D.向 溶液中加入少量铁粉是为了防止 溶液中加入少量铁粉是为了防止 被氧化 被氧化 |
您最近一年使用:0次
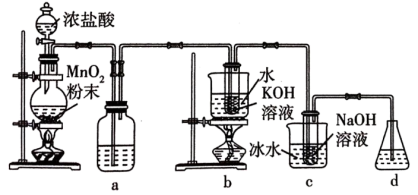
名校
8 . 氯可形成多种含氧酸盐,广泛应用于杀菌、消毒及化工领域。实验室中利用下图装置(部分装置省略)制备 和
和 ,探究其氧化还原性质。
,探究其氧化还原性质。
回答下列问题:
(1)盛放 粉末的仪器名称是
粉末的仪器名称是___________ ,a中的试剂为___________ 。
(2)b中采用的加热方式是___________ ,c中化学反应的离子方程式是___________ 。
(3)d的作用是___________ ,可选用试剂___________ (填标号)。
A. B.
B. C.
C. D.
D.
(4)取少量 和
和 溶液分别置于1号和2号试管中,滴加中性
溶液分别置于1号和2号试管中,滴加中性 溶液:
溶液:
1号试管溶液颜色不变。
2号试管溶液变为棕色,加入 振荡,静置后
振荡,静置后 层显
层显___________ 色。可知该条件下 的氧化能力
的氧化能力___________  (填“大于”或“小于”)。
(填“大于”或“小于”)。
 和
和 ,探究其氧化还原性质。
,探究其氧化还原性质。
回答下列问题:
(1)盛放
 粉末的仪器名称是
粉末的仪器名称是(2)b中采用的加热方式是
(3)d的作用是
A.
 B.
B. C.
C. D.
D.
(4)取少量
 和
和 溶液分别置于1号和2号试管中,滴加中性
溶液分别置于1号和2号试管中,滴加中性 溶液:
溶液:1号试管溶液颜色不变。
2号试管溶液变为棕色,加入
 振荡,静置后
振荡,静置后 层显
层显 的氧化能力
的氧化能力 (填“大于”或“小于”)。
(填“大于”或“小于”)。
您最近一年使用:0次
2021-10-13更新
|
287次组卷
|
3卷引用:新疆喀什莎车县第一中学2021-2022学年高二上学期期中考试化学试题
9 . 高铁酸钾(K2FeO4)是一种环保、高效、多功能饮用水的处理剂,制备流程如图所示:

某化学兴趣小组模拟上述流程,在实验室中探究制备K2FeO4的方法,回答下列问题:
查阅资料:K2FeO4具有强氧化性,在酸性或中性溶液中易快速产生O2,在碱性溶液中较稳定。
(1)反应Ⅲ中能够得到高铁酸钾的原因是___ 。
(2)若实验室用高锰酸钾与浓盐酸制取少量氯气,则反应的最佳装置应选用图中的___ (填标号),反应的离子方程式为___ 。
a.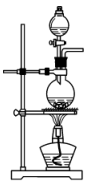 b.
b.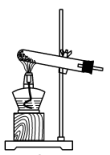
c.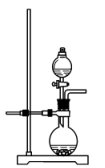 d.
d.
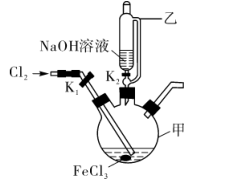
(3)制备K2FeO4的实验装置如图。装置中仪器乙的名称为____ ,实验时应先打开活塞K2的原因是____ ,为了提高氯气的利用率,可采取的措施是__ 。
(4)验证酸性条件下氧化性 >Cl2的实验方案为:取少量K2FeO4固体于试管中,
>Cl2的实验方案为:取少量K2FeO4固体于试管中,___ (实验中须使用的试剂和用品有:浓盐酸,NaOH溶液、淀粉KI试纸、棉花)。
(5)根据K2FeO4的制备实验得出:氧化性Cl2> ,和第(4)小题实验表明的Cl2和
,和第(4)小题实验表明的Cl2和 的氧化性强弱关系相反,原因是
的氧化性强弱关系相反,原因是___ 。

某化学兴趣小组模拟上述流程,在实验室中探究制备K2FeO4的方法,回答下列问题:
查阅资料:K2FeO4具有强氧化性,在酸性或中性溶液中易快速产生O2,在碱性溶液中较稳定。
(1)反应Ⅲ中能够得到高铁酸钾的原因是
(2)若实验室用高锰酸钾与浓盐酸制取少量氯气,则反应的最佳装置应选用图中的
a.
 b.
b.
c.
 d.
d.
(3)制备K2FeO4的实验装置如图。装置中仪器乙的名称为

(4)验证酸性条件下氧化性
 >Cl2的实验方案为:取少量K2FeO4固体于试管中,
>Cl2的实验方案为:取少量K2FeO4固体于试管中,(5)根据K2FeO4的制备实验得出:氧化性Cl2>
 ,和第(4)小题实验表明的Cl2和
,和第(4)小题实验表明的Cl2和 的氧化性强弱关系相反,原因是
的氧化性强弱关系相反,原因是
您最近一年使用:0次
2021-10-25更新
|
487次组卷
|
2卷引用:新疆喀什地区疏附县2022届高三下学期第一次模拟化学试题



